par Patrick PLA, Université Paris-Saclay
- Voie Wnt canonique
- Voies Wnt non canoniques
- Contrôle de la sécrétion et de la diffusion des Wnt
- Antagonistes et agonistes naturels et synthétiques de la voie Wnt
La voie de signalisation Wnt joue un rôle très important dans le développement animal, le maintien des cellules souches (dans l’intestin par exemple) et la cancérogenèse (Nusse et Clevers, 2017). En 1982, le ligand Wnt1 a été initialement identifié chez les vertébrés comme un oncogène du cancer du sein, avant que l’on se rende compte qu’il s’agissait d’un orthologue de Wingless connu chez la drosophile pour son rôle dans la polarisation des segments selon l’axe antéro-postérieur. 90% des cancers colorectaux sont causés par des altérations génétiques des facteurs de la voie Wnt (Cancer Genome Atlas). Par conséquent, les inhibiteurs chimiques de la signalisation Wnt présentent un énorme potentiel thérapeutique.
Les Wnts sont conservés chez tous les animaux métazoaires. Chez les Mammifères, la complexité et la spécificité de la signalisation Wnt sont en partie causées par l’existence de 19 ligands Wnt. Ce sont des protéines riches en cystéine d’environ 350-400 acides aminés qui contiennent un peptide signal N-terminal qui permet leur sécrétion. Ces protéines subissent des modifications post-traductionnelles, notamment une palmitoylation qui est essentielle à leur bon fonctionnement. Les récepteurs des Wnt, Frizzled (FZD) possèdent sept domaines transmembranaires et sont aussi diversifiés : il en existe 10 chez les Mammifères.
Voie Wnt canonique
L’interaction entre le ligand Wnt, le récepteur Frizzled et le co-récepteur LRP5 ou LPR6 active la signalisation Wnt. Le principal résultat de l’activation de cette voie est la stabilisation de l’activateur transcriptionnel β-caténine. La voie est donc connue sous le nom de signalisation canonique Wnt ou Wnt/β-caténine.
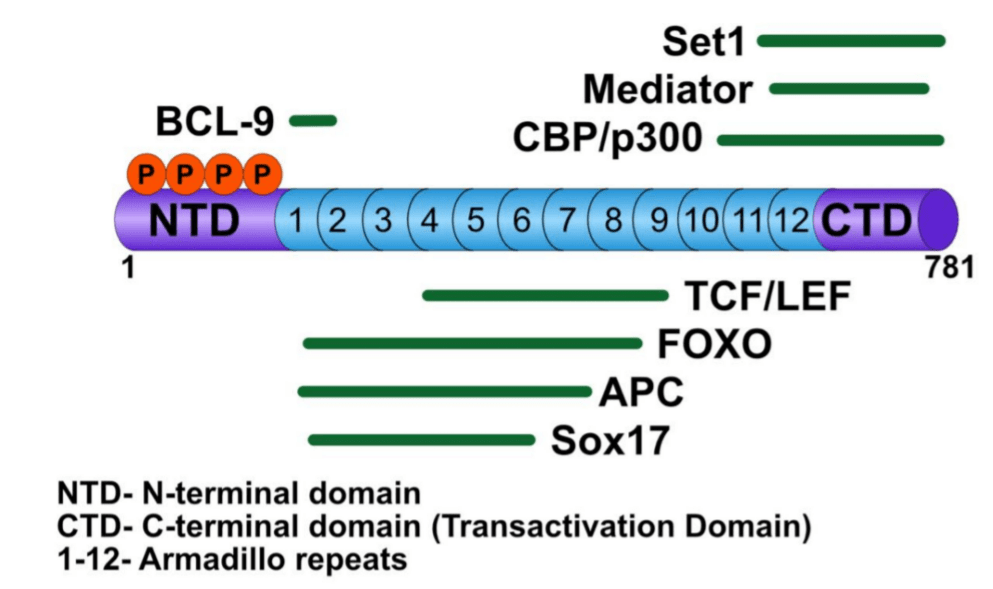
La β-caténine a un domaine central d’environ 530 acides aminés formé de 12 répétitions en tandem de type armadillo (ARM) flanqué à chaque extrémité de régions désordonnées d’environ 100 acides aminés. Elle est non seulement impliquée dans la voie Wnt canonique mais elle est aussi associée au complexe liant les cadhérines au réseau d’actine. La coordination et la répartition entre ces deux fonctions est encore mal comprise.
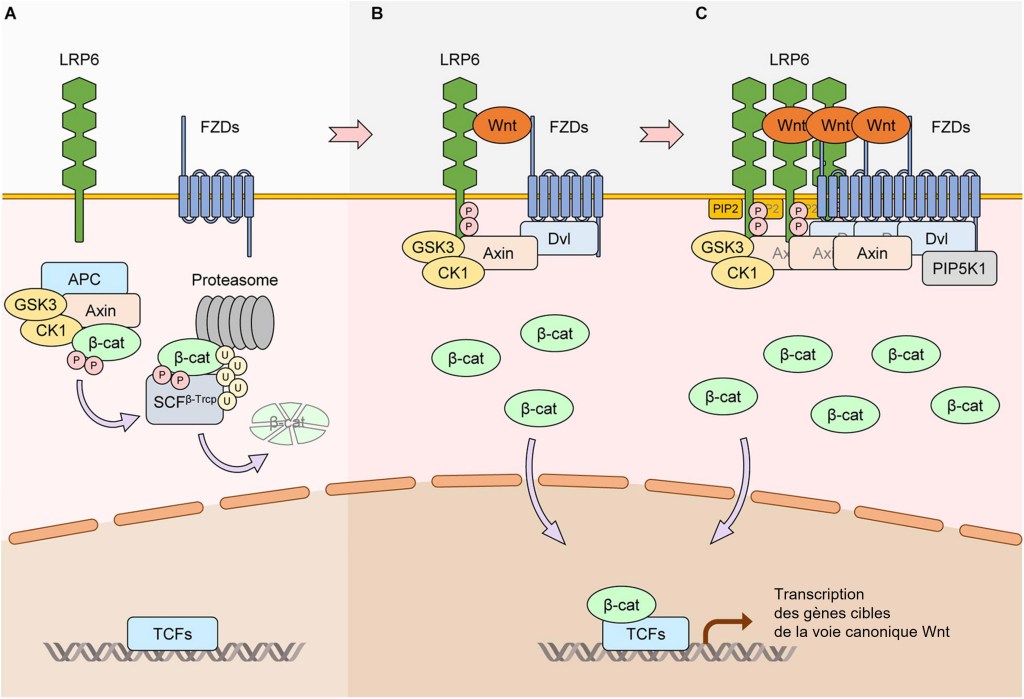
En l’absence de Wnt, la protéine d’échafaudage Axin forme un complexe de destruction avec la protéine Adenomatous Polyposis Coli (APC), la glycogène synthase kinase 3β (GSK3β) et la caséine kinase 1 alpha (CK1α) qui se lie à la β-caténine cytoplasmique. Celle-ci est alors phosphorylée sur des sérines et des thréonines par CK1α et GSK3β. La β-caténine phosphorylée est ubiquitinylée par le complexe ubiquitine ligase SCFβ-Trcp E3, un processus qui la cible pour la dégradation par le protéasome 26S.

Source : https://www.sciencedirect.com/science/article/pii/S0012160603001611

L’ubiquitination (ou ubiquitinylation) des protéines est une modification post-traductionnelle qui joue un rôle important. L’ubiquitine qui est un petit peptide de 76 acides aminés (8,5 kDa) est attachée sur des lysines de la protéine cible par une cascade de trois enzymes : d’abord l’enzyme d’activation de l’ubiquitine E1 (UBA), puis une enzyme de conjugaison de l’ubiquitine E2 (UBC) et enfin une ligase d’ubiquitine E3.

En présence de Wnt, Dishevelled se lie à un des domaines cytoplasmiques de Frizzled, puis le complexe de destruction de la β-caténine est recruté à la membrane plasmique par Dishevelled et LPRP5/6 et il est inactivé (Tauriello et al., 2012; Sharma et al., 2018).

En conséquence, la β-caténine est stabilisée puis transloquée vers le noyau où elle se fixe sur les facteurs de transcription de la famille LEF/TCF. Ce complexe active l’expression de gènes cibles impliqués dans la prolifération cellulaire, la différenciation, l’auto-renouvellement des cellules souches et de nombreux autres processus biologiques.
Pour vous tester, vous pouvez faire cet exercice sur la β-caténine
La dérégulation de la signalisation Wnt provoque des troubles du développement et plusieurs maladies telles que le cancer (Nusse et Clevers, 2017). Notamment, l’hyperactivation de la β-caténine, due à des mutations de APC, de AXIN ou du CTNNB1 (gène codant la β-caténine elle-même), est un facteur de risque important du cancer du côlon (Bugter et al., 2021).

Source : https://www.frontiersin.org/articles/10.3389/fonc.2021.653222/full
LRP5 (ou LRP6) est un co-récepteur pour Wnt pour activer la signalisation Wnt/β-caténine (Pinson et al., 2000; Tamai et al., 2000; Wehrli et al., 2000). Le domaine extracellulaire de LRP5/6 interagit avec Wnt et, avec Frizzled, active la cascade de signalisation Wnt/β-caténine. La protéine Dishevelled (DVL) est essentielle pour l’agrégation de LRP5/6 avec Frizzled induite par Wnt. LRP5/6 avec un domaine extracellulaire tronqué est constitutivement actif et peut activer la signalisation Wnt/β-caténine indépendamment de Wnt (Liu et al., 2003). A l’inverse, LRP5/6 avec un domaine intracellulaire tronqué agit comme une forme dominante-négative, inhibant la signalisation Wnt/β-caténine (Tamai et al., 2000). Il existe cinq motifs PPPS/TP dans le domaine intracellulaire LRP6, et les résidus sérine/thréonine dans ces motifs sont phosphorylés lors de la stimulation Wnt (Tamai et al., 2004). GSK3β et CK1γ sont les principales kinases qui phosphorylent respectivement les motifs PPPS/TP et leurs régions flanquantes en présence du ligand Wnt (Davidson et al., 2005 ; Zeng et al., 2005). Cela montre le rôle dual de GSK3β et CK1γ qui par leur phosphorylation de LPR5/6 stimulent la voie canonique Wnt et par leur phosphorylation de β-caténine l’inhibent. La fixation du ligand Wnt permet le basculement du deuxième mode vers le premier mode.

Un autre acteur important dans le signalosome est PIP5K1, une phosphatidylinositol phosphate kinase dont l’activation est médiée par Frizzled et Dishevelled (Pan et al., 2008). L’activation de PIP5K1 conduit à la production de phosphatidylinositol 4,5-bisphosphate (ptdIns(4,5)P2), qui à son tour induit l’agrégation et la phosphorylation de LRP6 (Pan et al., 2008). Par conséquent, les composants non protéiques tels que les phospholipides jouent également un rôle crucial dans la signalisation Wnt/β-caténine médiée par LRP6.
Le résultat final de l’activation de la cascade de signalisation Wnt est un échappement de la β-caténine de son complexe de destruction, lui permettant de s’accumuler dans le cytoplasme puis de se déplacer vers le noyau (Cselenyi et al., 2008; Wu et al., 2009). Une fois dans le noyau, β-caténine ne se fixe pas directement à l’ADN et ne peut ainsi pas être considéré comme un facteur de transcription. Elle va interagir avec des facteurs de transcription TCF/LEF qui, eux, se fixent à l’ADN au niveau de séquences-cibles. Les facteurs TCF/LEF inhibent la transcription des gènes cibles en l’absence de signal Wnt. Après stimulation cellulaire par les ligands Wnt, l’accumulation de la β-caténine dans le noyau déloge un corépresseur transcriptionnel appelé Groucho de la liaison avec TCF (Arce et al., 2009 ; Daniels et Weis, 2005).

Les mutations dans TCF7L2 qui code TCF4 sont impliquées dans de nombreux types de cancers et elles favorisent la migration et l’invasion des cellules cancéreuses colorectales humaines. Parmi les cibles de β-caténine/LEF-TCF on trouve l’oncogène c-Myc et aussi la cycline D1 qui est impliquée dans la progression à travers la phase G1 du cycle cellulaire vers la phase S.
Dans les embryons de vertébrés, les quatre homologues du TCF sont fonctionnellement spécialisés. Alors que certains membres de la famille TCF, tels que LEF1, sont nécessaires pour l’activation de la transcription (Arce et al., 2006 ; Galceran et al., 1999), TCF3 réprime de nombreux gènes (Cole et al., 2008; Houston et al., 2002 ; Kim et al., 2000). Le poisson zèbre déplété en TCF3 présente un défaut crânien antérieur, qui peut être sauvé par un forme constitutive répresseur du TCF3 (Kim et al., 2000).

Des expériences de perte de fonction sur le xénope révèlent les rôles opposés de la β-caténine et de TCF3 dans la spécification des axes dorsoventral et antéropostérieur (Houston et al., 2002 ; Liu et al., 2005).
Semblable aux embryons de Xenopus appauvris en TCF3, les souris mutantes pour le gène Tcf3 présentent un mésoderme axial élargi et une perte de tissus nerveux antérieurs; ces défauts peuvent être en grande partie sauvés par l’expression d’une construction TCF3 répressive dépourvue du domaine d’interaction avec la β-caténine (Merrill et al., 2004). Ainsi, TCF3 est un cas particulier parmi les facteurs LEF/TCF et joue le rôle d’inhibiteur de la voie Wnt.
Signalons que β-caténine ne se fixe pas qu’à des facteurs LEF/TCF mais aussi à d’autres protéines formant un véritable centre d’activation transcriptionnel.
Voies Wnt non canoniques
Dishevelled est un composant de la voie Wnt-Wingless qui est impliqué à la fois dans la voie canonique et dans les voies non canoniques. Initialement, Dishevelled a été appelé ainsi à cause du mutant perte-de-fonction chez la drosophile où les soies présentes à la surface de l’aile sont désorientées (et non pas alignées les unes par rapport aux autres comme d’habitude) ce qui indique un problème de polarité cellulaire planaire.
La polarité cellulaire planaire (PCP) fait référence à la polarisation collective des cellules le long d’un plan tissulaire, typiquement dans un tissu épithélial sur un plan perpendiculaire à l’axe apico-basal. Elle est contrôlée par un ensemble conservé de protéines associées à la membrane connue sous le nom de voie PCP centrale (Yang et Mlodzik, 2015; Strutt et al., 2016; Butler et Wallingford, 2017). La voie PCP dirige un large éventail de comportements cellulaires polarisés dans une grande variété de tissus, notamment les battements ciliaires dirigés, la motilité cellulaire collective et l’alignement des soies à la surface de la cuticule des Insectes et des poils sur la surface de la peau des Mammifères (Niessen et al., 2012; Devenport, 2014; Davet et al., 2017).

La voie de la PCP est essentielle au développement embryonnaire, et la perturbation génétique de la PCP entraîne de graves anomalies du développement, notamment des anomalies du tube neural et des cardiopathies congénitales (Curtin et al., 2003 ; Phillips et al., 2007 ; Wang et al., 2019). La voie de la PCP est aussi impliquée dans la mise en place de la polarité neuronale et dans le guidage axonal (He et al., 2018) et également dans la tumorigenèse (Zhan et al., 2016).
La PCP requiert les fonctions de plusieurs protéines centrales conservées, Prickle, Van Gogh/Strabismus (ou Vangl), Dishevelled (Dvl), Frizzled (Fzd) et Flamingo/Stan, identifiées à l’origine dans des études génétiques chez la drosophile. Dans les tissus épithéliaux de la drosophile, la PCP se manifeste par la distribution des complexes membranaires Frizzled/Dishevelled et Prickle/Van Gogh dans des domaines opposés à l’intérieur de chaque cellule (Adler, 2012; McNeill, 2010; Peng et Axelrod, 2012).


Le complexe Frizzled/Dishevelled induit une cascade de signalisation médiée par la voie non canonique qui provoque l’activation des petites GTPases Rho et Rac qui contrôlent l’arrangement du cytosquelette et notamment des microfilaments d’actine (Fanto et al., 2004; Habas et al., 2001).
Wnt5a est un ligand activant la voie PCP. Il interagit avec la région extracellulaire de LRP6 et cette interaction inhibe l’activation de Rac1, une protéine cible de la signalisation Wnt non canonique (Bryja et al., 2009). De plus, Wnt5a interfère avec l’interaction entre Wnt3a et LRP6, entraînant également l’inhibition de la signalisation Wnt/β-caténine (Bryja et al., 2009; Grumolato et al., 2010).
Le mécanisme moléculaire du choix de l’activation de la voie canonique ou d’autres voies après fixation du ligand WNT à ses récepteurs est encore mal compris. On sait que parmi les 19 ligands Wnt identifiés chez les Mammifères, certains d’entre eux, Wnt1, Wnt3a et Wnt8, activent préférentiellement Wnt/β-caténine tandis que d’autres, Wnt5a et Wnt11, activent principalement la voie Wnt/PCP. Ror1/2 est un récepteur tyrosine kinase qui a un domaine extracellulaire riche en cystéine de type Frizzled et il est un co-récepteur impliqué dans la réception du signal Wnt pour activer la voie PCP. Le choix des voies canonique ou PCP se fait sans doute par des affinités différentielles entre LPR5/6 et Ror1/2.
De manière intéressante, la localisation du facteur de transcription GRHL3 détermine le passage de la voie Wnt canonique à la voie Wnt/PCP au cours du développement. Lorsqu’il est dans le noyau, GRHL3 favorise l’activité de la voie Wnt/β-caténine qui accompagne la détermination de l’épiderme à partir de l’ectoderme et lorsqu’il passe dans le cytoplasme, GRHL3 stimule la voie Wnt/PCP qui intervient dans la morphogenèse de l’épithélium épidermique et dans sa polarité (Kimura-Yoshida et al., 2022).

Le syndrome de Robinow est une maladie génétique causant des malformations squelettiques, génitales et rénales. Il y a une grande variété de génotypes aboutissant à ce syndrome mais toutes les mutations découvertes résident dans des gènes de la voie de signalisation Wnt non canonique, notamment ROR2, WNT5A et aussi DVL1 (Dishevelled1) et DVL3 (Person et al., 2009). Ces données soutiennent l’hypothèse selon laquelle le syndrome de Robinow résulte d’une perturbation de la voie Wnt/PCP. Les défauts cranio-faciaux observés chez les patients et l’expression de ROR2 lors de la spécification et de la migration des crêtes neurales céphaliques qui forment une bonne partie du squelette cranio-facial sont sans doute liés (Schille et al., 2016).

Une autre voie non canonique aboutit à l’augmentation de la concentration de Ca2+ dans le cytoplasme. Les Wnt se fixent alors au co-récepteur tyrosine kinase Ryk. Chez la drosophile, l’orthologue de Ryk, Derailed, est impliqué dans la répulsion des axones en croissance par Wnt5 (Yoshikawa et al., 2003).
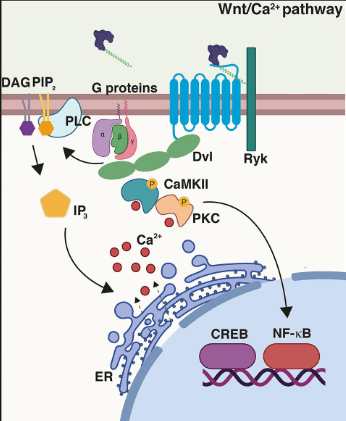
Contrôle de la sécrétion et de la diffusion des Wnt
La molécule de drosophile Wingless (Wg) est la molécule de la famille WNT la plus étudiée in vivo (Hausmann et al., 2007). Ces études ainsi que les travaux sur C. elegans ont identifié des gènes qui régulent la biogenèse des Wnt et leur sécrétion. Le gène Porcupine code une protéine transmembranaire du RE (Reticulum Endoplasmique) qui contient un domaine O-acyl transférase, qui a un rôle dans la modification post-traductionnelle de Wg impliquant un transfert d’acyl qui aboutit à une palmitoylation (ou palmitylation) (Hausmann et al., 2007). Une déplétion de Porcupine entraîne une diminution de la palmitoylation de Wg et WNT3A sur la sérine 209 et une accumulation de Wg et de WNT3A dans le RE qui aboutit à une diminution de leur sécrétion (Takada et al., 2006).
Deux autres complexes protéiques qui contrôlent la sécrétion de Wnt/Wg ont été identifiés. Wntless (Wls), également connue sous le nom de Evenness interrupted (Evi) ou Sprinter (Srt), chez la drosophile, et le complexe rétromère chez les nématodes (Hausmann et al., 2007). Les mutants porcupine, wls et retromer phénocopient les mutant Wg/Wnt mutants chez la drosophile et C. elegans, attestant de leurs rôles essentiels dans la biogenèse Wnt.
Wls est une protéine à plusieurs domaines transmembranaires localisée dans l’appareil de Golgi, les compartiments endocytaires et la membrane plasmique et est essentielle pour la sécrétion de Wg.
Le complexe rétromère, composé de cinq sous-unités, a d’abord été étudié chez la levure. Il médie le trafic membranaire des protéines entre les endosomes et l’appareil de Golgi (Hausmann et al., 2007).

Le complexe rétromère est requis pour la récupération/le recyclage des Wls de l’endosome au Golgi (Belenkaya et al., 2008 ; Franch-Marro et al., 2008 ; Pan et al., 2008 ; Port et al., 2008), qui est probablement médiée par une interaction directe entre Wls et la sous-unité du rétromère Vps35. La perte de fonction du rétromère provoque la dégradation de Wls dans les lysosomes et aboutit à la réduction de la sécrétion de Wls et donc de Wg/Wnt. Ces études ont conduit au modèle suivant : Wnt est glycosylé et ses résidus lipidiques sont modifiés par Porcupine, et il est escorté par Wls du Golgi à la membrane plasmique pour la sécrétion. Wls est recyclé par endocytose et renvoyé au Golgi par le complexe rétromère.
La visualisation des ligands Wnt est essentielle pour comprendre leur distribution. Dans le disque alaire de la drosophile, les protéines Wg sont largement distribuées à partir des cellules marginales des ailes, où Wg est exprimé (Strigini et Cohen, 2000; Zecca et al., 1996). En outre, la dispersion à longue distance de Wg a été mise en évidence par une expérience dans laquelle Wg a été capturé par Frizzled2 (un de ses récepteurs) exprimé de manière distale (Chaudhary et al., 2019). De même, les ligands Wnt endogènes marqués avec des protéines fluorescentes ont montré des distributions à longue distance chez C. elegans (Pani et Goldstein, 2018).

En plus de ces observations chez les invertébrés, les ligands Wnt8 endogènes se dispersent loin de leurs cellules sources dans les embryons de Xenopus (Mii et al., 2017). D’autre part, chez la souris, Wnt3 s’accumule à quelques diamètres de cellules de ses cellules sources dans le microenvironnement de l’intestin (Farin et al., 2016). Ces études montrent que les ligands Wnt se dispersent bien dans les tissus et les embryons, bien que la plage de dispersion varie.
Les molécules de surface cellulaire, par exemple les protéoglycanes de sulfate d’héparane (HS) (HSPG), ont également un rôle important dans la distribution et la signalisation de Wnt. Les HSPG se composent d’une protéine centrale et de plusieurs chaînes de glycosaminoglycane HS (GAG). Parmi les HSPG, la protéine centrale glypicane et les chaînes HS sont nécessaires à la distribution et à la signalisation de Wg chez la drosophile.
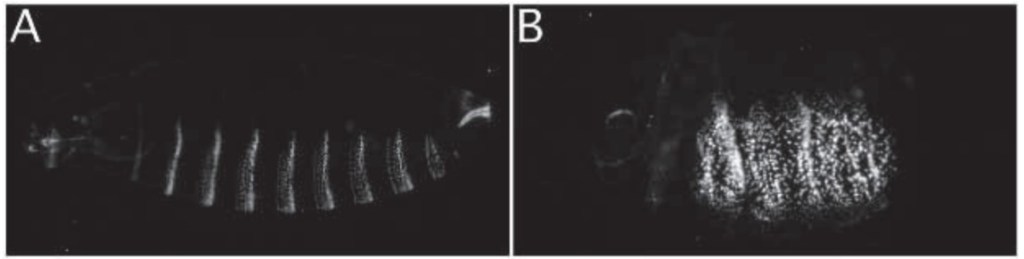
Source : https://journals.biologists.com/dev/article/124/18/3565/39459/The-Drosophila-sugarless-gene-modulates-Wingless
Antagonistes et agonistes naturels et synthétiques de la voie Wnt
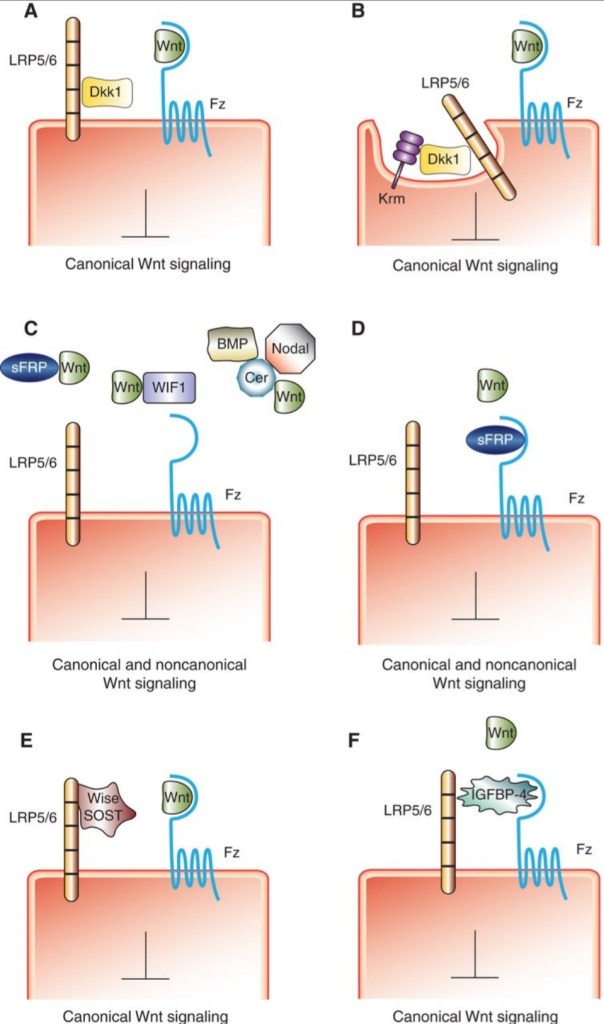

Cerberus est nécessaire à la formation de la tête chez les vertébrés. De même que Dkk1 ou Dickkopf-1 qui est un ligand de haute affinité pour LRP6, le co-récepteur de Wnt (aux côtés de Frizzled). La fixation de Dkk1 empêche Wnt d’interagir avec LRP6 et donc Dkk-1 est un antagoniste de la voie Wnt (Mao et al., 2001 ; Semenov et al., 2001; Bafico et al., 2001). Au début du développement des vertébrés, Dkk1 est exprimé dans l’endomesoderme antérieur et joue un rôle important dans la mise en place de l’axe antéro-postérieur en inhibant la signalisation Wnt/LRP6 dans l’organisateur de la tête et la plaque précordale (Glinka et al., 1998 ; Hashimoto et al., 2000 ; Shinya et al., 2000 ; Mukhopadhyay et al., 2001).
Les autres récepteurs de Dkk sont les protéines transmembranaires Kremen1 et 2 (Krm1 et 2, appelés collectivement Krms). Dkk1 forme un complexe ternaire complexe avec Krm1 ou 2 et LRP6, qui est éliminé de la surface de la cellule par endocytose, arrêtant ainsi la transduction du signal Wnt (Mao et al., 2002). Chez le Xénope, Krms et Dkk1 sont co-exprimés dans la plaque précordale et coopèrent fonctionnellement dans l’inhibition de Wnt pour réguler la mise en place de l’axe antéro-postérieur dans le tube neural (Davidson et al., 2002). Krm1 est aussi nécessaire à la formation du thymus chez la souris en agissant comme inhibiteur de Wnt (Osada et al., 2006).

Dans les embryons de xénope, Krm2 est exprimé dans diverses régions qui n’expriment pas Dkk1 (Davidson et al., 2002), notamment dans les cellules de crêtes neurales. L’expression de Krm2 est activée par Wnt et est requis pour la formation des crêtes neurales. Dans ce cas, en absence de Dkk1, Krm2 stimule la signalisation Wnt et favorise, via une liaison directe, la localisation à la surface cellulaire de LRP6. Ces résultats montrent que Krms agit comme inhibiteur ou activateur de la signalisation Wnt en fonction de la présence ou de l’absence de Dkk.
Bighead est un autre antagoniste de la voie Wnt. Il ressemble dans son mode d’action à Dkk. Il est produit par l’organisateur de Spemann et se fixe sur LPR6 ce qui aboutit à son endocytose et donc à l’absence de possibilité pour Wnt d’activer correctement ses cellules cibles (Ding et al., 2018). Comme pour Dkk, son action est nécessaire pour qu’une tête normale se forme. Attention, parfois l’endocytose peut au contraire stimuler la voie Wnt comme c’est le cas dans les cellules de crêtes neurales (Piacentino et al., 2022).

Les protéines sécrétées Frizzled-related (sFRP) dont Frzb se lient à Wnt et l’empêchent d’activer ses récepteurs. Cela joue un rôle dans de nombreux processus développementaux, par exemple la mise en place de l’épithélium stomacal et intestinal.

Autres antagonistes de la voie Wnt, les ligases E3 transmembranaires ZNRF3/RNF43 qui ubiquitinylent et provoquent l’internalisation et la dégradation de Frizzled et de LRP6. ZNRF3/RNF43 sont activés par la voie de signalisation Wnt elle-même ce qui montre qu’il s’agit d’une boucle de rétroaction négative (Koo et al., 2012).

Des mutations perte-de-fonction de ZNRF3/RNF43 sont observées dans 5 à 10% des cancers pancréatiques, aboutissant à une suractivation de la voie Wnt (Jiang et al., 2013).
Les ligands R-spondine se fixent sur leur récepteur LGR4/5/6 et séquestrent ZNRF3/RNF43, conduisant à la clairance membranaire de ZNRF3/RNF43 (Carmon et al., 2011 ; Glinka et al., 2011 ; Koo et al., 2012). Ainsi, les R-spondines augmentent l’abondance membranaire des récepteurs Wnt et potentialisent la signalisation Wnt.
LGR5 est une protéine intéressante. Son gène a été identifié initialement comme une cible de la voie Wnt dans les cellules souches intestinales (elle est un marqueur classique qui permet d’identifier ces cellules). C’est une protéine à 7 domaines transmembranaires de la famille des rhodopsines. Le fait que ce soit un récepteur de la R-spondine qui potentialise la signalisation Wnt montre qu’une boucle de rétroaction positive est à l’œuvre dans les cellules souches de l’intestin (de Lau et al., 2014)

Notum est un autre inhibiteur de la voie Wnt et il agit sous la forme d’une boucle de régulation négative car sa sécrétion est activée par la voie Wnt. Il agit en tant que carboxyestérase et il dépalmitoyle Wnt (Kakugawa et al., 2015). La palmitoylation est nécessaire à la fixation de Wnt à Frizzled donc cela inhibe la réception du signal Wnt.

De nombreux petites molécules chimiques inhibitrices ou activatrices de la voie Wnt ont été découvertes ces dernières années. Elles sont importantes pour manipuler la voie Wnt, notamment dans les protocoles de différenciations des cellules souches pluripotentes mais aussi pour développer des traitements anti-cancéreux (Bayle et al., 2021).

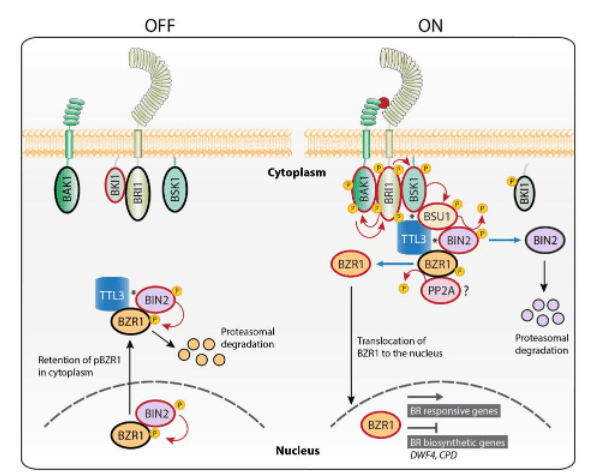
Signalons qu’une voie de signalisation chez les végétaux ressemble à la voie Wnt : la voie activée par les brassinostéroïdes. En absence de ligand, un orthologue de GSK3 appelé BIN2 phosphoryle un co-facteur de transcription appelé BZR1 (qui n’a rien à voir évolutivement avec la β-caténine) et l’empêche de s’accumuler dans le noyau. La fixation d’un brassinostéroïdes rend BIN2 inactif et permet à BZR1 de s’accumuler dans le noyau et de réguler la transcription. Cette voie joue un rôle dans l’élongation des cellules et aussi du tube pollinique et pour la différenciation des faisceaux vasculaires.
VOIR DES EXERCICES SUR LES VOIES DE SIGNALISATION
- Adhérences cellule-cellule
- Arabidopsis thaliana
- Axe antéro-postérieur chez la drosophile
- Biomécanique du développement
- Caenorhabditis elegans
- Concepts principaux
- Contrôle de la traduction
- Contrôle de la transcription
- Contrôle génétique et épigénétique
- Croissance du tube pollinique et double fécondation chez les Angiospermes
- Croissance et guidage axonal
- Des modèles animaux moins classiques
- Développement de l’oeil des Vertébrés
- Développement et évolution
- Et l’Humain ?
- Exercices sur l’ovogenèse, la spermatogenèse et la fécondation
- Exercices sur le contrôle de l’expression des gènes
- Exercices sur le développement des bourgeons de membre
- Exercices sur le développement des muscles striés squelettiques
- Exercices sur le développement des végétaux et les hormones végétales
- Exercices sur les cycles et les divisions cellulaires
- Exercices sur les étapes du développement, les inductions embryonnaires et la mise en place des axes de polarité
- Exercices sur les matrices extracellulaires, le cytosquelette et les adhérences cellule-cellule
- Exercices sur les voies de signalisation
- Glossaire
- Glossaire des termes liés à la génétique
- Glossaire des termes liés au cytosquelette, la matrice extracellulaire, l’adhérence et la migration cellulaire
- Hématopoïèse et développement des cellules du système immunitaire
- Histoire de la biologie cellulaire et de la biologie du développement
- L’acide rétinoïque
- L’apoptose
- L’autophagie
- L’organogenèse
- L’ovogénèse prépare le développement embryonnaire
- La drosophile
- La fécondation
- La formation des somites
- La gastrulation
- La gastrulation (version allégée)
- La métamorphose chez les Hexapodes et les Amphibiens
- La neurogénèse chez les mammifères adultes
- La neurulation
- La poule
- La signalisation calcique
- La souris
- La superfamille TGFβ et ses voies de signalisation
- La voie de signalisation de l’auxine et ses rôles
- La voie de signalisation Hedgehog
- La voie de signalisation Hippo et ses composants YAP/TAZ
- La voie de signalisation Notch
- Le clivage
- Le cytosquelette
- Le destin des cellules et les réseaux de régulation génique
- Le développement des bourgeons de membre
- Le développement des muscles striés squelettiques
- Le développement des organes génitaux et des cellules germinales
- Le développement du cortex
- Le méristème apical caulinaire en phase végétative et lors de la formation d’une fleur
- Le poisson zèbre
- Le xénope
- Les cellules des crêtes neurales
- Les cellules et les gènes en action dans le développement
- Les cellules souches
- Les cellules tumorales
- Les cycles et les divisions cellulaires
- Les étapes du développement
- Les étapes du développement embryonnaire d’Arabidopsis thaliana et leur contrôle
- Les inductions embryonnaires et les gradients de morphogène
- Les matrices extracellulaires animales
- Les organismes modèles
- Les outils pour étudier l’expression et la fonction des gènes
- Les parois des cellules végétales
- Les techniques et les outils pour la biologie cellulaire
- Les transitions épithélio-mésenchymateuses et les migrations cellulaires
- Les vésicules extracellulaires
- Les voies de signalisation
- Les voies de signalisation FGF
- Mise en place des axes chez les Vertébrés
- Structures et processus cellulaires
