Par Patrick Pla, Université Paris-Saclay
- Quiescence ou prolifération ? : entrée et progression dans la phase G1
- Réplication de l’ADN et progression en phase G2
- La mitose et le contrôle de ses étapes
- Les particularités des divisions des cellules végétales
- Les particularités de la méiose
- Maintien de l’identité des cellules durant la division
- La polyploïdisation
- Les divisions asymétriques
Les êtres vivants ont la capacité de se reproduire. Les cellules qui constituent les unités de base du vivant ne font pas exception. Leur prolifération doit cependant être régulée au cours du développement puis au cours de l’homéostasie tissulaire des organismes pluricellulaires de telle manière à obtenir un ensemble harmonieux et fonctionnel. Des anomalies de ces contrôles peuvent aboutir à des tumeurs.

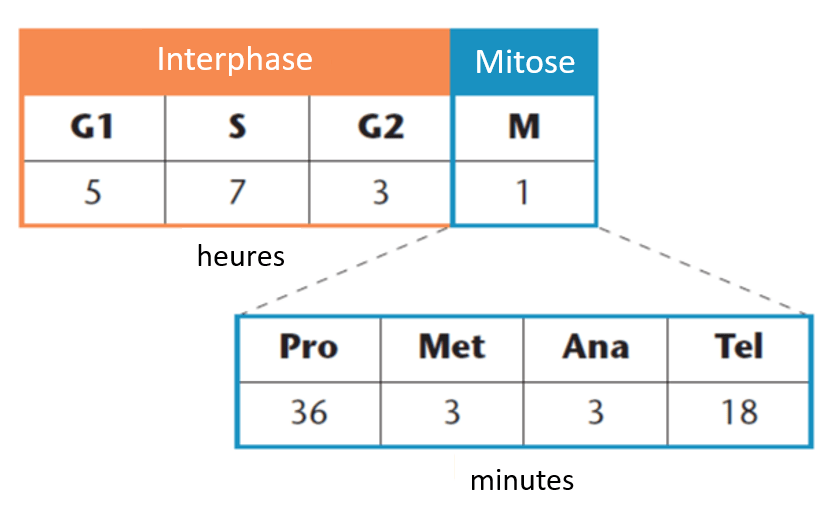
Le cycle cellulaire est un processus étroitement régulé composé de quatre phases : G1, S (phase de réplication), G2 et M (mitose). Aux premiers stades du cycle cellulaire, une présence continue de facteurs de croissance et de nutriments est requise jusqu’à ce que le point de restriction G1 soit atteint, après quoi les cellules sont engagées dans un programme de division cellulaire. Le point de contrôle G2/M sert à s’assurer que tout l’ADN a bien été répliqué et le point de contrôle métaphase/anaphase permet d’assurer une distribution précise du matériel génétique entre les deux cellules filles.

Après la division, chaque cellule peut soit répéter le cycle, soit entrer dans un état de repos appelé G0 (quiescence).
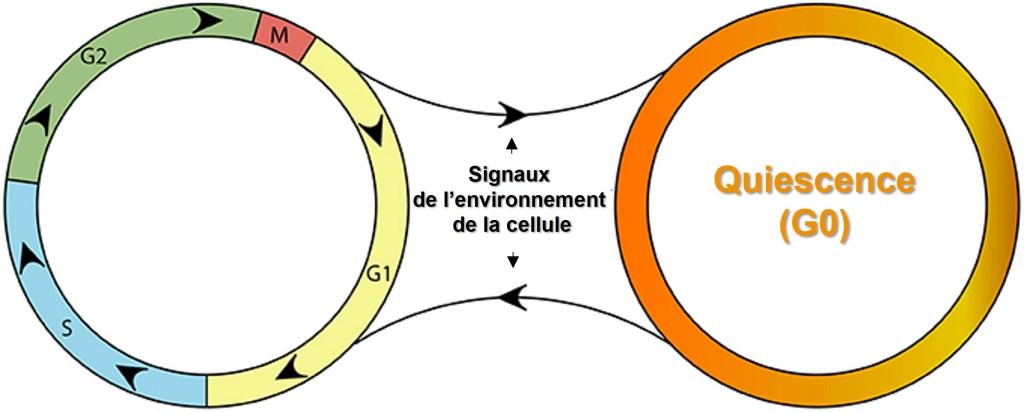
Les cellules entrent dans G0 juste avant la différenciation ou en réponse à l’absence de facteurs de croissance ou en réponse à un stress génotoxique. La quiescence implique un arrêt temporaire du cycle cellulaire. Une perte définitive de la capacité de prolifération s’appelle la sénescence, et concerne par exemple la plupart des cellules différenciées.
Quiescence ou prolifération ? : entrée et progression dans la phase G1
Le fait qu’une cellule entre dans G0 ou passe par G1 pour continuer le cycle est dicté par la régulation de plusieurs facteurs clés, notamment les cyclines et les kinases dépendantes des cyclines (CDK), les inhibiteurs de CDK et la protéine du rétinoblastome (Rb). Les complexes cycline-CDK entraînent la progression du cycle cellulaire par la phosphorylation des protéines impliquées dans chacune des phases du cycle cellulaire (Malumbres, 2014).
Les kinases dépendantes des cyclines (CDK) sont des sérine/thréonine kinases (elles phosphorylent des sérines et/ou des thréonines sur leurs protéines-cibles; ces sérines ou thréonines sont très souvent suivies d’une proline). Leur activité kinase dépend d’une sous-unité régulatrice, une cycline. Sur la base de la séquence du domaine kinase, les CDK appartiennent au groupe de kinases CMGC (du nom des initiales de certains membres), avec les protéines kinases activées par les mitogènes (MAPK) et la glycogène synthase kinase-3 béta (Gsk3β).
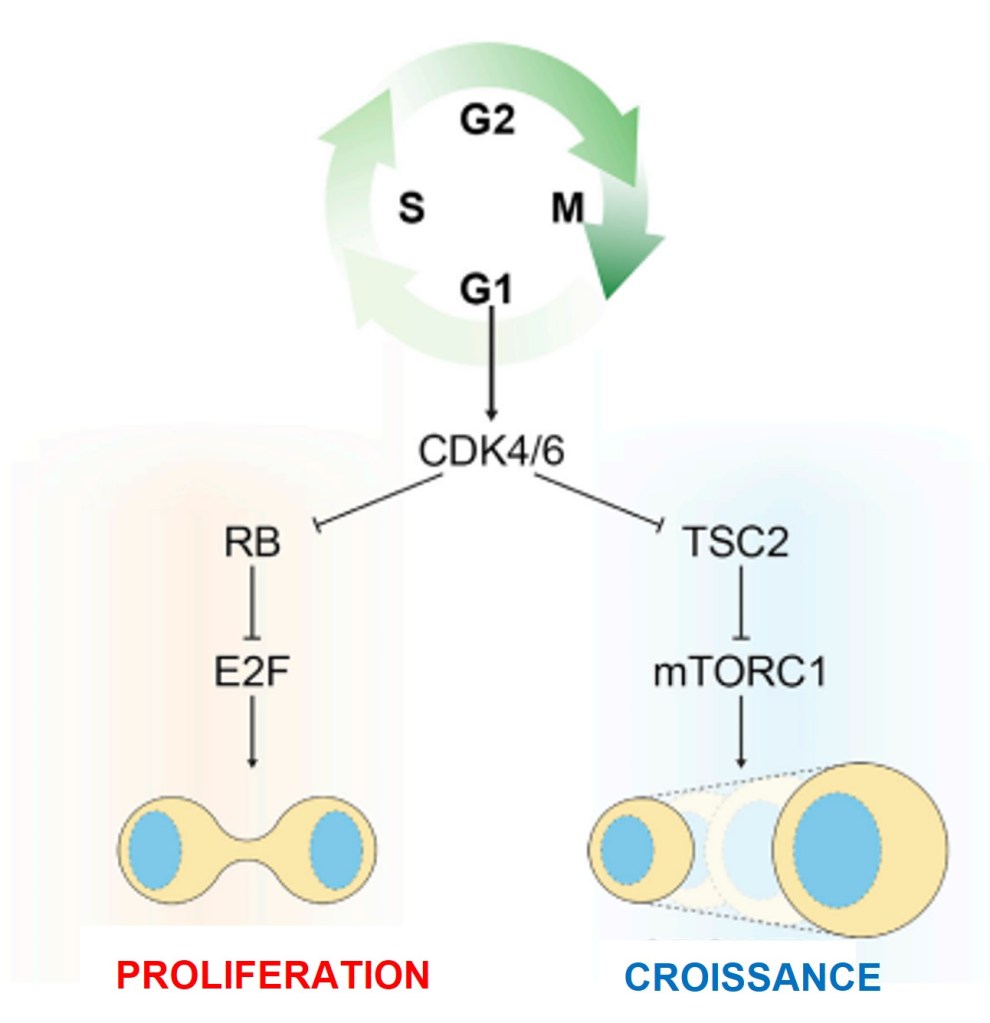
Les complexes cycline D-CDK4/6 et cycline E-CDK2 favorisent la progression dans G1 (Aktas et al., 1997). Ainsi, des niveaux élevés de cycline D ou de cycline E et de CDK4/6 augmentent la prolifération en entraînant le passage à travers la phase G1. A l’inverse, des stimuli qui diminuent l’abondance et l’activité de ces protéines induisent une quiescence (Aktas et al., 1997). CDK4/6 peut aussi agir sur la croissance cellulaire en activant mTORC1, une kinase qui stimule l’anabolisme (production de nouvelles molécules) et inhibe le catabolisme (destruction de molécules). Elle active mTORC1 en inhibant un de ses inhibiteurs, TSC2. CDK4/6 couple ainsi croissance et division cellulaire (Romero-Pozuelo et al., 2020).
De nombreuses voies de signalisation peuvent faciliter la progression de la cellule en G1. Akt est une sérine/thréonine kinase activée par des voies de signalisation en provenance de nombreux récepteurs de facteurs de croissance (par exemple les FGF). Akt a de multiples effets pour aboutir à une stimulation de l’avancée dans le cycle : augmentation de la transcription de cycline D1 via l’inhibition de GSK3β et l’entrée dans le noyau de la β-caténine qui s’associe avec les facteurs de transcription LEF/TCF, augmentation de la traduction de l’ARNm de cycline D1 via la voie mTOR. Akt fait également sortir du noyau des inhibiteurs de la progression du cycle tels p21 et p27, qui sont des inhibiteurs de CDK.

p21 (CDKN1A), p27 (CDKN1B) et p57 (CDKN1C) sont des inhibiteurs de CDK (ou CKI) qui favorisent la quiescence, et effectivement les cellules quiescentes présentent généralement des niveaux élevés de ces protéines (Aktas et al., 1997 ; Barr et al., 2017 ; Cheung et Rando, 2013 ; Fujimaki et al., 2019). Par exemple, p27 est fortement exprimé pendant la quiescence dans les fibroblastes en culture (Oki et al., 2014). Des diminutions de l’activité ou des niveaux d’inhibiteurs de CDK peuvent conduire à la sortie de la quiescence et à la réentrée dans le cycle cellulaire (Arora et al., 2017; Urban et al., 2021).

Ainsi, en raison du rôle régulateur critique de ces facteurs du cycle cellulaire, les signaux d’induction de la quiescence agissent généralement pour diminuer l’activité cycline-CDK ou augmenter les niveaux d’inhibiteur de CDK.
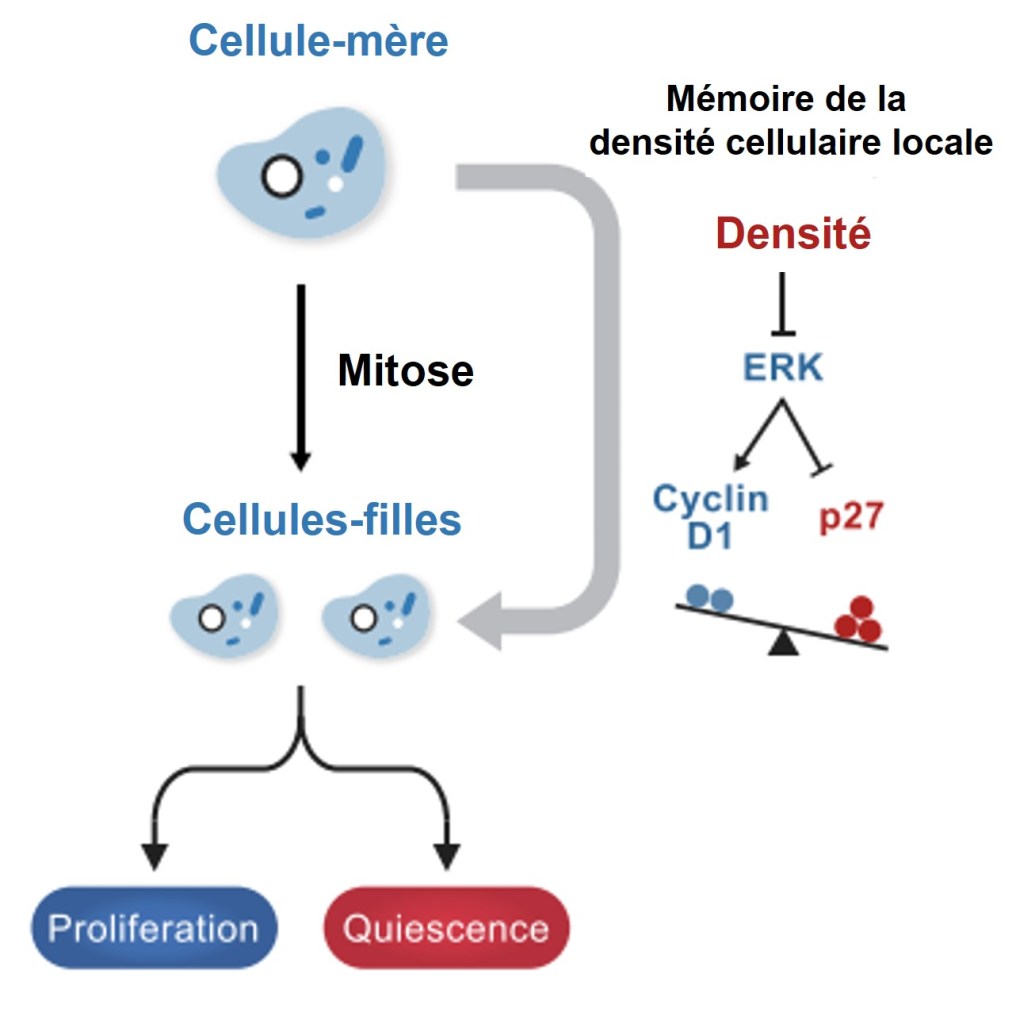
L’équilibre entre la cycline D qui pousse à la prolifération et p27 qui oriente vers la quiescence dépend aussi de la densité cellulaire. Une cellule fille qui vient d’être générée par mitose a « gardé en mémoire » la densité cellulaire où se trouvait sa cellule mère et cela modifie l’activité de ces protéines. C’est une composante de ce que l’on appelle l’inhibition de contact. Une forte densité dans la cellule mère supprime l’activité ERK qui aboutit à un ratio p27/Cycline D augmenté dans la cellule fille (Fan et Meyer, 2021).
La protéine dite « du rétinoblastome » Rb est une cible majeure de la phosphorylation par CDK4/6 et un acteur central dans la décision prolifération-quiescence. Elle a été découverte et étudiée initialement dans le cadre des rétinoblastomes, des tumeurs de l’œil affectant principalement des enfants mais cette protéine joue un rôle dans toutes les cellules. Rb inhibe la prolifération en se liant à et en inactivant E2F1, un facteur de transcription clé pour les gènes du cycle cellulaire et de la division cellulaire (Cheung et Rando, 2013 ; Yao et al., 2008). La phosphorylation de Rb par la cycline D-CDK4 empêche sa capacité à réprimer E2F, permettant l’entrée dans le cycle cellulaire (Yao et al., 2008). L’activité E2F est suffisante pour inciter les cellules quiescentes à entrer dans la phase S, tandis que la prévention de l’activation E2F inhibe la réentrée dans le cycle cellulaire. Ainsi, la voie Rb-E2F agit comme un interrupteur qui intègre des signaux de croissance gradués dans une décision binaire prolifération contre quiescence.

Rb peut également agir en maintenant la quiescence en dehors de la voie E2F. Dans les cellules quiescentes, le Rb hypophosphorylé s’associe au complexe promoteur d’anaphase lié à Cdh1 ou cyclosome (APC/CCdh1) pour cibler Skp2, un activateur de la dégradation de l’inhibiteur de CDK p27 (Binné et al., 2007). Cela permet au p27 de s’accumuler et de favoriser davantage la quiescence. L’activité APC/CCdh1 est nécessaire pour maintenir les hépatocytes dans un état quiescent, et sa perte entraîne une réentrée de ces cellules dans le cycle cellulaire et une insuffisance hépatique ultérieure (Wirth et al., 2004).
Rb a deux membres de la même famille qui lui sont étroitement liés, RBL1/p107 et RBL2/p130 (Sadasivam et DeCaprio, 2013). Comme Rb, p107 et p130 sont des suppresseurs de tumeurs qui empêchent l’expression des gènes dont les produits font avancer le cycle cellulaire. Elles réalisent cette action en se liant aux protéines de répression E2F4/5 (Claudio et al., 1994). De plus, p130 fonctionne dans le cadre du complexe DREAM (DP, RB-like, E2F4/5 et MuvB) (Litovchick et al., 2007). DREAM s’assemble pendant la quiescence et inhibe la progression du cycle cellulaire en inhibant la transcription de nombreux gènes du cycle cellulaire régulés habituellement par E2F, notamment les gènes codant les facteurs de transcription B-MYB et FoxM1 (Fischer et al., 2016). En conséquence, les perturbations de p130 ou du complexe DREAM permettent l’expression de ses gènes cibles du cycle cellulaire habituellement réprimés, déplaçant l’équilibre de la quiescence vers la prolifération (Forristal et al., 2014; Iness et al., 2019).

Revenons à la progression du cycle cellulaire. La phosphorylation de Rb par CDK4/6 entraine via E2F1 l’activation de la transcription de gènes codant les protéines indispensables à la transition G1/S et à la réplication qui suit. Parmi ces cibles, on trouve le gène codant une nouvelle cycline, la Cycline E. Elle s’associe avec la kinase CDK2 et ce nouveau complexe phosphoryle également la protéine Rb. Il y a donc mise en place d’une boucle de rétro-activation positive qui amplifie la phosphorylation de Rb et la libération de E2F. L’hyperphosphorylation de Rb (sur 14 sites) permet le passage du « point de restriction ». A partir de ce point, les cellules peuvent poursuivre leur cycle cellulaire de manière autonome (indépendamment de la présence de facteurs de croissance, d’éléments de la matrice extracellulaire…).
Bilan :

Les cyclines de type D finissement par être dégradées à la fin de la phase G1 mais une isoforme dite b de la cycline D1, obtenue par épissage alternatif, qui fait disparaître dans la protéine un motif PEST de dégradation, a une vie prolongée ce qui dérégule le cycle cellulaire. La surexpression de cette forme b a été observée dans des cancers comme par exemple ceux de la prostate (Comstock et al., 2009).
Réplication de l’ADN et progression en phase G2
En fin de phase G1, le facteur E2F stimule la transcription de gènes permettant l’entrée et la progression dans la phase S (cycline A).
Une ubiquitine ligase nommée SCF provoque la dégradation des inhibiteurs de CDK de phase S, ce qui permet à ces CDK d’être actifs. Lorsque la cellule est entrée en réplication, SCF provoque aussi la dégradation des cyclines exprimées en phase G1.
La réplication commence au niveau de multiples séquences d’origines de réplication sur chaque chromosome reconnues par les complexes ORC. Des hélicases inactives sont chargées aux origines de réplication (et ce, dès la phase G1 en ce qui concerne le complexe de pré-réplication constitué de Mcm2-7). Puis les cycline/CDK de phase S ainsi que la kinase DDK favorisent l’activation des hélicases en facilitant leur association avec des co-facteurs (Moiseeva et al., 2018). Ces hélicases séparent alors les deux brins d’ADN permettant à la machinerie de réplication de s’installer. A partir de cette origine, deux fourches de réplication progressent en s’écartant. Les complexes cycline-CDK de phase S stimulent l’arrivée de l’ADN hélicase et de la machinerie de réplication. En revanche, ils inhibent les complexes ORC une fois la réplication enclenchée, de telle manière à ce que l’ADN ne soit pas répliqué plusieurs fois. Les complexes de pré-réplication qui sont indispensables à la réplication suivante, ne peuvent se mettre en place qu’en phase G1 et pas avant.

Il arrive que la réplication s’arrête ou progresse plus lentement à certains loci. C’est ce qui arrive parfois lors de la première division cellulaire chez l’embryon humain (passage du zygote au stade 2 cellules) où la réplication peut se terminer seulement en phase G2. Des anomalies chromosomiques peuvent en résulter (Palmerola et al., 2022).
Signalons que les histones sont synthétisées essentiellement en phase S et s’associe à l’ADN nouvellement synthétisé juste derrière la fourche de réplication. Si des histones ne sont pas synthétisées en quantité suffisante, il y a un rallongement de la phase S voire un arrêt du cycle en phase G2 (Günesdogan et al., 2014).
La réplication du centrosome, le centre organisateur des microtubules, est une importante étape préliminaire pour la mitose, sachant le rôle essentiel que les fuseaux de microtubules jouent durant la division cellulaire. Cette réplication est coordonnée avec la réplication de l’ADN par la Cycline E-CDK2 (Hanashiro et al., 2008). Elle phosphoryle notamment directement la nucléophosmine (NPM)/B23 qui est responsable de l’initiation de la réplication des centrioles (Okuda et al., 2000). L’autre protéine impliquée dans l’initiation de cette réplication est PLK4 (pour Polo-Like Kinase 4) (Moyer et Holland, 2019). Le processus est semi-réplicatif (comme pour l’ADN) : un nouveau centrosome est formé d’un ancien centriole associé à un nouveau. Des mécanismes de contrôle permettent de s’assurer que le centrosome ne s’est répliqué qu’une seule fois par cycle cellulaire.

Des anomalies de la régulation du nombre de réplication du centrosome par cycle peuvent aboutir à un nombre plus élevé de centrosomes et à des fuseaux mitotiques multipolaires. On peut les trouver dans les cellules tumorales et cela cause des aneuploïdies (nombre anormal de chromosomes dans une cellule).
Signalons que la production de nouveaux centrioles peut aussi avoir lieu en dehors du cadre de la division cellulaire, par exemple lors de la production de cils dans les cellules multiciliées en train de se différencier. De manière intéressante, cette production de nouveaux centrioles peut dépendre de protéines qui interviennent aussi au cours du cycle cellulaire (Jord et al., 2017).
La mitose et le contrôle de ses étapes
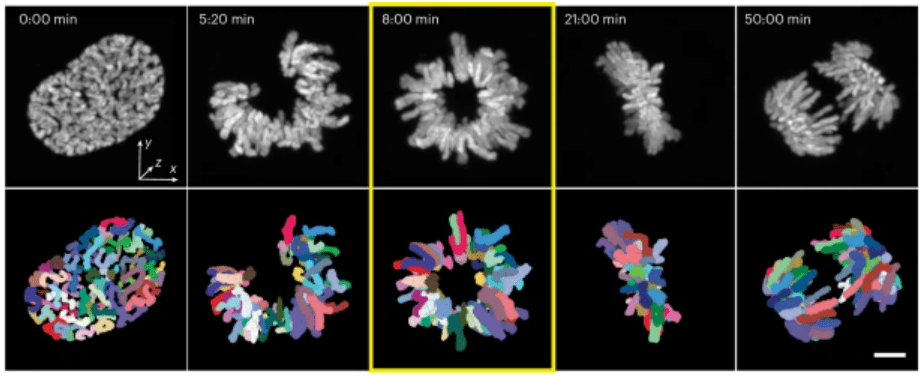
Pour réviser les phases de la mitose :
L’entrée en mitose à partir du stade G2 est contrôlé par CDK1 associée à la cycline B. Ce complexe est aussi appelé MPF (pour M-phase Promoting Factor). CDK1 est le seul membre de la famille véritablement indispensable à l’accomplissement du cycle cellulaire. Chez la souris, le knock-out de CDK1 est très rapidement léthal, ce qui n’est pas le cas des knock-out de CDK2, CDK4 ou CDK6 et CDK1 peut compenser l’absence de toutes les autres CDK (Santamaria et al., 2007).
Comme souvent avec les CDK, la quantité de CDK1 reste assez constante au cours du cycle cellulaire. C’est l’accumulation de cycline B au-delà d’un certain seuil en phase G2 qui fait basculer la cellule en mitose. La transcription du gène codant la cycline B nécessite l’activité de cycline A-CDK2, ce qui explique l’enchaînement de l’expression de ces cyclines et évite que la mitose ne commence trop tôt (Fung et al., 2007). La transcription du gène codant la cycline B est inhibée lorsque l’ADN est endommagé et que des réparations sont nécessaires. Ce type de blocage n’est plus possible dans la plupart des cellules cancéreuses.
Une forte activité cyclineB-CDK1 provoque une condensation des chromosomes via la phosphorylation des complexes de condensines (Bazile et al., 2010), la dispersion de la membrane nucléaire via la phosphorylation des lamines, la séparation des centrosomes, la formation du fuseau mitotique et l’assemblage des kinétochores qui couplent les chromosomes aux microtubules (voir plus loin). Une fois que les chromosomes sont attachés aux microtubules du fuseau, la cycline B est dégradée en fin de métaphase et la cellule passe à la deuxième phase de la mitose vers l’anaphase. C’est le complexe ubiquitine ligase APC/C (avec son co-activateur Cdc20) qui cible la cycline B pour la dégradation. Si tous les chromosomes ne sont pas attachés au fuseau, APC/C n’est pas activé et la cellule conserve un haut niveau de cycline B. C’est ce que l’on appelle le point de contrôle métaphasique ou point de contrôle du fuseau. Il s’agit d’être sûr que tous les chromosomes sont arrimés au fuseau avant de les répartir dans les deux cellules-filles.
L’activité de CDK1 est aussi régulée par des phosphorylations. Wee1 phosphoryle la tyrosine 15 de CDK1 ce qui l’inactive. La phosphatase Cdc25 enlève cette phosphorylation et active CDK1 à la transition G2/M (Strausfeld et al., 1991). Les premiers complexes actifs CyclineB-CDK1 inhibent Wee1 tout en activant Cdc25 créant une boucle de rétroaction positive (Hoffmann et al., 1993; Tang et al., 1993).

Plk1 (pour Polo-Like Kinase 1) est une sérine/thréonine kinase qui active Cdc25 ce qui favorise l’activation de CyclineB-Cdk1. L’expression de Plk1 est augmentée dans de nombreuses cellules cancéreuses et c’est une cible de choix pour des traitements.

La condensation des chromosomes est assurée par les condensines, qui sont des complexes de 5 protéines qui forment un anneau et plusieurs de ces complexes peuvent s’assembler pour former un super-anneau. Les condensines sont la cible de la CyclineB-CDK1 qui les active par phosphorylation. Pendant l’interphase, une phosphorylation par la caséine kinase II assure que les condensines ne seront pas actives et que les chromosomes de ne condenseront pas inopinément.

L’assemblage et la fonction du fuseau mitotique nécessitent que les microtubules subissent des périodes alternées de croissance et de rétrécissement, ainsi que l’action de moteurs moléculaires, qui peuvent réticuler et séparer les microtubules du fuseau. Un bon équilibre entre la dynamique des microtubules et le glissement des microtubules est essentiel dans tous les processus mitotiques pour obtenir une séparation fidèle des chromosomes (Cheerambathur et al., 2013; Yukawa et al., 2019).
Pour réviser la structure et les fonctions des microtubules,
voir la page dédiée.

Une partie de l’arsenal de chimiothérapie anti-tumorale repose sur des molécules qui empêchent l’assemblage des microtubules (vincristine, vinblastine) ou, au contraire, empêche leur désassemblage (paclitaxel ou taxol) ce qui bloque le déroulement des mitoses. Malheureusement, les mitoses des cellules « normales » sont également affectées en même temps que celles des cellules tumorales ainsi que d’autres processus cellulaires impliquant les microtubules ce qui provoque de lourds effets secondaires.
Des dysfonctionnements en anaphase et télophase peuvent mener à une mauvaise répartition des chromosomes dans les cellules filles et donc à des aneuploïdies (nombre anormal de chromosomes dans une cellule). C’est un phénomène qui est courant dans de nombreux types de cancer (Tanaka et al., 2009).
Par ailleurs, les cellules doivent adopter la bonne forme (généralement arrondie pour les cellules animales) pour entrer en mitose car les microtubules astraux doivent être correctement ancrés à la périphérie de la cellule et notamment à son réseau cortical d’actine. Cela passe par une augmentation de la pression osmotique intracellulaire et par une rigidification du cortex cellulaire (Stewart et al., 2011).
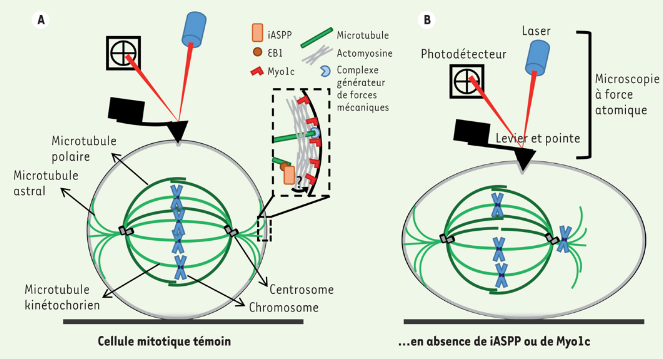
Les microtubules s’attachent aux centromères des chromosomes par l’intermédiaire d’un complexe appelé kinétochore. Deux kinétochores sont présents à chaque centromère et chacun d’entre eux peut interagir avec une vingtaine de microtubules. Du point de vue de l’ADN, chaque région centromérique englobe 1 à plusieurs million de paires de bases (selon les espèces). Ces régions d’hétérochromatine contiennent divers types de séquences d’ADN répétitives (par exemple, des milliers de répétitions d’une séquence de 170 pb appellée alpha satellite).

Les kinétochores sont des mécanosenseurs qui permettent de contrôler la stabilité de l’attachement des microtubules au chromosome et la répartition des microtubules s’attachant à un même chromosome pour que lors de l’anaphase, les chromatides-sœurs soient tirées vers des extrémités séparées de la cellule et non vers le même côté. Ils sont au coeur du point de contrôle métaphasique ou point de contrôle de l’assemblage du fuseau.

La partie interne du kinétochore, en contact avec la chromatine, s’appelle le CCAN (pour Constitutive Centromere Associated Network) et est constituée d’un complexe de multiples protéines CENP. Parmi elles, CENPA (ou CENP-A), un variant de l’histone H3, interagit directement avec la chromatine, notamment les histones H3 (classiques) et H4. CENPU est responsable du recrutement de PLK1 (pour Polo-Like Kinase-1), une sérine/thréonine kinase qui a de nombreux rôles lors de la mitose (et que nous avons déjà vu agir lors de la transition G2/M). Ici, elle phosphoryle et active APC/C qui est le principal acteur du point de contrôle métaphasique. Signalons que les kinétochores d’organismes modèles bien étudiés tels que C. elegans et la drosophile sont dépourvus de tout le répertoire de CENP, à l’exception de CENP-C, ce qui laisse à penser que des protéines alternatives doivent jouer un rôle similaire chez eux (et peut-être chez l’ensemble des Ecdysozaires) (Musacchio et Desai, 2017). Egalement, les végétaux doivent avoir des complexes centromériques et des kinétochores assez différents puisque les gènes orthologues de ceux exposés ici ne sont pas présents dans leur génome (Yamada et Goshima, 2017).
La partie externe du kinétochore est celle sur laquelle les microtubules s’attachent. Elle est formée de 3 complexes : Knl1, Mis12 et Ndc80. C’est ce dernier complexe qui interagit tout particulièrement avec les microtubules. La sérine/thréonine kinase Aurora B, un régulateur majeur de la fixation du kinétochore aux microtubules, phosphoryle jusqu’à neuf sites dans la queue N-terminale de la protéine Ndc80. Ces phosphorylations neutralisent la charge positive intrinsèque du domaine N-terminal de Ndc80, diminuant considérablement l’affinité de liaison du complexe Ndc80 pour les microtubules. Aurora B peut ainsi éliminer tout mauvais attachement des microtubules au kinétochore. Les microtubules détachés grandissent à nouveau et ont une chance de mieux s’attacher. Aurora B phosphoryle aussi des composants du complexe interne des kinétochores comme CENP-C, ce qui rend le complexe plus solide (Kren et Musacchio, 2015).
Un point de contrôle de l’assemblage du fuseau se met en place qui permet de vérifier que l’ensemble des chromosomes ont leur centromère accroché des deux côtés à des microtubules. Un attachement que d’un seul côté pourrait amener les deux chromatides d’un chromosome à se retrouver dans la même cellule-fille, tandis que l’autre cellule-fille n’aurait pas de chromatide.
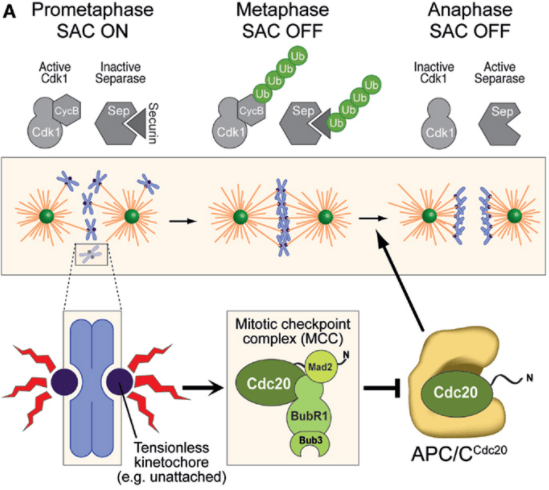
Lorsque tous les chromosomes sont correctement attachés, APC/C provoque la dégradation de la Cycline B comme nous l’avons vu ce qui permet de passer à la terminaison de la mitose via l’anaphase et la télophase.
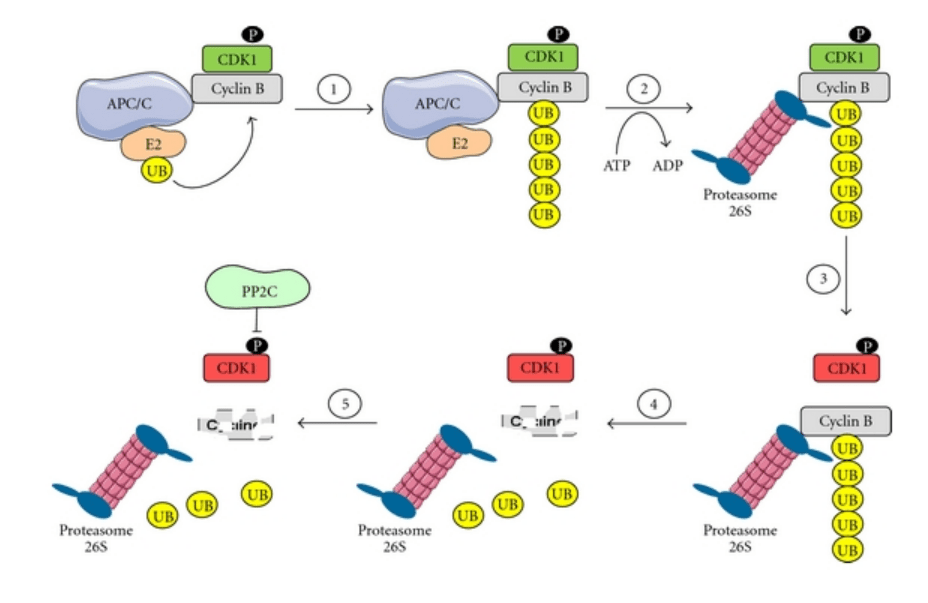
Il provoque également la dégradation de la sécurine, qui jusque là empêchait la séparase de cliver les molécules de cohésine. La cohésine étant maintenant dégradée, les chromatides peuvent se séparer. Une autre protéine qui jusque là protégeait la cohésine de la dégradation, Shugoshine est également envoyée à la dégradation par l’action de APC/C (Rattani et al., 2015).
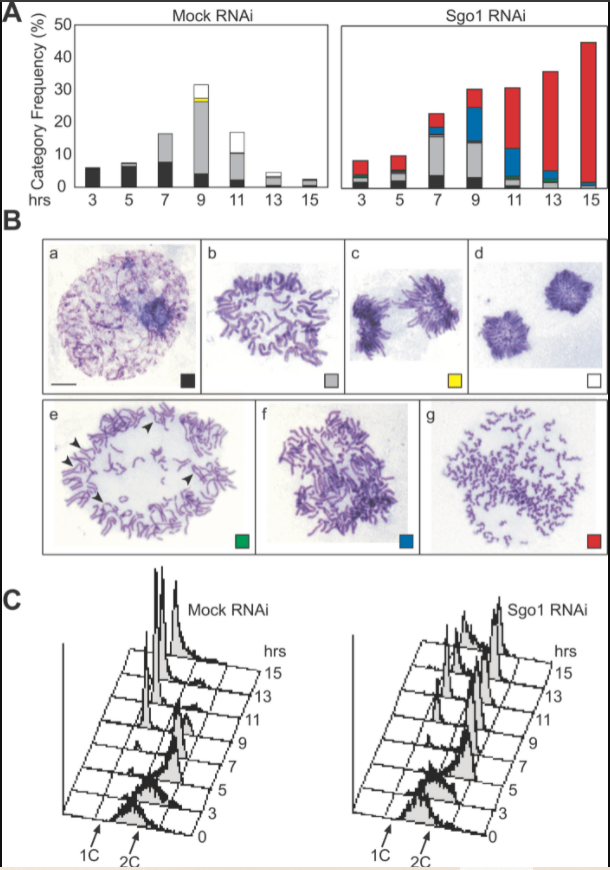
Des cellules HeLa synchronisées ont été transfectées avec le siARN Sgo1 ou un siARN contrôle, récoltées à intervalles de 2 heures après la libération et examinées par étalement des chromosomes et coloration au Giemsa. 100 cellules ont été notées pour l’indice mitotique, et 100 cellules mitotiques ont été classées en sept catégories en fonction de la configuration des chromosomes, comme illustré en (B) pour chaque point de temps. (A) La fréquence de chaque catégorie de cellule mitotique est donnée en pourcentage du nombre total de cellules, de sorte que la somme de chaque colonne représente l’indice mitotique. (B) Images représentatives de sept catégories de cellules mitotiques. Étalement des chromosomes : (a) prophase ; (b) métaphase ; (c) anaphase ; et (d) télophase. (e) Phase précoce de la disjonction précoce des chromatides-sœurs. À ce stade, les chromatides-sœurs commencent à se séparer. Les pointes de flèches indiquent les chromosomes dont la cohésion centromérique semble être perdue. (f) Phases ultérieures de la séparation des chromatides-sœurs. A ce stade, les paires de chromatides-sœurs ne sont plus discernables, les restes de la plaque métaphasique sont encore visibles et les chromatides-sœurs ne se sont pas encore hypercondensées. (g) Chromatides simples dispersées. Les chromatides-sœurs sont complètement séparées et distribuées au hasard les unes par rapport aux autres, les chromatides individuelles sont hypercondensées, ce qui donne un aspect « frisé ». Notez que la séparation des chromatides dans les anaphases normales (c) est différente de la séparation précoce des chromatides-sœurs (e-g), en ce sens que des chromatides disjointes et appariées coexistent dans la même cellule.
(C) Une partie des cellules récoltées pour l’analyse des figures A et B ont été fixées à l’éthanol et leur contenu en ADN a été analysé par cytométrie de flux (après coloration fluorescente au iodure de propidium). On voit que la mitose est bloquée car le nombre de cellules 2C devient stable au cours du temps quand Sgo1 est déplété par le siARN. Source : https://journals.plos.org/plosbiology/article?id=10.1371/journal.pbio.0030086
Au cours de l’anaphase, le fuseau s’allonge pour écarter les pôles du fuseau et séparer les deux ensembles de chromosomes (Mallavarapu et al., 1999; Roostalu et al., 2010; Vukušić et al., 2017). L’allongement du fuseau est réalisé par la génération de forces de glissement des microtubules au niveau de la zone médiane du fuseau (Kiyomitsu et Cheeseman, 2013; Redemann et al., 2017). La zone médiane est le chevauchement des microtubules au centre du fuseau, formé de microtubules orientés de manière antiparallèle (microtubules interpolaires), qui proviennent des deux pôles opposés du fuseau.
Le glissement des microtubules est favorisé par les membres de la famille de la kinésine-5 (ou Eg5) dans la plupart des organismes (Avunie-Masala et al., 2011; Brust-Mascher et al., 2009). Cette kinésine tétramèrique réticule les microtubules antiparallèles et les sépare. En marchant vers les extrémités positives de chacun des deux microtubules antiparallèles la kinésine-5 peut déplacer les microtubules les uns par rapport aux autres (Kapitein et al., 2005). La kinésine-5 est surexprimée dans certaines tumeurs (gliomes, neuroblastomes et tumeurs du poumon et du sein) (Rath et Kozielski, 2012).

Parallèlement au glissement des microtubules, les microtubules interpolaires doivent croître à une vitesse qui permet au fuseau de s’allonger tout en maintenant la zone médiane du fuseau. La croissance des microtubules doit se produire avec au moins la vitesse à laquelle les microtubules du fuseau glissent pour maintenir le chevauchement des microtubules, nécessaire à la stabilité du fuseau. La dynamique des microtubules pendant l’anaphase est régulée par CLASP, qui favorise la polymérisation des microtubules (Bratman et Chang, 2007; Maton et al., 2015).

La cytodiérèse correspond au pincement qui se forme entre les deux cellules-filles et qui aboutit à leur séparation. Il est contrôlé par un anneau contractile d’actine/myosine.
C’est l’activité équatoriale de la petite GTPAse RhoA qui contrôle la mise en place des faisceaux de filaments d’actine formant l’anneau contractile (Nishimura et al., 2006).

Centralspindline, un hétérotétramère de la kinésine MKLP1 (également connue sous le nom de KIF23) et de CYK4 (également connue sous le nom de RACGAP1), se localise aux extrémités positives des microtubules de la zone médiane (Raich et al., 2017) et recrute ECT2, une protéine de la famille des RhoGEF qui ôte un GDP en échange d’un ajout de GTP sur les protéines de la famille Rho. Cela conduit à l’activation de RhoA qui à son tour active ROCK et la kinase citron qui à leur tour activent la chaine légère de la myosine II par phosphorylation et permet la contraction du complexe actomyosique dans l’anneau (Maudale et al., 1998; Yamashiro et al., 2003).
Une fois les cellules séparées, l’activité APC/C reste importante de telle manière à ce qu’aucune cycline mitotique ne puisse s’accumuler. Ce n’est que lors du passage G1 vers S du cycle suivant que l’activité d’APC/C redevient nulle.
BILAN DU CONTRÔLE DU CYCLE CELLULAIRE

TEST SUR LES ETAPES DU CYCLE CELLULAIRE
Les particularités des divisions des cellules végétales
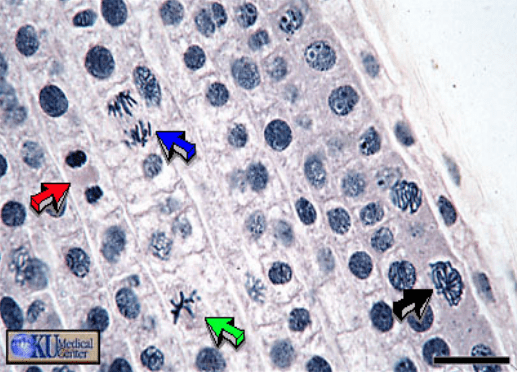
Les cellules végétales sont confrontées à des défis particuliers lors de la division. Entourées de parois cellulaires rigides, elles ne peuvent adopter la morphologie arrondie typique des cellules animales en mitose et doivent donc recourir à des mécanismes spécifiques pour définir le plan de division.
Les cellules végétales n’ont pas de centrosomes, le centre de nucléation et d’organisation des microtubules que l’on trouve dans les cellules animales. Les fuseaux mitotiques s’organisent malgré cela, mais de manière différente. Le fuseau métaphasique est généralement en forme de tonneau sans un seul point de focalisation à chaque pôle. Dans les derniers stades de la mitose, une cellule végétale assemble un phragmoplaste qui est un réseau de microtubules important pour le dépôt de matériau à la plaque cellulaire où se formera la paroi entre les deux cellules-filles.
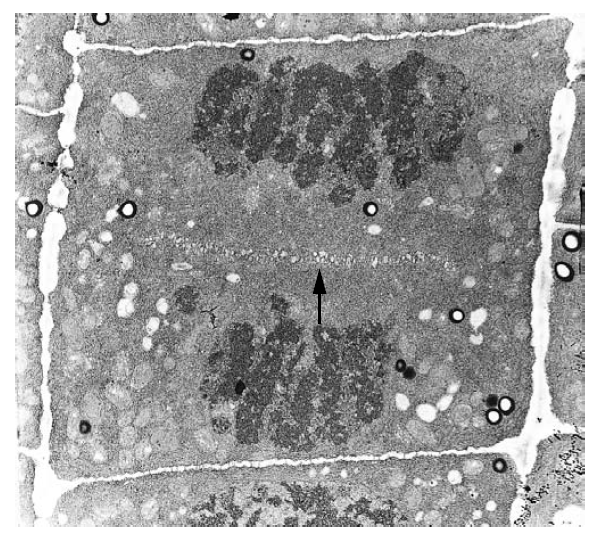
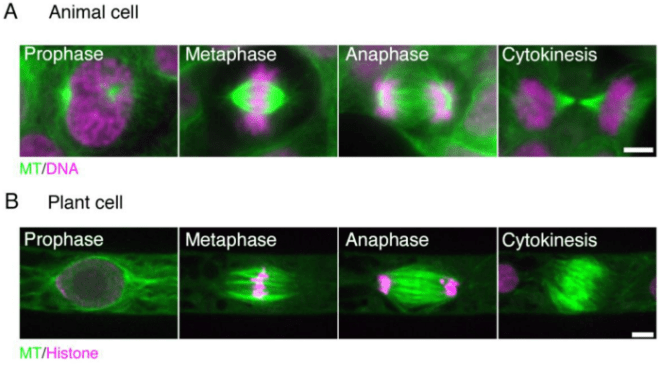

Le phragmoplaste se forme au centre de la cellule-mère qui a presque achevé de se diviser. Il se développe ensuite latéralement vers les bords de la cellule. Au cours de sa croissance, de nouveaux microtubules sont recrutés dans la
périphérie et démantelés au centre. Des microfilaments d’actine sont également présents et avec les microtubules, ils coordonnent l’intense activité sécrétrice qui permet le dépôt de la nouvelle paroi cellulaire qui va séparer les deux cellules-filles.
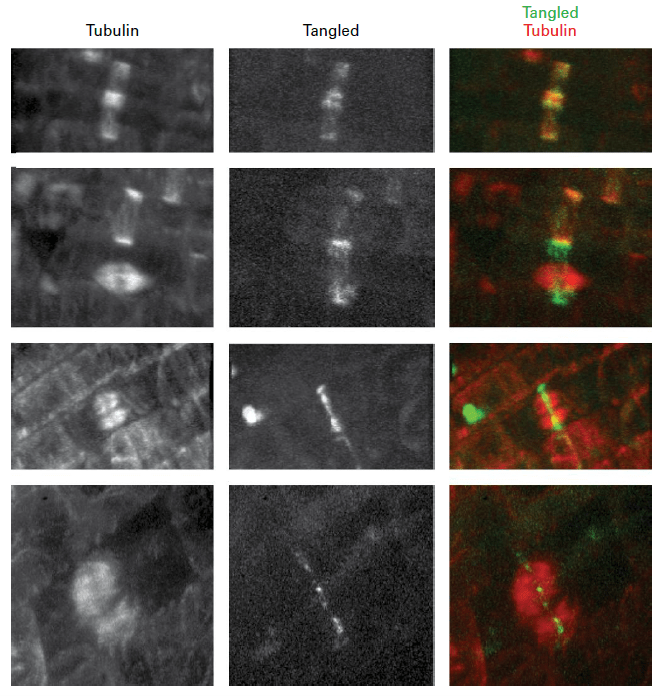
Des différences sont présentes aussi avant même la mitose avec la formation de la bande préprophasique (BPP) en phase G2 tardive. Il s’agit d’un anneau de microtubules qui est positionné au niveau de la future plaque métaphasique et au niveau du futur phragmoplaste.

La BPP permet de recruter un ensemble de MAP (Microtubule-Associated Proteins) qui est conservé tout au long de la division et marque le site exact d’insertion de la plaque cellulaire par le phragmoplaste lors de la cytokinèse. Par exemple, la protéine TANGLED sert de régulateur spatial essentiel en liant et en organisant les microtubules dans la BPP, en maintenant les informations de position de la cette bande durant la cytokinèse, assurant ainsi une orientation et une exécution adéquates de la division cellulaire (Walker et al., 2007).
Les particularités de la méiose

La méiose consiste en deux divisions cellulaires successives qui suit un seul cycle de réplication de l’ADN, ce qui permet de générer des gamètes haploïdes à partir de cellules parentales diploïdes au cours de la reproduction sexuée. Tandis que la mitose permet de générer deux cellules-filles identiques du point de vue de leur patrimoine génétique, la méiose, au contraire, permet de générer quatre cellules-filles différentes d’un point de vue génétique.
(attention sur le schéma, on part d’une cellule germinale et non d’une cellule souche)
Vidéo de comparaison entre la méiose et la mitose :
L’une des grandes particularités de la méiose sont les crossing-overs en prophase I. Ces recombinaisons entre chromosomes homologues sont l’une des clés de la création de la diversité génétique par la reproduction sexuée. En recombinant au hasard les allèles d’origine paternel et maternel, les crossing-overs assurent que chaque gamète aura une combinaison inédite et unique d’allèles à transmettre à la descendance.
Les crossing-overs ont aussi constitué un modèle d’étude qui a été important dans l’histoire de la génétique pour savoir si des gènes se trouvent sur un même chromosome et si oui, pour établir la distance génétique entre ces deux gènes. C’est un apport essentiel de la génétique de la drosophile développé par Thomas H. Morgan au début du XXème siècle : pour en savoir plus, voir ce site.
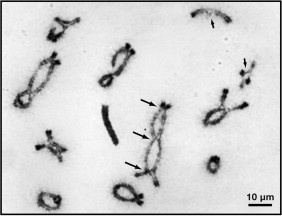

Un crossing-over commence par l’action de la protéine SPO11 (ou de ses homologues) et de ses protéines associées dans un complexe qui catalyse la formation de cassures double brin programmées. Ensuite, les extrémités de cette cassure sont réséquées et traitées par plusieurs nucléases et hélicases pour générer des surplombs étendus d’ADN simple brin (ADNsb) 3′ (Symington, 2016). Ces ADNsb exposés sont successivement recouverts par la protéine de réplication A (RPA) et s’associent à deux recombinases conservées RAD51 et DMC1 pour former des nucléofilaments, qui sont responsables de la recherche d’homologie et de la formation de la double jonction Holliday (dHJ).

Finalement, les dHJ sont résolus. Une partie des enzymes impliquées ont aussi des fonctions de réparation de l’ADN ce qui n’est pas étonnant puisque le processus moléculaire des crossing-overs a commencé par une cassure double brin. Mais certaines des enzymes sont spécifiques de la méiose. La bonne réalisation des crossing-overs nécessite un coalignement spatial de chromosomes homologues. Une structure macromoléculaire protéique tripartite, également appelée complexe synaptonémal (SC), s’assemble entre les chromosomes homologues coalignés et stabilise la structure de ces derniers (Gao et Colaiácovo, 2018).
Il peut y avoir plusieurs crossing-overs le long d’un même bras d’une paire de chromosomes homologues mais on observe qu’ils se déroulent avec une assez grande distance entre eux, ce que l’on appelle l’interférence des crossing-overs. C’est une manière de limiter le nombre de crossing-overs. Avec l’âge, cette régulation se fait moins forte lors de l’ovogénèse, aboutissant à des taux de recombinaison plus élevés au cours du vieillissement (Campbell et al., 2015).
Les crossing-overs sont scrutés par des points de contrôle de la méiose. La progression dans le cycle cellulaire peut être retardée ou une apoptose peut être déclenchée si les recombinaisons ne se déroulent pas normalement et il est nécessaire qu’il y ait au moins un crossing-over par chromosome homologue (Jones et Franklin, 2006; Subramanian et al., 2014).
Signalons qu’il existe quelques cas où il n’y a pas de crossing-overs tel que chez les drosophiles mâles ou chez les Bombyx mori femelles.
L’autre grande originalité de la méiose par rapport à la mitose est la non-séparation des chromatides d’un même chromosome lors de l’anaphase de la 1ère division méiotique. Les chromosomes homologues se séparent mais pas les chromatides de chaque chromosome. Cela tient au comportement particulier des anneaux de cohésine qui ont des sous-unités différentes par rapport aux anneaux présents à la mitose (Haering et al., 2008; Brar et al., 2009).
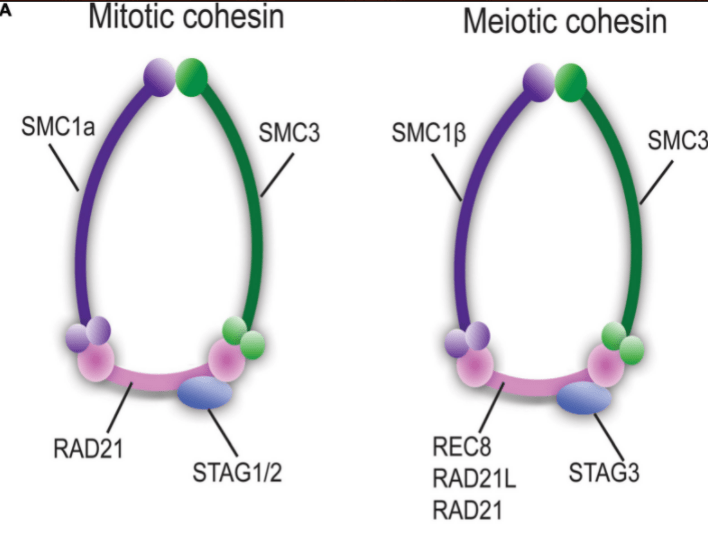
Lors de la seconde division méiotique, ces anneaux sont clivés et la séparation des chromatides peut se faire (Schökel et al., 2011).
Il est courant que la méiose subisse des arrêts chez les futurs gamètes femelles : par exemple chez les Vertébrés, la méiose s’arrête en prophase I lors du développement embryonnaire puis reprend à l’ovulation et s’arrête ensuite en métaphase II. Le dernier déblocage a lieu lors de l’activation de l’ovocyte à la fécondation. Lors du deuxième arrêt, en métaphase II, le facteur CSF ou facteur cytostatique maintient la présence de cycline B-CDK1 par inhibition d’APC/C. CSF est en fait composé des membres d’une voie de signalisation, la voie Mos/MAPK (Dupré et al., 2011).

Si on réalise un transfert cytoplasmique d’un ovocyte mature non fécondé vers l’une des cellules d’un embryon à 2 cellules, cette cellule ne se divise plus (elle est dit « en arrêt CSF ») démontrant la capacité du cytoplasme de l’ovocyte mature à maintenir l’activité MPF et à bloquer le cycle.
Lors de la fécondation, l’entrée des ions Ca2+ dans le cytoplasme inactive les composants de cette voie (par l’intermédiaire de CamKII et de la calcineurine), provoquant la dégradation de la cycline B et le basculement dans la dernière partie de la deuxième division méiotique.
Autre particularité : les ovocytes perdent leurs centrioles au cours du développement, les ovocytes doivent ainsi utiliser des mécanismes alternatifs pour former des fuseaux de microtubules pendant la méiose (Manandhar et al., 2005). Cela dépend de 2 mécanismes dans les ovocytes de souris : la voie Ran-GTP et les centres d’organisation des microtubules acentriolaires (aMTOCs) (Schuh et al., 2007). La voie Ran-GTP génère un gradient de facteurs d’assemblage du fuseau émanant de la chromatine et qui contrôle la polymérisation des microtubules (Drutovic et al., 2019). Les aMTOCs sont des structures composées de matériel péricentriolaire qui forment des noyaux de nucléation (ou sites d’initiation) pour la formation des microtubules (Combelles et al., 2001; Ma et al., 2014). Attention, certains organismes n’ont pas d’aMTOCs dans leurs ovocytes, comme la drosophile et les humains.
Enfin, dernière particularité, lors de la formation des gamètes femelles, les deux divisions de la méïose sont fortement asymétriques avec la production d’un petit globule polaire et d’un ovocyte. La méiose femelle ne donne ainsi qu’un seul gamète fécondable. En contraste, lors de la méiose mâle, les divisions sont symétriques et donnent naissance à 4 spermatozoïdes.

Maintien de l’identité des cellules durant la division
Des facteurs de transcription restent accrochés à la chromatine lors des divisions cellulaires comme c’est le cas de Sox2. On pense qu’ils sont essentiels pour le maintien de l’identité des cellules.
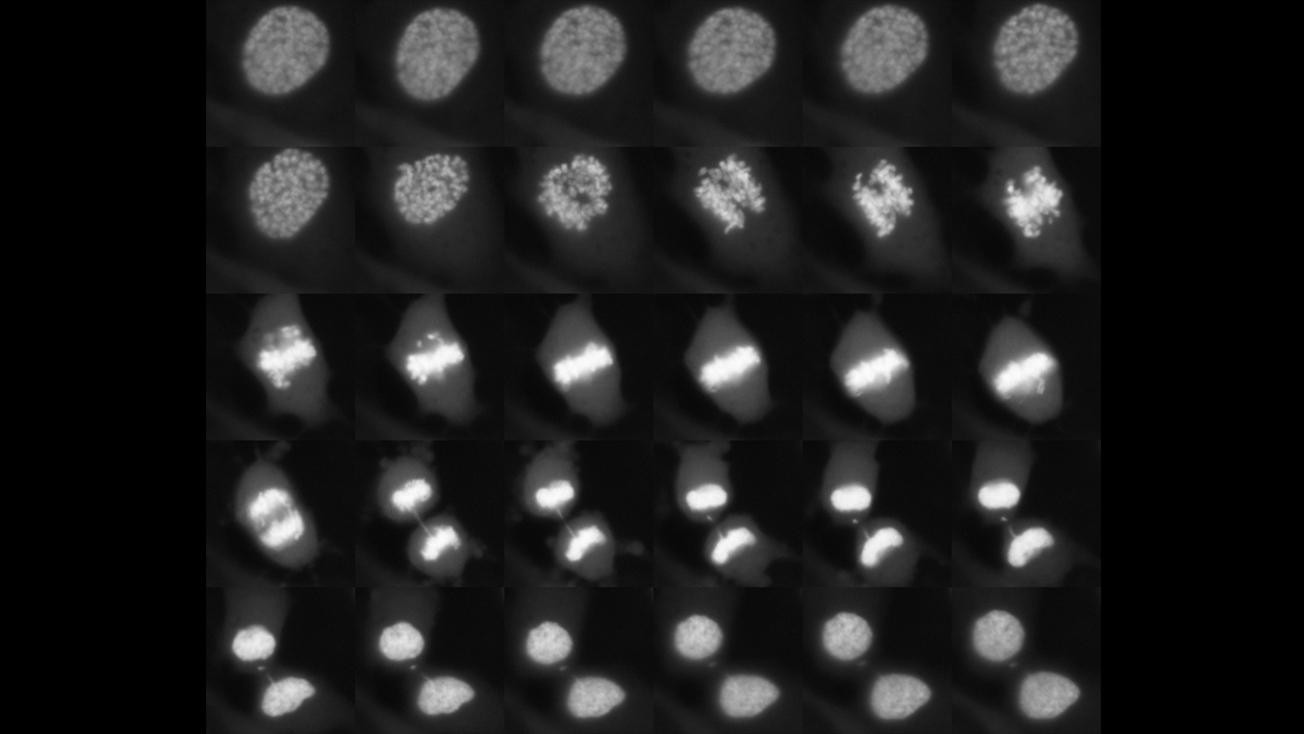
En plus de ces facteurs de transcription, les modifications épigénétiques restent présentes sur la chromatine pendant la division cellulaire. L’ensemble des éléments qui restent sur la chromatine et qui permettent de refaire démarrer la transcription de gènes spécifiques après la mitose réalise le « bookmarking », l’équivalent de l’utilisation de marque-pages dans un livre que l’on referme temporairement.
La polyploïdisation
La polyploïdisation ou augmentation du nombre de chromosomes dans une cellule se produit dans de nombreuses cellules végétales et animales dans le cadre d’un programme de développement, où il est crucial d’augmenter la taille des cellules et la production métabolique. Elle est assez fréquente chez les végétaux et plus rares chez les animaux. Par exemple, la polyploïdisation des neurones géants des limaces Limax leur permet d’atteindre la taille énorme dont ils ont besoin pour transmettre des signaux sur de grandes distances (Yamagishi et al., 2012).
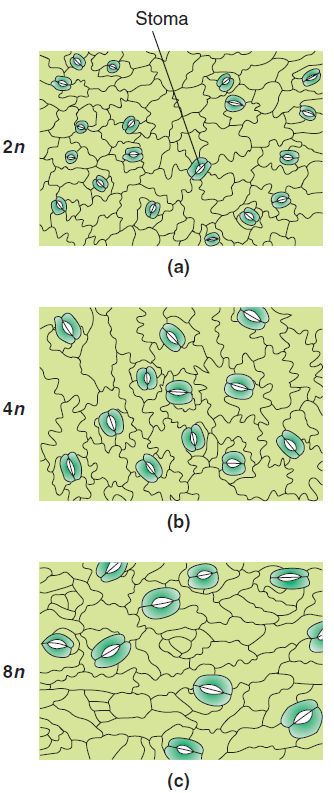
(a) Diploïde ; (b) Tétraploïde ; (c) Octoploïde. On constate que la taille des cellules augmente, particulièrement au niveau des stomates, avec une ploïdie accrue. Source
La polyploïdisation des cellules gliales sous-périneurales de la drosophile assure l’intégrité de la barrière hémato-encéphalique pendant la croissance des organes (Unhavaithaya et al., 2011). Chez les vertébrés, les cellules polyploïdes sont présentes dans de nombreux organes, tels que le foie, le sang, la peau, le pancréas, le placenta et les glandes mammaires, où elles jouent des fonctions importantes dans l’homéostasie tissulaire, la régénération et en réponse aux dommages. Les cellules polyploïdes peuvent soit être mononucléées, comme les mégacaryocytes (Mattia et al., 2002) et les cellules géantes du trophoblaste, soit multinucléées, comme les cellules épithéliales mammaires.
La polyploïdie peut survenir soit par fusion cellulaire, soit par des cycles cellulaires non canoniques dans lesquels les cellules répliquent leur ADN mais ne se divisent pas. Deux types de cycles cellulaires inhabituels conduisent à la polyploïdie : l’endoréplication et l’endomitose. Dans l’endoréplication, la phase M est ignorée, ce qui entraîne des cycles de réplication de l’ADN (phase S) et des phases G sans mitose ni cytokinèse intermédiaires. Les cycles cellulaires endoréplicatifs donnent de grandes cellules mononucléées. Dans l’endomitose, les cellules entrent en mitose, mais ne subissent pas de division cellulaire, ce qui donne des cellules polyploïdes avec un seul noyau ou 2 noyaux, selon que la phase M est interrompue avant ou après le début de la ségrégation des chromosomes sœurs (qui se produit normalement pendant l’anaphase).


(A) Au début de la grossesse, les précurseurs des cellules du trophoblaste extra-villeux expriment le récepteur EGFR et forment une colonne cellulaire dite hautement proliférative, qui génère des précurseurs exprimant HLA-G à l’extrémité distale de la colonne cellulaire. Au cours de cette transition, un cycle cellulaire endoréplicatif provoque la tétraploïdisation. L’endoréplication dans les trophoblastes HLA-G+ est caractérisée par un patron d’expression Cycline A+/p57-. Lors de l’invasion dans l’endomètre utérin, les trophoblastes extra-villeux perdent leur activité cyclique avec un phénotype cycline A-/p57+ dominant et subissent une sénescence cellulaire. L’induction de la sénescence cellulaire est au moins en partie régulée par p57 et la cycline E. (B) L’équilibre entre l’endoréplication et la sénescence est perturbé dans le cas des môles hydatiformes, une anomalie rare de la grossesse où les cellules trophoblastiques présentent une activité endoréplicative exacerbée caractérisée par une augmentation de la cycline A+/p57, une polyploïdisation accrue et une sénescence cellulaire réduite. Source : https://journals.plos.org/plosgenetics/article?id=10.1371/journal.pgen.1007698
PASSEZ A LA PAGE SUIVANTE POUR ETUDIER LES DIVISIONS ASYMETRIQUES
