Par Patrick Pla, Université Paris-Saclay
- Introduction
- Constituants des parois des cellules végétales
- Dépôt de la paroi cellulaire primaire et secondaire
- Croissance de la paroi cellulaire primaire
- Transport dans la paroi cellulaire
- Signalisation à partir de la paroi cellulaire
- Destruction de la paroi cellulaire
Introduction
Lorsqu’au XVIIème siècle Robert Hooke a observé au microscope des tissus végétaux, il a observé des logettes qu’il a appelé cellule. On sait maintenant qu’il avait observé surtout de la paroi cellulaire, car le tissu observé (du liège) est essentiellement formé de cellules mortes et seule la paroi cellulaire persiste.

De manière similaire, le bois est essentiellement constitué de cellules mortes dont il ne reste que la paroi. Les propriétés du bois découlent donc directement des propriétés de la paroi cellulaire.
La paroi des cellules végétales constitue leur « squelette ». Pour les végétaux aériens, elle est un élément indispensable pour leur soutien et notamment la croissance en hauteur. Lorsqu’elle est lignifiée, la paroi cellulaire permet une grande solidité qui permet de développer des structures très hautes qui assurent l’accession à un maximum de lumière, principale source d’énergie. Cela se fait au prix de l’impossibilité de la migration cellulaire, ce qui distingue les cellules végétales des cellules animales.
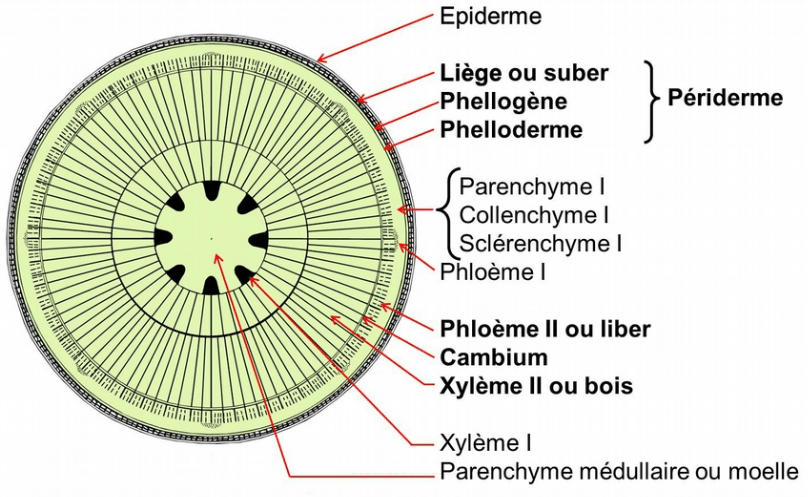
Les tissus secondaires (issus du cambium et du phellogène) sont en caractères gras. Avec le temps, l’accroissement du bois va comprimer le parenchyme médullaire jusqu’à le faire disparaître. Source : https://planet-vie.ens.fr/thematiques/vegetaux/anatomie-vegetale-et-histologie-vegetale/la-structure-secondaire-des-tiges

Pour les méthodes de coloration histologique de la cellulose et de la lignine : voir ce lien.
Constituants des parois des cellules végétales
Cellulose
La cellulose, connue pour être la molécule organique la plus abondante sur Terre, joue un rôle essentiel dans le règne végétal. Elle est classée parmi les polysaccharides, des polymères complexes composés de multiples unités de glucose. La structure de la cellulose se distingue par des liaisons β-(1→4) entre les glucoses, contrairement à l’amidon et au glycogène qui présentent des liaisons α-(1→4) ainsi que des ramifications α-(1→6). Deux glucoses liés par des liaisons β-(1→4) forment la cellobiose. Une chaîne de cellulose comporte entre 1.000 à 30.000 glucoses selon les espèces et les tissus.


L’association de 36 chaînes de cellulose entre elles par des liaisons hydrogènes inter-moléculaire forme une microfibrille (d’un diamètre de 10-25 nm). L’association de 6 microfibrilles de cellulose forme une macrofibrille et un agencement de plusieurs macrofibrilles forme une fibre de cellulose.
La biosynthèse de la cellulose implique des cellulose synthases organisées en rosette intégrée dans la membrane plasmique. La cellulose est synthétisée à partir de molécules de glucose activées par l’UDP. La cellulose synthase couple l’élongation du polymère cellulosique avec sa translocation vers l’extérieur de la cellule à travers un pore dans la membrane plasmique.
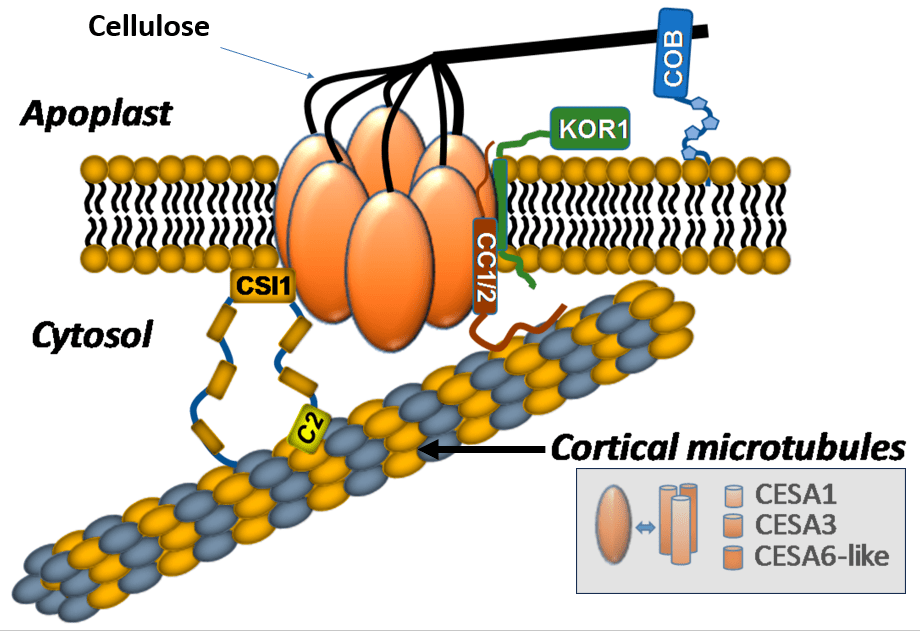
Dans les cellules végétales, des faisceaux de microtubules corticaux (juste sous la membrane plasmique) jouent un rôle fondamental pour guider les mouvements des complexes de cellulose synthase qui permettent la synthèse de cellulose de la paroi. L’orientation des microfibrilles de cellulose est directement dépendante de l’orientation des microtubules corticaux. Cette orientation détermine ensuite selon quel axe la cellule va pouvoir s’allonger (l’allongement se fait perpendiculairement à l’orientation des microtubules corticaux et des microfibrilles de cellulose), ce qui est un paramètre crucial pour la morphogénèse des tissus végétaux.

Un complexe en forme de rosette contenant plusieurs cellulose synthases sont rattachés aux microtubules corticaux par des protéines de liaison, telles que CSI1 et donnent naissance à plus d’une douzaine de chaînes cellulosiques, qui forment rapidement une microfibrille de cellulose cristalline dans la paroi cellulaire. Les microtubules corticaux sont reliés entre eux par des protéines comme MAP65 qui stabilise l’ensemble de la structure. Source : https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4441250/
Grâce à sa rigidité et sa solidité, la cellulose constitue la principale composante des parois cellulaires des plantes, lui conférant ainsi un rôle clé dans leur architecture et leur protection. Elle offre une structure de soutien aux cellules végétales, leur permettant de résister aux forces mécaniques et aux pressions environnementales. De plus, la cellulose est également impliquée dans le transport de l’eau et des nutriments à travers les plantes.
La dégradation de la cellulose est bien moins répandue dans le monde vivant que celle de l’amidon et est réalisée par certaines enzymes spécifiques appelées cellulases, présentes chez des micro-organismes, tels que les bactéries et les champignons. Ces enzymes sont capables de décomposer la cellulose en ses unités de glucose constitutives, rendant ainsi la cellulose accessible comme source d’énergie ou de matériaux pour ces organismes et les organismes qui les abritent (les hôtes des microbiotes intestinaux par exemple).
Outre son importance biologique, la cellulose est également utilisée par l’homme dans divers secteurs industriels où elle constitue un matériel de choix en raison de son abondance et de ses propriétés physiques. En tant que matière première renouvelable, elle est utilisée dans la production de papier, de textiles tels que le coton (les poils des graines de coton sont composés à près de 95% de cellulose, un record), et même dans la fabrication de bioplastiques respectueux de l’environnement. Les gènes impliqués dans la formation de la paroi cellulaire du coton sont d’ailleurs très étudiés pour des raisons économiques (You et al., 2023).
Hémicelluloses
Ce sont des polysaccharides (glucose, xylose, arabinose…) plus courtes que dans la cellulose et ramifiés par des chaines très courtes. Ils font le lien entre les fibrilles de celluloses (avec lesquelles elles peuvent se lier par des liaisons hydrogènes). Tandis que les celluloses assurent l’armature de la paroi, les hémicelluloses assurent sa cohésion.
Chez les Angiospermes, les chaines latérales courtes commencent en général par un xylose (et ce sont donc des xyloglucanes).
La callose est une hémicellulose qui est produite en cas de blessure pour éviter l’entrée de pathogènes.
Pectines
Il s’agit de polysaccharides riches en acides polygalacturoniques. Ils influencent la porosité et l’extensibilité de la paroi. Les acides galacturoniques portent chacun un groupement carboxyle COO– et lorsqu’ils ne sont pas méthylés, ces groupements peuvent interagir par liaisons ioniques avec des ions Ca2+. Ces ions attirent l’eau ce qui est à l’origine des propriétés gélifiantes des pectines.

Les précurseurs des pectines sont synthétisés dans l’appareil de Golgi et transportés vers la membrane plasmique, où ils sont traités et incorporés dans la paroi existante. Les pectines sont particulièrement abondantes dans la lamelle moyenne qui correspond à la partie centrale de la paroi, à l’interface entre la paroi synthétisée par une cellule et celle synthétisée par la cellule voisine. La lamelle moyenne est par ailleurs la couche la plus appauvrie en cellulose parmi les différentes couches de la paroi.
Lignine
La lignine désigne un ensemble de macromolécules polyphénoliques qui sont déposées secondairement dans la paroi. Elle est la principale composante du bois. La lignine confère une grande rigidité à la paroi et elle est spécifique des Trachéophytes (elle est aussi présente chez quelques algues rouges par convergence évolutive). Elle est essentielle au port des plantes qui font plus d’1 mètre de hauteur et où la pression du turgescence contre la paroi primaire ne suffirait pas à maintenir la plante érigée. La lignine permet aussi à la paroi des faisceaux de xylème de supporter la pression négative liée à l’évapotranspiration.
Le précurseur de la formation de la lignine est la phénylalanine. Cet acide aminé subit une désamination oxydative par la Phénylalanine ammonia-lyase (PAL) puis une série d’autres étapes enzymatiques.

La transcription des gènes codant les enzymes impliquées dans la biosynthèse des lignines est sous le contrôle des facteurs de transcription VND1-7 et NST1-3.
Subérine

La subérine est un polymère lipidique (longues chaînes de polyesters d’acides gras et de composés phénoliques liés aux chaînes lipidiques par des liens esters et éthers) imperméable qui se dépose dans la paroi de certains tissus (endoderme des racines qui sépare les tissus vasculaires du cortex, liège ou suber dans le périderme, tégument de diverses graines, également dans les zones d’abscission). Avec la cutine qui lui est proche, la subérine joue un rôle de protection contre la déshydratation, contre les parasites et aussi contre le feu.
La subérine se dépose aussi au niveau des sites de blessure et d’abscission.

Chez Arabidopsis, il y a expression au niveau de ces sites du gène FAR4, codant une acide gras-CoA réductase impliquée dans la synthèse de la subérine (Domergue et al., 2010).

Protéines
Les protéines sont en proportion très minoritaires dans la paroi cellulaire des végétaux ce qui est une situation très différente de la matrice extracellulaire des animaux. Il s’agit de HRGP (Hydroxyprolin Rich Glyco Protein) qui est une protéine de structure, d’enzymes impliquées dans le renouvellement ou le remodelage de la paroi (cellulases, pectinases…) ou qui interviennent dans la défense contre les pathogènes (chitinase).
Dépôt de la paroi cellulaire primaire et secondaire
Dans les derniers stades de la mitose, une cellule végétale assemble un phragmoplaste qui est un réseau de microtubules important pour le dépôt de matériau à la plaque cellulaire où se formera la paroi entre les deux cellules-filles. Des vésicules dérivées de l’appareil de Golgi remplies de pectine voyagent le long de ces microtubules et s’alignent le long de la plaque cellulaire et fusionnent formant la lamelle pectique. Du réticulum endoplasmique se place en travers de cette lamelle pectique, ce qui ménage des espaces qui formeront les plasmodesmes, reliant le cytoplasme de cellules voisines. Les couches cellulosiques se déposent par la suite dans la plaque cellulaire pour former la paroi entre les deux cellules filles.

La paroi primaire est d’abord déposée dans toutes les cellules, puis après une éventuelle phase de croissance, la paroi secondaire est déposée dans les cellules de certains tissus (xylème, sclérenchyme…).
La biosynthèse de la cellulose implique des cellulose synthases (ou CESA) organisées en rosette intégrée dans la membrane plasmique. Au cours de l’épaississement de la paroi, la cellulose fraichement synthétisée est donc toujours celle la plus proche de la membrane plasmique et la plus ancienne cellulose à une plus grande distance.
Les différentes CESA sont codées par une famille multigénique. L’étude de mutants a montré que trois sous-unités CESA différentes, CESA1, 3 et 6, sont importantes pour la biosynthèse de la cellulose de la paroi cellulaire primaire. Un certain niveau de redondance fonctionnelle est observé entre CESA2, 5 ou 9 avec CESA6, alors que les sous-unités CESA1 et 3 ne sont pas redondantes et sont donc nécessaires à la synthèse de la cellulose (Desprez et al., 2007; Persson et al., 2007).
Les CESA 4, 7 et 8 sont spécifiquement impliquées dans la synthèse de cellulose dans les parois secondaires et la transcription des gènes correspondants est co-régulée (Perrson et al. 2005, Brown et al., 2005).
Une modulation précise de la biosynthèse de la paroi secondaire riche en lignine se réalise en fonction des paramètres de l’environnement. Par exemple, les blessures favorisent le métabolisme de la lignine via l’inhibition de l’expression de l’activité (via des modifications post-traductionnelles) du facteur de transcription LTF1, de la famille MYB qui est un inhibiteur de la production de lignine (Gui et al., 2019). De manière générale, LTF1 retarde le dépôt de lignine dans la paroi pour donner le temps à la croissance de la paroi primaire de se faire suffisamment.

Les gibbérellines (une famille d’hormones végétales diterpéniques tétracycliques) stimulent la production de la paroi secondaire.

Croissance de la paroi cellulaire primaire
La croissance de la paroi primaire est un élément essentiel à la croissance en longueur des tiges et, dans une moindre mesure, des racines. L’auxine à de fortes concentrations a surtout un rôle positif sur l’élongation cellulaire dans la tige et un rôle inhibiteur dans la racine.

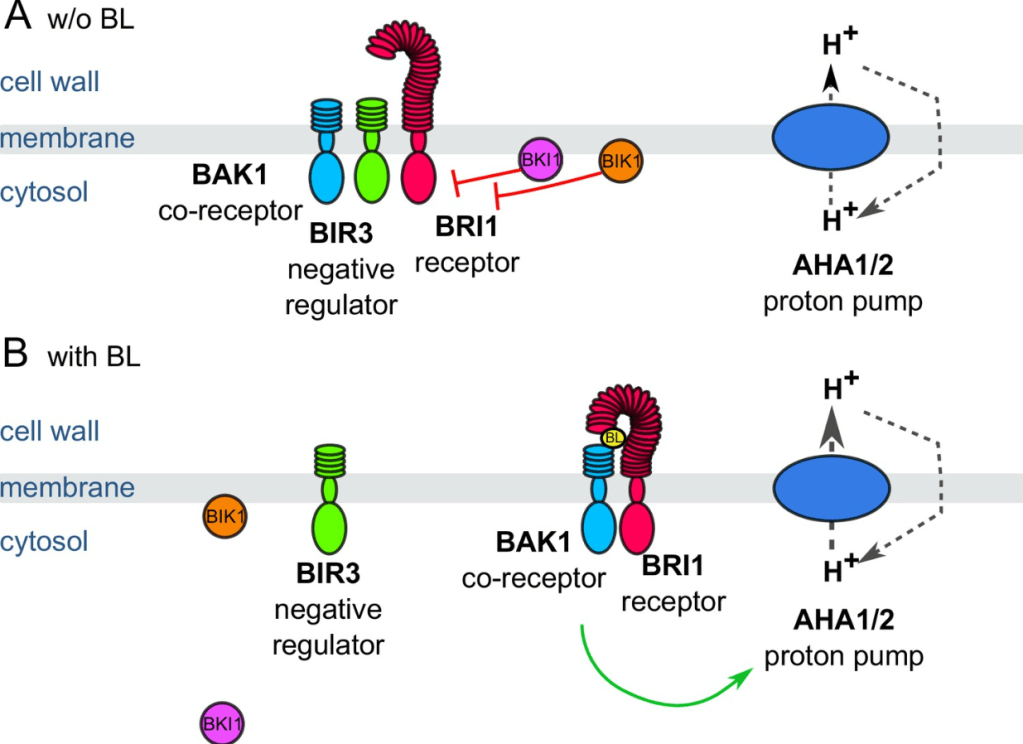
Dans la tige, l’auxine induit une expansion cellulaire rapide et cela peut être mimé par exemple en incubant des segments d’hypocotyle dans un milieu acide (pH 4,5). Cependant, l’action des protons n’est pas directe sur les composants de la paroi car l’expansion en milieu acide n’a pas lieu si les hypocotyles ont été traités au préalable avec des protéases. On en déduit le modèle suivant : l’auxine agit en acidifiant l’apoplasme où se trouve la paroi cellulaire, ce qui entraîne l’activation de protéines localisées dans la paroi qui lui permettent de se relâcher avec la pression de turgescence. Il s’agit d’un mécanisme de croissance connu sous le nom de « théorie de la croissance acide » qui date des années 1970.

Dans la tige, l’auxine déclenche l’efflux de protons, en activant la H+-ATPase de type P localisée dans la membrane plasmique. Chez Arabidopsis, les H+-ATPases sont codées par une famille de gènes qui comprend 11 membres appelés AHA. A la suite de la présence d’auxine, la phosphorylation de l’avant-dernier résidu Thr conservé (Thr948 dans AHA1, Thr947 dans AHA2) invalide l’autoinhibition de l’activité de la pompe ATPase par la région C-terminale cytoplasmique. L’auxine induit l’expression dépendante de TIR1/AFB des protéines SAUR qui agissent comme des inhibiteurs des phosphatases PP2C.D, qui sont responsables de la déphosphorylation de l’avant-dernier résidu des pompes. La signalisation auxine active donc des inhibiteurs des inhibiteurs des H+-ATPases. En parallèle, la signalisation activée par l’auxine stimule l’activité des kinases TMK qui phosphorylent l’avant-dernière Thr des pompes à protons (Lin et al., 2021).

En parallèle, l’auxine stimule également l’exocytose de vésicules qui contiennent des pompes à H+ enrichissant ainsi la membrane plasmique et permettant une acidification de la paroi encore plus importante. L’auxine diminue également l’endocytose des pompes à H+ en inhibant l’expression de la protéine de type SNARE SYP132 qui est impliquée dans ce processus (Xia et al., 2019).

Les protéines activées par la baisse de pH dans la paroi en réponse à l’auxine sont principalement les expansines.
Outre les expansines, l’acidité pariétale active aussi les xyloglucanes endotransglycosylases (XET) qui hydrolysent le squelette des xyloglucanes. Elles permettent l’insertion de nouvelles molécules de xyloglucanes permettant la croissance.
A plus long terme, l’auxine agit en faveur de la croissance cellulaire en stimulant la transcription des gènes codant les expansines ou les enzymes de synthèse des glucides pariétaux.
Les gibbérellines jouent un rôle dans la croissance de la paroi primaire, notamment au niveau des entrenoeuds de la tige. Plusieurs mécanismes complémentaires y contribuent, notamment la régulation des microtubules qui forment un réseau essentiel pour le dépôt de la cellulose et l’expansion cellulaire.

Transport dans la paroi cellulaire
La paroi cellulaire n’a pas qu’une fonction structurale mais est aussi un lieu de passage de diverses molécules.
Des protéines de transfert lipidique LTP permettent de transporter des molécules hydrophobes tels que les lipides et les sesqui-/di-terpènes depuis la membrane plasmique jusqu’à la cuticule (DeBono et al., 2009; Lee et al., 2009). Les molécules de signalisation volatiles telles que l’isoprène ou le limonène sont aussi transportées à travers la paroi par ces protéines de transfert et cela est utile à la fois pour leur émission que pour leur réception (Liao et al., 2023).

Signalisation à partir de la paroi cellulaire
Il existe une voie de signalisation qui permet à la cellule de connaitre l’intégrité de sa paroi cellulaire et de réagir en cas de perte de cette intégrité ou de croitre si la paroi est normale.

L’une des principales protéines impliquées est FERONIA (FER) qui est une kinase qui joue un rôle dans la préservation de l’intégrité des cellules en croissance dans les racines et dans la réponse aux stress biotiques et abiotiques. Le mécanisme par lequel FER perçoit l’état de la paroi cellulaire est peu connu mais il implique des stimuli mécaniques à l’interface paroi/membrane plasmique (Vaahtera et al., 2019) ainsi que des stimuli chimiques : par exemple, la pectine ou les produits de dégradation dérivés de la pectine résultant de la dégradation de la paroi cellulaire lors d’une infection par un agent pathogène sont impliqués dans les réponses au stress biotique et abiotique et peuvent activer des changements dans les niveaux calciques intracellulaires et d’oxygène réactif (ROS) (Benedetti et al., 2015).
Destruction de la paroi cellulaire
La dégradation de la cellulose est bien moins répandue dans le monde vivant que celle de l’amidon et est réalisée par certaines enzymes spécifiques appelées cellulases, présentes chez des micro-organismes, tels que les bactéries et les champignons. Ces enzymes sont capables de décomposer la cellulose en ses unités de glucose constitutives, rendant ainsi la cellulose accessible comme source d’énergie ou de matériaux pour ces organismes et les organismes qui les abritent (les hôtes des microbiotes intestinaux par exemple).
Lors de l’abscission des feuilles, l’éthylène provoque la lyse de composants des parois cellulaires dans la zone d’abscission. Cet effet est contre-balancé par l’auxine lorsque ce n’est pas encore la période de la chute des feuilles.
Par ailleurs, dans les laboratoires de recherche, on peut réaliser une dégradation de la paroi cellulaire pour mettre en culture des protoplastes, des cellules végétales sont paroi qui prennent une forme sphérique. Les protoplastes sont utilisés pour réaliser des transformations génétiques, étudier la biochimie cellulaire sans être perturbé par des composants de la paroi, etc…

D’AUTRES RESSOURCES POUR APPROFONDIR :
Cours Unisciel sur la paroi des cellules végétales
- Adhérences cellule-cellule
- Arabidopsis thaliana
- Axe antéro-postérieur chez la drosophile
- Caenorhabditis elegans
- Concepts principaux
- Contrôle de la traduction
- Contrôle de la transcription
- Contrôle génétique et épigénétique
- Croissance et guidage axonal
- Des modèles animaux moins classiques
- Développement de l’oeil des Vertébrés
- Développement et évolution
- Et l’Humain ?
- Exercices sur l’ovogenèse, la spermatogenèse et la fécondation
- Exercices sur le contrôle de l’expression des gènes
- Exercices sur le développement des bourgeons de membre
- Exercices sur le développement des muscles striés squelettiques
- Exercices sur les cycles et les divisions cellulaires
- Exercices sur les étapes du développement, les inductions embryonnaires et la mise en place des axes de polarité
- Exercices sur les matrices extracellulaires, le cytosquelette et les adhérences cellule-cellule
- Exercices sur les voies de signalisation
- Glossaire
- Glossaire des termes liés à la génétique
- Glossaire des termes liés au cytosquelette, la matrice extracellulaire, l’adhérence et la migration cellulaire
- Hématopoïèse et développement des cellules du système immunitaire
- Histoire de la biologie cellulaire et de la biologie du développement
- L’acide rétinoïque
- L’apoptose
- L’autophagie
- L’organogenèse
- L’ovogénèse prépare le développement embryonnaire
- La drosophile
- La fécondation
- La formation des somites
- La gastrulation
- La métamorphose chez les Hexapodes et les Amphibiens
- La neurogénèse chez les mammifères adultes
- La neurulation
- La poule
- La souris
- La superfamille TGFβ et ses voies de signalisation
- La voie de signalisation de l’auxine et ses rôles
- La voie de signalisation Hedgehog
- La voie de signalisation Hippo et ses composants YAP/TAZ
- La voie de signalisation Notch
- Le clivage
- Le cytosquelette
- Le destin des cellules et les réseaux de régulation génique
- Le développement des bourgeons de membre
- Le développement des muscles striés squelettiques
- Le développement des organes génitaux et des cellules germinales
- Le développement du cortex
- Le méristème apical caulinaire en phase végétative et lors de la formation d’une fleur
- Le poisson zèbre
- Le xénope
- Les cellules des crêtes neurales
- Les cellules et les gènes en action dans le développement
- Les cellules souches
- Les cellules tumorales
- Les cycles et les divisions cellulaires
- Les étapes du développement
- Les étapes du développement embryonnaire d’Arabidopsis thaliana et leur contrôle
- Les inductions embryonnaires et les gradients de morphogène
- Les matrices extracellulaires animales
- Les organismes modèles
- Les outils pour étudier l’expression et la fonction des gènes
- Les techniques et les outils pour la biologie cellulaire
- Les transitions épithélio-mésenchymateuses et les migrations cellulaires
- Les vésicules extracellulaires
- Les voies de signalisation
- Les voies de signalisation FGF
- Mise en place des axes chez les Vertébrés
- Structures et processus cellulaires
- Voies de signalisation WNT
