Par Patrick Pla, Université Paris-Saclay
- Mise en perspective évolutive des yeux des vertébrés
- Développement précoce de l’oeil
- Prolifération, détermination et différenciation dans la rétine neurale en développement
- Les capacités de régénération de la rétine
- Développement de rétines à partir de cellules souches pluripotentes humaines : vers une thérapie tissulaire
Mise en perspective évolutive des yeux des vertébrés
Les yeux sont des organes sensoriels qui permettent de percevoir la lumière et de former une image qui est plus ou moins détaillée selon les espèces. Il existe différents types d’yeux dans le règne animal.

Tous ces types d’yeux dépendent d’un programme génétique qui est en partie commun. Il est activé par le facteur de transcription Pax6 (ou eyeless chez la drosophile).

L’expression du Pax6 de souris par transgénèse dans la drosophile (ou même l’expression de Pax6 du calmar) aboutit à la formation d’un oeil ectopique, mais un oeil composé de drosophile, pas un oeil de souris ou de calmar ! Cela veut dire que le facteur de transcription Pax6 « donne l’ordre » de former un oeil mais la manière de répondre à cet ordre (c’est-à-dire les gènes activés en aval) dépend de l’organisme.

Signalons tout de même qu’en aval de Pax6, le tout début de la cascade menant à la formation d’un oeil est aussi conservé avec l’activation de l’expression de sine oculis (Six chez les Vertébrés), de eyes absent (Eya1-4 chez les Vertébrés) et de dachshund (Dach chez les Vertébrés).
Cependant, des yeux d’un type particulier dans des taxons éloignés comme les yeux à chambre des Vertébrés et des Céphalopodes ne sont pas homologues car ils ne sont pas hérités d’un ancêtre commun. Leur similitude ne provient que du fait que certaines lois de la physique ne peuvent pas être contournées et que les solutions biologiques pour former une image sont limitées.
L’œil de la drosophile se compose d’environ 800 ommatidies régulièrement disposées, chacune étant composée de 8 neurones photorécepteurs (cellules R) (R1-R8), disposés selon un motif trapézoïdal défini. Ils sont accompagnés de 12 cellules accessoires. Au cours du développement post-embryonnaire, l’œil se développe à partir d’un disque imaginal épithélial, qui est initialement composé de précurseurs multipotents identiques. Au fur et à mesure qu’une vague de prolifération et de différenciation cellulaire (appelée sillon morphogénétique) traverse le disque de l’arrière vers l’avant, des groupes régulièrement espacés de cellules en différenciation se forment dans son sillage et maturent ensuite en groupes d’ommatidies.
Développement précoce de l’oeil
Le développement de l’œil humain commence à 3 semaines et se poursuit jusqu’au 5ème mois postnatal. Cela commence par l’expression d’un ensemble de facteurs de transcription dans la partie de la plaque neuroectodermique nommée champ oculaire (Zuber et al., 2003). Parmi ces facteurs de transcription, Six3 et Rax jouent des rôles particulièrement notables. Six3 peut induire à lui tout seul une cupule optique dans le mésencéphale de manière ectopique (Fujimura, 2016). Six3 inhibe localement la signalisation Wnt ce qui est nécessaire à la formation du champ oculaire.
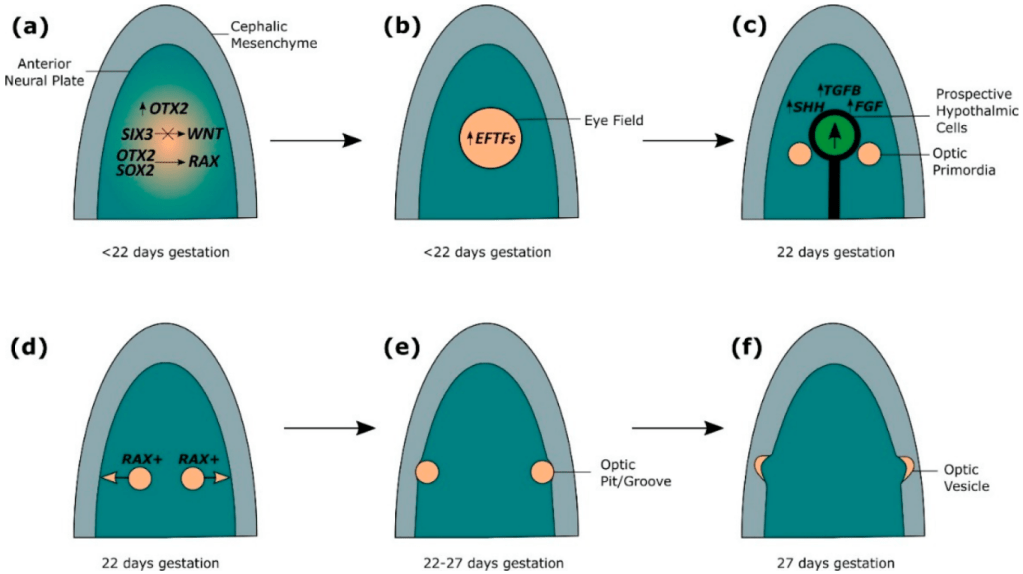
La signalisation du mésoderme pré-chordal et notamment SHH divise le champ oculaire unique en une moitié droite et une moitié gauche. L’inhibition de l’expression de Pax6 dans la ligne médiane contribue à séparer le champ en deux. Des anomalies dans cette signalisation peuvent aboutir à une cyclopie (oeil unique, frontal).

Ensuite, se forment deux vésicules optiques autour de la 4ème semaine du développement humain. La région distale de la vésicule optique s’invagine pour former une structure en forme de coupe, la coupe ou cupule optique. Ces mouvements sont sous le contrôle du facteur de transcription Rax.

La rétine et l’épithélium pigmentaire rétinien (RPE) sont formés respectivement à partir des parois externe et interne de la vésicule optique et commencent à exprimer des facteurs de détermination différents : Vsx2 (ancien nom Chx10) pour la rétine et Mitf pour le RPE (Mitf est un facteur de transcription (qui est aussi exprimé dans les mélanocytes issus des crêtes neurales) et qui active la transcription des gènes codant les enzymes permettant de synthétiser les mélanines). Le mésenchyme autour de la coupe optique donne naissance à la sclérotique qui forme notamment le « blanc de l’oeil » et à la choroïde où se développe la vascularisation ainsi que quelques cellules pigmentées indépendantes de celles du RPE (les cellules pigmentées de la choroïde dérivent des crêtes neurales).
La partie non neurale de l’oeil est formée à partir de l’ectoderme sus-jacent aboutissant à la cornée et au cristallin. De nombreuses signalisations/inductions croisées ont lieu entre ectoderme non-neural et neurectoderme.
La vésicule optique qui est une expansion du prosencéphale (cerveau antérieur) envoie des signaux inducteurs vers l’épiderme de la placode du cristallin : BMP4, FGF8 et Delta. L’épiderme avait déjà été rendu compétent à ces signaux au préalable. La placode du cristallin envoie en retour des FGF qui activent la formation de la coupe optique, laquelle envoie en retour d’autres FGF qui provoquent l’invagination de la placode. Il s’agit d’un exemple classique d’inductions réciproques successives (Ogino et al., 2012).

Les FGF envoyés par la placode du cristallin sont indispensables pour activer l’expression de Vsx2 dans la future rétine. Le mésenchyme céphalique intervient également en envoyant des signaux (notamment TGFβ) qui activent l’expression de Mitf dans le futur épithélium pigmenté rétinien (RPE) et y inhibent l’expression de Vsx2. La zone frontière entre RPE se raffine notamment par le fait que Vsx2 réprime l’expression de Mitf (Horsford et al., 2005).
L’invagination de la rétine est cruciale pour la formation de la coupe optique (Fuhrmann, 2010). Des études sur des coupes optiques auto-organisées à partir de cellules souches embryonnaires humaines ont suggéré que leur formation est un processus spontané qui consiste en trois processus locaux consécutifs : relaxation de la rétine, constriction apicale de la région charnière et expansion tangentielle (Eiraku et al., 2012). Adjacente à la région charnière où se produit l’invagination de la rétine se trouve la zone marginale ciliaire (CMZ), qui sert de pool de cellules souches pour la neurogenèse rétinienne pendant le développement et éventuellement la régénération de l’œil des vertébrés (Bélanger et al., 2017; Fischer et al., 2013; Kuwahara et al., 2015). La signalisation SCF/SCFR facilite l’invagination de la rétine humaine en accélérant la progression du cycle cellulaire des cellules progénitrices rétiniennes (RPC), en régulant la dynamique du cytosquelette et en améliorant la constriction apicale dans la CMZ (Gong et al., 2019).

Prolifération, détermination et différenciation dans la rétine neurale en développement
Nous nous intéresserons ici au développement de la rétine neurale, la partie photoréceptrice des yeux où le signal lumineux est tranformé en signal nerveux qui est transféré vers le cerveau, chez les Vertébrés. L’autre partie, la rétine non-neurale est l’épithélium pigmenté rétinien (RPE).
Présentation rapide de la rétine :
La rétine des vertébrés est composée de cinq grands types de cellules neuronales et de trois types de cellules gliales (glie de Müller, astrocytes et cellules microgliales) qui sont organisés en trois couches différentes. Chacun des types de cellules rétiniennes est généré d’une manière ordonnée qui a été bien étudiée chez les vertébrés.

Signalons que les astrocytes ne sont présents que dans la rétine des Mammifères et pas dans la rétine des autres vertébrés (Paisley et Key, 2021). Ils jouent un rôle important dans le développement des vaisseaux sanguins de la rétine qui ne sont présents que chez les Mammifères.
Il existe deux grands types de photorécepteurs : les cones et les batonnets qui diffèrent par leur sensibilité (batonnets plus sensibles), leurs molécules photoréceptrices et leur distribution spatiale dans la rétine. Les cellules horizontales, bipolaires et amacrine traitent et intègrent les informations reçues par les photorécepteurs avant de transmettre l’information aux cellules ganglionnaires qui projettent leur axone dans ce qui forme le nerf optique. Dans le détail, il y en a une quarantaine de sous-types.
Initialement, la rétine n’est formée que d’une couche cellulaire externe (dite zone nucléaire) et une couche acellulaire interne. Les différentes couches et les différents types cellulaires de la rétine se mettent en place progressivement à partir du développement de cellules souches rétiniennes multipotentes.

La chronologie du développement de la rétine chez l’Homme peut être divisée en 3 périodes :
- 4,6-7,5 semaines post-conception (PCW) : prolifération des progéniteurs rétiniens, de l’épithélium pigmenté rétinien (RPE) et émergence du cristallin. C’est processus sont associés à l’augmentation de l’expression des gènes agissant dans les voies de signalisation (TGF/BMP, WNT) impliqués dans le développement ;
- 7,5-10 PCW : émergence de cellules ganglionnaires rétiniennes (RGC) et initiation des programmes transcriptionnels qui contrôlent le développement des interneurones (cellules horizontales et amacrines) ainsi que des cônes ;
- 11-18 PCW : émergence séquentielle de cônes, des batônnets, des cellules amacrines, bipolaires et gliales de Müller.
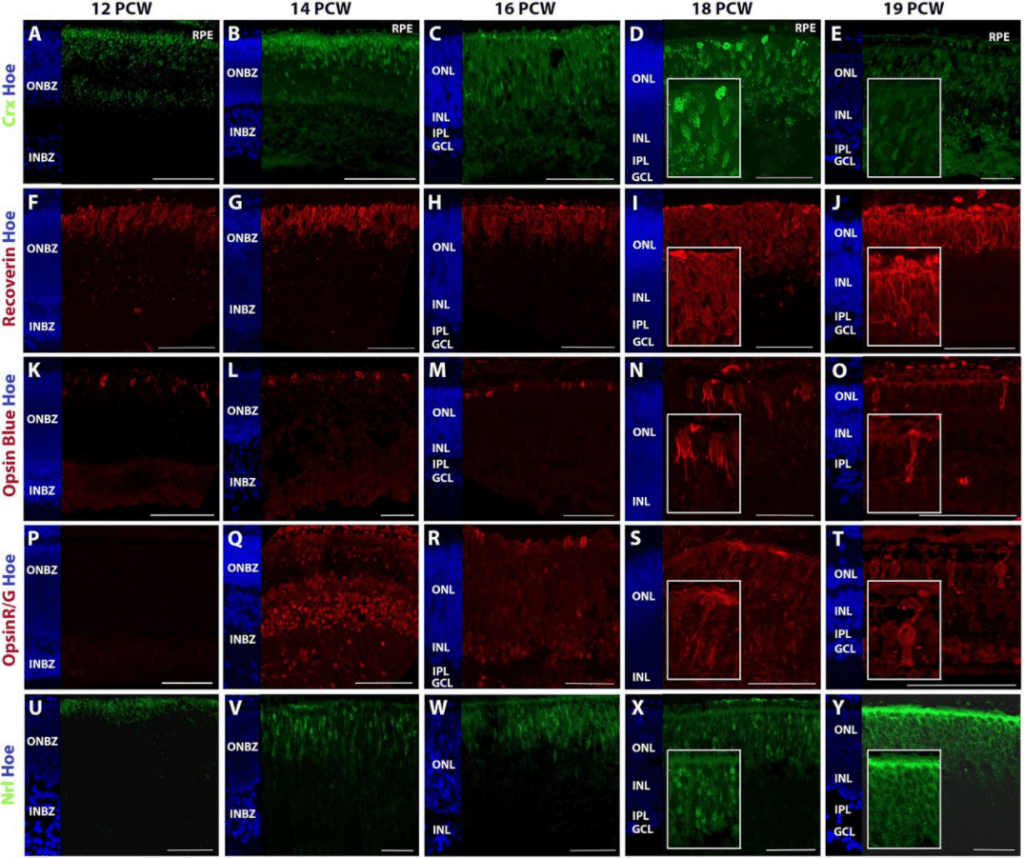
Les progéniteurs rétiniens multipotents progressent à travers des états de compétence régulés dans le temps au cours desquels elles génèrent des types cellulaires distincts dans une séquence définie qui est conservée au cours de l’évolution des vertébrés : d’abord les cellules ganglionnaires (RGC) et les cellules amacrines GABAergiques, ensuite les cellules amacrines glycinergiques, les cellules horizontales, les cellules bipolaires et les photorécepteurs.


Différents facteurs de transcription orientent la détermination vers tel ou tel lignage. Par exemple, Atoh7 est nécessaire à la formation des cellules ganglionnaires. Des mutations dans la séquence codante d’Atoh7 ou dans ces séquences régulatrices aboutissent à une absence ou à une forte réduction du nerf optique (formé normalement par les axones des cellules ganglionnaires) (Miesfeld et al., 2020).

Réciproquement, l’inhibition de son expression est nécessaire à la formation des cellules horizontales et amacrines. Pour les photorécepteurs, la voie Wnt doit être inhibée et le gène Crx doit s’exprimer. Les cellules s’orientent vers une différenciation en cônes lorsqu’elles expriment Thrb et Oc1 dans un premier temps puis l’une des opsines et RXRG. Cette différenciation est sous le contrôle des FGF alors que la différenciation en bâtonnets se fait sous l’influence de Shh. dans ce cas, l’expression de Oc1 est inhibée. La différence de répartition de ces molécules de signalisation peut expliquer la différence de répartition des cônes et des bâtonnets dans la rétine (plus de cones au niveau de la fovéa, le pint d’acuité visuelle maximale). La différenciation des photorécepteurs est un long processus et les bâtonnets ne sont pleinement différenciés que 4 mois après la naissance chez l’Homme.
La bonne différenciation des photorécepteurs dépend de la bonne différenciation du cil primaire dont est dérivé le segment externe qui est directement responsable de la photoréception dans ces cellules. Des ciliopathies peuvent ainsi affecter les photorécepteurs. Une mutation dans le gène RPGR est impliquée dans environ 15% des patients atteints de rétinite pigmentaire et son produit est exprimé à l’interface entre le centrosome et le cil des photorécepteurs (Deng et al., 2018).
La vision trichromatique des couleurs chez les Primates dits de l’Ancien Monde (dont font partie les humains) dépend de la présence de 3 cônes différents avec chacun un gène particulier d’opsine qui s’exprime : S (pour Short wavelength), M (pour Medium wavelength) et L (pour Long wavelength). On commence à comprendre les voies de signalisation impliqués dans l’activation de chacune des opsines. Par exemple, l’acide rétinoïque favorise l’expression de l’opsine M au détriment de l’expression de l’opsine L dans la population des cônes en différenciation (Hadyniak et al., 2024).

D) Les barres noires indiquent des fenêtres temporelles d’ajout de RA pendant la différenciation organoïdes rétiniens humains à partir de cellules iPS. (E) Quantification des ratios de cônes M et L pour les traitements (F – I) Expression des ARNm codant l’opsine M (bleu) ou l’opsine L (rose) vue par hybridation in situ fluorescente dans des organoïdes cultivés dans différentes conditions comme en (E) (D), quantifiées dans (E). Les contours en pointillés blancs indiquent les cellules exprimant les différentes opsines (des cones). Source : https://journals.plos.org/plosbiology/article?id=10.1371/journal.pbio.3002464

Les cellules ganglionnaires de la rétine, une fois mises en place, font croitre leur axone et l’ensemble des axones forment le nerf optique. Des signaux moléculaires, notamment les récepteurs Eph et les ligands éphrine, et les interactions Robo/Slit guident les axones en favorisant ou en inhibant la formation du cône de croissance (Campbell et al., 2007, Kita et al., 2014). Ces instructions permettent de définir el trajet des axones, la synaptogenèse et la cartographie rétinotopographique. Bon nombre de ces signaux sont conservés dans les voies visuelles des vertébrés (Erskine et al., 2007). Une partie des axones des cellules ganglionnaires passe de l’autre côté du plan de symétrie bilatérale (du côté contralatéral) dans le chiasma optique mais chez certains Mammifères, certains des axones restent du côté ipsilatéral, permettant une vision binoculaire (les informations concernant un même objet mais vu par les deux yeux (avec un léger décalage spatial) sont traitées dans le même côté du cortex). Le facteur de transcription Zic2 est nécessaire et suffisant pour que les axones des cellules ganglionnaires restent du côté ipsilatéral (Herrera et al., 2003).
Comme dans le reste du système nerveux central, les cellules gliales se mettent en place après les neurones à partir des mêmes cellules souches neurales, comme l’ont montré les études de lignage cellulaire (Turner et al., 1990). Le destin glial dans la rétine dépend de l’activation de l’expression de Lhx2 et de Hesr2 (De Melo et al., 2018; Tetsu Satow, 2001) et permet de générer les cellules gliales de Müller. L’activation de la voie Notch est nécessaire dans les futures cellules de Müller.
Des processus de maturation intrinsèques régulent principalement le moment de la genèse de tel ou tel type cellulaire et les progéniteurs tardifs ne peuvent générer des types cellulaires antérieurs aux cellules progénitrices de stade avancé, ce qui correspond à un changement de compétence pour générer des types de cellules rétiniennes précoces par rapport aux types de cellules rétiniennes tardives (Mattar et Cayouette, 2022).

Les modifications des histones contribuent aux changements dans la capacité des progéniteurs du système nerveux central à générer divers types de cellules et jouent également un rôle dans le développement rétinien (Raeisossadati et al., 2021). Une modification répressive, la méthylation de l’histone H3 au niveau de la lysine 27 (H3K27me3) est régulée de manière dynamique sur les séquences régulatrices des gènes exprimés dans les progéniteurs et les cellules qui se différencient au cours du développement rétinien de la souris et de l’Homme. La méthylation de H3K27 est catalysée par le complexe répressif polycomb 2 (PRC2). Chez les progéniteurs rétiniens, la perte de composants de PRC2, Ezh2 ou Eed, entraîne une dérépression généralisée des gènes qui ne sont normalement pas exprimés dans les lignées rétiniennes, une différenciation accélérée des types de cellules tardifs, ainsi qu’une sortie prématurée du cycle cellulaire entraînant une déplétion des progéniteurs. La répression de l’expression des gènes médiée par PRC2 maintient donc l’identité rétinienne des progéniteurs et contrôle la temporalité de leur séquence de différenciation.
La rétine peut aussi être un centre de signalisation pour organiser les tissus aux alentours. Par exemple, elle sécrète de l’acide rétinoïque qui agit sur les cellules du mésenchyme périoptique (dérivé des cellules de crêtes neurales) pour limiter leur prolifération.

La taille d’un organe comme l’oeil a un impact important sur sa fonction car les propriétés optiques dépendent de la distance entre les différents éléments. Des voies de signalisation sont impliquées dans le contrôle de ce paramètre, notamment la voie BMP qui a un rôle inhibiteur de la croissance de l’oeil (Mai et al., 2022). Une diminution de l’expression de Bmp2 est associée à la myopie dans divers modèles animaux (la myopie est souvent causée par une taille trop grande de l’oeil) (He et al., 2018 ; Wang et al., 2015 ; Zhang et al., 2012, 2016, 2019). Le polymorphisme mononucléotidique (SNP) BMP2 humain rs235770 est associé à la myopie (Verhoeven et al., 2013).

Contrairement aux mammifères, la neurogenèse des bâtonnets dans la rétine des poissons se poursuit tout au long de la vie. Les nouveaux bâtonnets sont générés à partir d’une population de progéniteurs exprimant Pax6 à prolifération lente dans la couche nucléaire interne (INL) (Otteson et al., 2001). Ces progéniteurs proviennent des cellules gliales de Müller et continuent à se diviser en migrant vers l’extérieur de la rétine pour devenir des précurseurs de photorécepteurs, qui se différencient ensuite en bâtonnets. La neurogenèse en continue dans la rétine du poisson semble maintenir les cellules de Müller prêtes à répondre à des lésions rétiniennes et les poissons présentent des capacités de régénération remarquables. Cette capacité a été malheuresement perdue chez les mammifères.
Le rétinoblastome est la tumeur maligne intraoculaire la plus répandue chez les enfants, avec un taux de survie inférieur à 30 %. Un modèle de Rb dans des organoïdes rétiniens à été développé par dérivation de cellules souches embryonnaires humaines génétiquement modifiées par mutagenèse pour aboutir à une perte-de-fonction homozygote du gène RB1, un gène suppresseur de tumeur très fréquemment muté dans les rétinoblastomes. Ces organoïdes mutés portent des tumeurs très proches des rétinoblastomes. L’analyse en transcriptomique de cellules isolées suggère que les cellules tumorales proviennent de précurseurs de cônes de maturation positifs pour ARR3 au cours du développement (Liu et al., 2020). Reste à savoir si tous les rétinoblastomes in vivo dérivent aussi de ce genre de cellules ou si une diversité existe.
Les capacités de régénération de la rétine
Des blessures, une exposition trop importante à de fortes intensités lumineuses ou des maladies génétiques peuvent causer une dégénérescence, notamment des photorécepteurs.

A la suite de ces dégénérescences, il existe de grandes variations dans les capacités de régénération parmi les Vertébrés. Les poissons tels que le posson-zèbre ont d’excellentes capacités, les amphibiens tels que le xénope des capacités limitées et les mammifères des capacités quasi-inexistantes. Cela tient essentiellement à des différences de comportement des cellules gliales de Müller : chez le poisson-zèbre, ces cellules sont capables de se dédifférencier et d’acquérir des propriétés de cellules souches. La quiescence des cellules de Müller est contrôlée par la voie Notch qui est inhibée lorsque les cellules se remettent à proliférer en cas de dommages à la rétine (Campbell et al., 2022). Par division asymétrique, elles peuvent générer des précurseurs neuronaux multipotents qui, après prolifération puis différenciation, peuvent remplacer les photorécepteurs et les autres neurones manquants. En revanche, en cas de dégénérescence chez les mammifères, les cellules gliales de Müller entrent en gliose, deviennent hypertrophiques et forment des « cicatrices gliales » mais ne génèrent pas de précurseurs « utiles ».

On peut « forcer » les cellules gliales de Müller de Mammifères à former des nouveaux neurones notamment en leur faisant exprimer le facteur proneural Ascl1 (Jorstad et al., 2017) ou en inhibant l’expression des facteurs NFI qui maintiennent un état glial (Hoang et al., 2020).
Développement de rétines à partir de cellules souches pluripotentes humaines : vers une thérapie tissulaire
On estime que 596 millions de personnes dans le monde ont actuellement une déficience visuelle et environ 43,3 millions de personnes sont aveugles. Cela souligne le besoin de développer des stratégies thérapeutiques pour parvenir au moins à limiter les troubles fonctionnels de la vue.
Des tentatives de thérapies cellulaires ont été effectués sur des types cellulaires de la rétine.
Des précurseurs rétiniens ont été produits in vitro à partir de cellules ES murines et ils ont été injectés dans la rétine de modèles de souris rendues aveugles (Crx-/-). Les précurseurs ont migré dans l’ONL et se sont différenciés en photorécpeteurs qui se sont intégrés dans les circuits rétiniens. Les souris ont retrouvé partiellement la vision (Reh 2009).
En 2014, au Japon, une tentative de thérapie cellulaire à partir de dérivés de cellules iPS a eu lieu pour soigner des patients atteints de DMLA (Dégénérescence maculaire liée à l’âge). Il s’est avéré que les cellules iPS avaient accumulé trop de mutations. Les tests ont été refaits, non pas avec des lignées iPS générées à partir des patients (autogreffe) mais à partir de lignées iPS sélectionnés sur le critère qu’elles mutent nettement moins.
La rétine est cependant un bon candidat pour être réparé par thérapie tissulaire (et non pas cellulaire) où c’est un tissu entier avec de multiples types cellulaires qui est greffé (et non pas un seul type cellulaire). A partir du début des années 2010, de nombreuses mises au point de protocole ont permis de produire des organoïdes rétiniens à partir de cellules souches pluripotentes d’abord murines (de souris) et puis humaines. Notamment, En 2011, l’équipe de Yoshiki Sasai (Japon) a mis au point une protocole de différenciation de rétine en 3D (dans du Matrigel) où toutes les couches cellulaires de la rétine ont pu se développer correctement. La plupart des protocoles repose sur des cultures en suspension de vésicules optiques en 3D.

A l’aide de facteurs dans le milieu, on peut orienter la différenciation au sein de ces organoïdes : par exemple la présence d’acide rétinoïque favorise le développement de bâtonnets et son absence favorise le développement de cônes (Sanjurjo-Soriano et al. 2022).
Ces organoïdes rétiniens peuvent être utilisés pour élucider les mécanismes menant à des pathologies comme des formes de rétinite pigmentaire dont la modélisation chez la souris n’était pas consistante avec les formes humaines de la pathologie (Deng et al., 2018). Pour envisager des applications thérapeutiques, il faut s’affranchir le plus possible de produits d’origine animale (le Matrigel par exemple ou les sérums). On parle de protocoles « xeno-free ».
EN DIRECT DES LABOS :
EQUIPES FRANCOPHONES TRAVAILLANT SUR LE SUJET :
Equipe « Cellules souches et neurogenèse dans la rétine » – Institut des Neurosciences Paris Saclay
- Adhérences cellule-cellule
- Arabidopsis thaliana
- Axe antéro-postérieur chez la drosophile
- Caenorhabditis elegans
- Concepts principaux
- Contrôle de la traduction
- Contrôle de la transcription
- Contrôle génétique et épigénétique
- Croissance et guidage axonal
- Des modèles animaux moins classiques
- Développement et évolution
- Et l’Humain ?
- Exercices sur l’ovogenèse, la spermatogenèse et la fécondation
- Exercices sur le contrôle de l’expression des gènes
- Exercices sur le développement des bourgeons de membre
- Exercices sur le développement des muscles striés squelettiques
- Exercices sur les cycles et les divisions cellulaires
- Exercices sur les étapes du développement, les inductions embryonnaires et la mise en place des axes de polarité
- Exercices sur les matrices extracellulaires, le cytosquelette et les adhérences cellule-cellule
- Exercices sur les voies de signalisation
- Glossaire
- Glossaire des termes liés à la génétique
- Glossaire des termes liés au cytosquelette, la matrice extracellulaire, l’adhérence et la migration cellulaire
- Hématopoïèse et développement des cellules du système immunitaire
- Histoire de la biologie cellulaire et de la biologie du développement
- L’acide rétinoïque
- L’apoptose
- L’autophagie
- L’organogenèse
- L’ovogénèse prépare le développement embryonnaire
- La drosophile
- La fécondation
- La formation des somites
- La gastrulation
- La métamorphose chez les Hexapodes et les Amphibiens
- La neurogénèse chez les mammifères adultes
- La neurulation
- La poule
- La souris
- La superfamille TGFβ et ses voies de signalisation
- La voie de signalisation de l’auxine et ses rôles
- La voie de signalisation Hedgehog
- La voie de signalisation Hippo et ses composants YAP/TAZ
- La voie de signalisation Notch
- Le clivage
- Le cytosquelette
- Le destin des cellules et les réseaux de régulation génique
- Le développement des bourgeons de membre
- Le développement des muscles striés squelettiques
- Le développement des organes génitaux et des cellules germinales
- Le développement du cortex
- Le méristème apical caulinaire en phase végétative et lors de la formation d’une fleur
- Le poisson zèbre
- Le xénope
- Les cellules des crêtes neurales
- Les cellules et les gènes en action dans le développement
- Les cellules souches
- Les cellules tumorales
- Les cycles et les divisions cellulaires
- Les étapes du développement
- Les étapes du développement embryonnaire d’Arabidopsis thaliana et leur contrôle
- Les inductions embryonnaires et les gradients de morphogène
- Les matrices extracellulaires animales
- Les organismes modèles
- Les outils pour étudier l’expression et la fonction des gènes
- Les parois des cellules végétales
- Les techniques et les outils pour la biologie cellulaire
- Les transitions épithélio-mésenchymateuses et les migrations cellulaires
- Les vésicules extracellulaires
- Les voies de signalisation
- Les voies de signalisation FGF
- Mise en place des axes chez les Vertébrés
- Structures et processus cellulaires
- Voies de signalisation WNT
