Par Patrick Pla, Université Paris-Saclay
Les transitions épithélio-mésenchymateuses
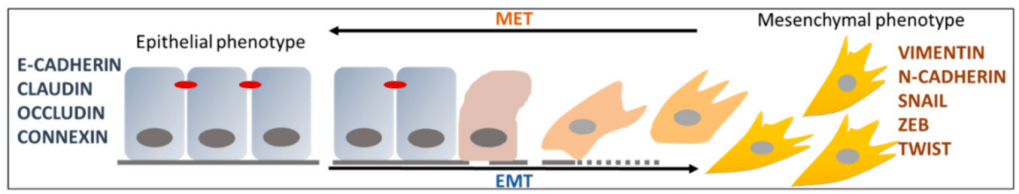
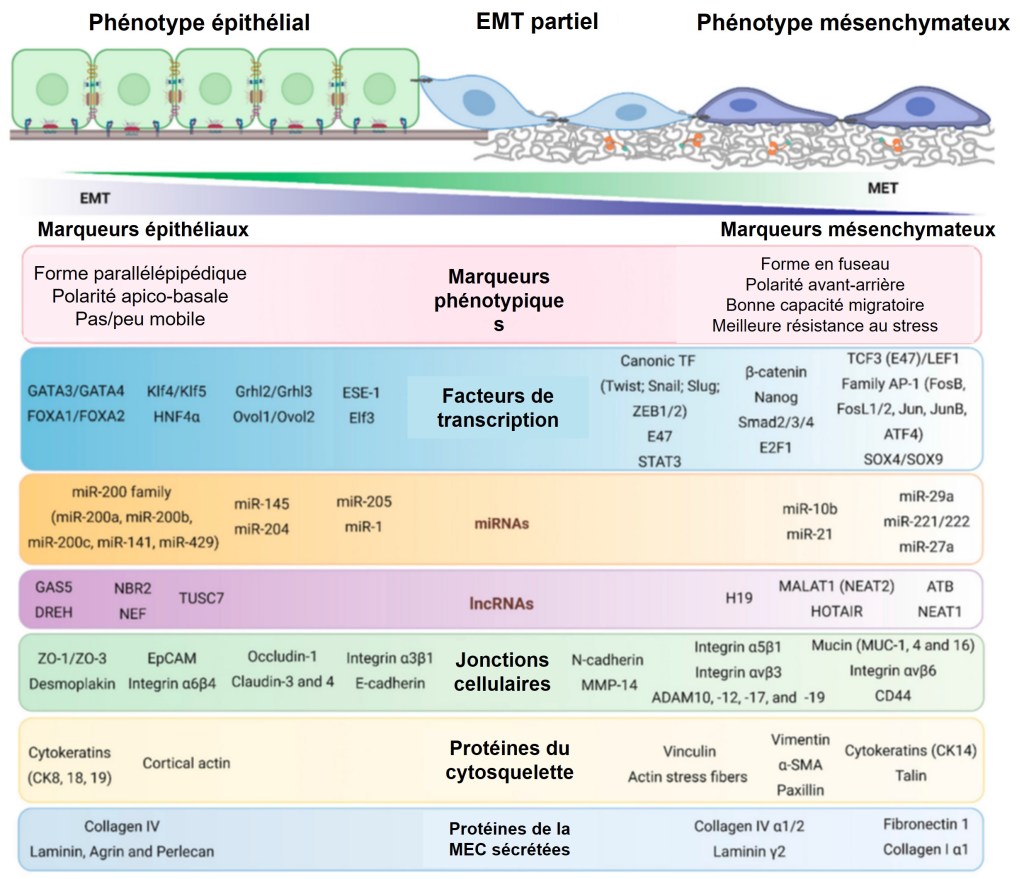
La transition épithélio-mésenchymateuse (EMT) consiste pour une cellule en l’acquisition de propriétés mésenchymateuses à la place de caractéristiques épithéliales. Cela implique la perte (éventuellement partielle) d’interactions cellule-cellule et de la polarité apico-basale, et le gain de caractéristiques mésenchymateuses telles que les expansions cytosoliques, la polarité arrière-avant et l’augmentation de la capacité de migration et d’invasion, le tout accompagné d’un changement radical de type d’interactions cellules-matrice extracellulaire (MEC). Il ne faut cependant pas voir ces états de manière trop binaire : il existe de nombreux états intermédiaires.
L’EMT est impliquée dans de nombreux processus physiologiques (développement embryonnaire, cicatrisation) et pathologiques (fibrose, cancers). De nombreuses études sur les EMT lors du développement embryonnaire ont été suivies de la découverte des mêmes acteurs impliqués dans le passage de tumeurs in situ à des métastases (80 % des cancers ont pour origine des cellules épithéliales et c’est lorsqu’elles deviennent mésenchymateuses que les cellules tumorales deviennent vraiment dangereuses).
Une version commentée de cette figure est disponible en vidéo.
Source : https://www.pnas.org/doi/10.1073/pnas.2009997117
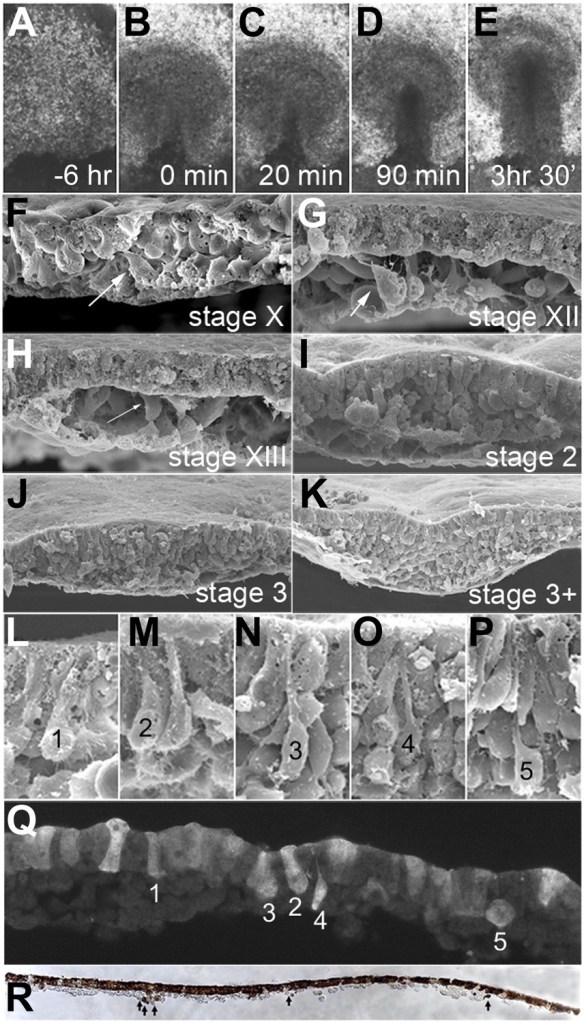
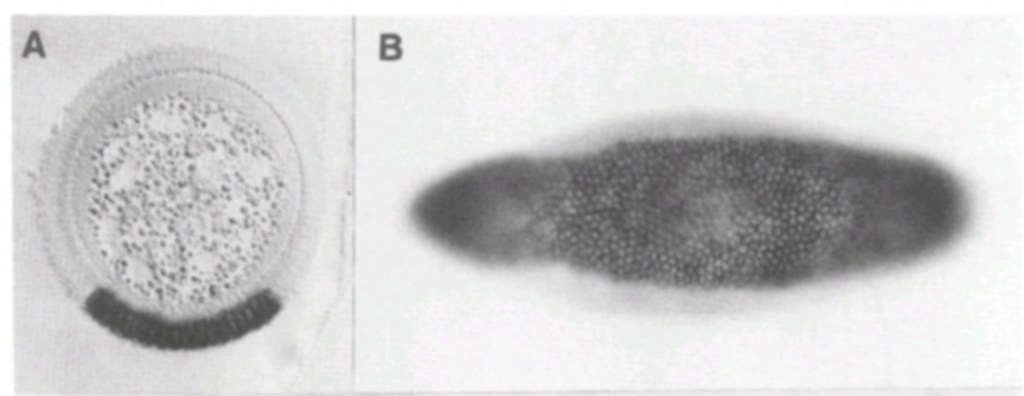
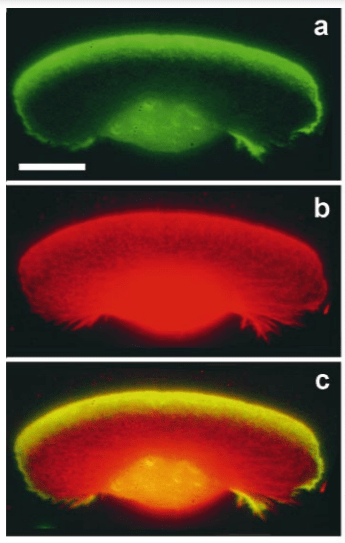
(A–E) Images montrant l’épiblaste uniforme 6 heures (A, stade EG&K XII) et juste avant la formation de la ligne primitive (B, stade EG&K XIV), la première apparition de la ligne primitive (C, stade HH2), l’accumulation de mésoderme sous la ligne primitive (D, stade HH3), apparition d’un sillon dans la ligne primitive et l’émigration du mésoderme (E, stade HH3+). (F-K) Microscopie électronique à balayage d’embryons fracturés avant (F-H) et après (I-K) formation de la ligne primitive. Les flèches blanches indiquent une transition épithélio-mésenchymateuse (EMT) possible avant la formation de la ligne primitive. (L–P) Microscopie électronique à balayage de ligne primitive fracturée, montrant des cellules en EMT avec divers degrés de constriction apicale et d’expansion basolatérale (classées comme « stades d’entrée 1 à 5 »). (Q) Cet embryon a été cultivé pendant 1 heure après électroporation d’un morpholino fluorescent témoin dans tout l’épiblaste au stade XI, puis sectionné sagittalement et visualisé sous fluorescence. Les cellules marquées dans l’épiblaste présentent des morphologies similaires à celles des images de microscopie électronique (panneaux L-P, « stades d’entrée 1 à 5 »). (R) Cet embryon a été cultivé pendant 4 heures après électroporation d’un morpholino fluorescent témoin dans tout l’épiblaste au stade XI, puis fixé (au stade XII), sectionné sagittalement et coloré avec un anticorps anti-fluorescéine (marron). La coupe montre plusieurs cellules qui ont quitté l’épiblaste et se trouvent maintenant dans l’espace sous-jacent dans toute l’étendue antéro-postérieure de l’embryon (flèches). Source : https://elifesciences.org/articles/01817
Historique
Elizabeth Hay (1927-2007) à Harvard a été la première à décrire l’EMT et à utiliser plus tard ce terme. À partir de 1958, elle a travaillé sur la régénération des membres d’amphibiens et notamment décrit la dédifférenciation des cellules cartilagineuses des membres de la salamandre, qui peuvent participer à la formation de nouveaux membres en se redifférenciant. Ce processus ressemble à une EMT. Elizabeth Hay a ensuite travaillé sur le développement embryonnaire du poulet. Grâce aux descriptions très précises des images de microscopie optique et électronique obtenues à partir de tissus embryonnaires, elle a identifié et répertorié différents phénotypes cellulaires. En 1968, elle a décrit comment les tissus mésenchymateux sont issus des cellules épithéliales lors de l’émergence et de la migration des cellules de la crête neurale.
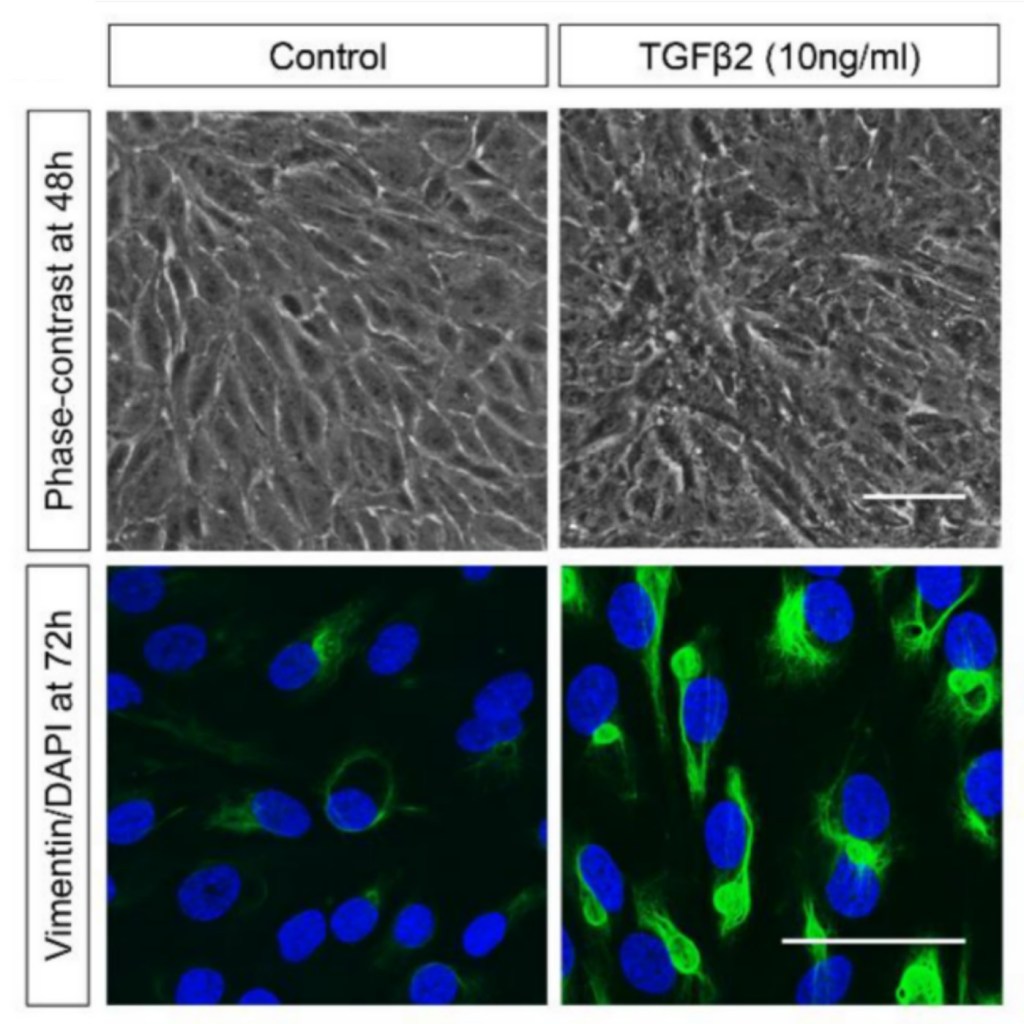
Hay et son équipe ont utilisé le terme EMT pour la première fois en 1982, dans une publication décrivant une culture de cellules épithéliales de cristallin de poulet en suspension dans des gels de collagène qui peut conduire à des expansions cytosoliques. Ces cellules sont alors capables de se déplacer individuellement dans la matrice de collagène, et elles ressemblent à des cellules mésenchymateuses. En 1982, des chercheurs suisses et allemands (équipe de Karl Illmensee, Université de Genève) ont montré que les premières cellules mésenchymateuses apparaissant lors de l’embryogenèse de souris proviennent de cellules épithéliales qui perdent l’expression des protéines des desmosomes et des cytokératines et commencent à exprimer la vimentine.
Depuis 1990, quelques équipes ont montré la grande importance des protéines de la famille du TGF (facteur de croissance transformant), TGF-α et TGF-β1, 2 ou 3 au cours de l’EMT. En effet, l’expression du TGF-α conduit à un phénotype mésenchymateux et invasif dans les cellules cancéreuses de la prostate de rat. En 1991, Potts et al. ont montré l’importance du TGF-β3 dans l’EMT des cellules endothéliales cardiaques embryonnaires et en 1994, ils ont montré que les cellules épithéliales mammaires peuvent subir une EMT après un traitement au TGF-β.
Les cellules épithéliales sont considérées comme ayant tout ou partie des caractéristiques biologiques cellulaires suivantes:
- polarité apicobasale,
- jonctions serrées,
- jonctions adhérentes,
- jonctions gaps,
- desmosomes,
- hémidesmosomes reliés à une lame basale,
- filaments intermédiaires à base de kératine,
- faisceau cortical de fibres d’actine.
Cependant, la plupart des tissus épithéliaux embryonnaires ne contiennent pas ce spectre complet de caractéristiques, et les composants moléculaires généralement associés à ces structures subcellulaires ne sont pas uniquement ou universellement présents dans les cellules épithéliales (Nakaya et Sheng, 2013). L’expression de la E-cadhérine, par exemple, peut être détectée dans des cellules non épithéliales (Filimonow et al., 2019), et de nombreuses structures épithéliales telles que l’endothélium vasculaire n’expriment pas la E-cadhérine (Giampietro et al., 2012; van Roy, 2014) mais la N-cadhérine et la VE-cadhérine. De plus, lorsque le même processus de développement est étudié (par exemple la gastrulation ou la formation des crêtes neurales), les types et la dynamique de l’expression des cadhérines peuvent dépendre de l’organisme modèle. Ainsi, au lieu d’utiliser des marqueurs moléculaires, un épithélium peut être mieux défini comme un groupe de cellules qui sont collectivement polarisées avec des surfaces apicales et basolatérales partagées et qui fonctionnent comme une barrière physicochimique entre deux compartiments (Yang et al., 2020).
Les cellules mésenchymateuses, en revanche, sont définies comme des cellules non épithéliales. Elles :
- ne maintiennent pas une polarité cellulaire stable,
- ont des interactions cellule-cellule et cellule-matrice dynamiques,
- ont des filaments intermédiaires à base de vimentine et des fibres de tension d’actine,
- sont plus mobiles que les cellules épithéliales.
Il existe une multitude d’états intermédiaires entre ces deux états (qui peuvent être stables ou partiellement stables) et ils sont appelés collectivement spectre EMT (Nieto et al., 2016).

Une version commentée de cette figure est disponible en vidéo.
Source : https://www.mdpi.com/1422-0067/22/9/4701/htm
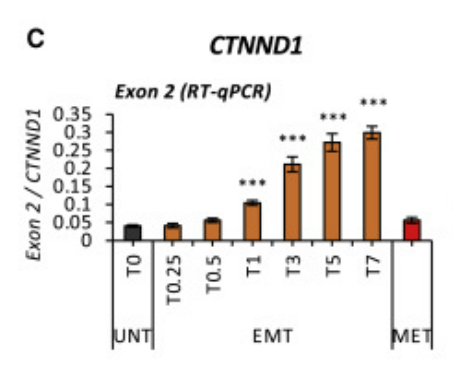
Outre des changements d’expression de gènes, l’EMT peut s’accompagner d’un changement d’isoforme des protéines par épissage alternatif comme c’est le cas pour CTNND1 (aussi appelé p120Cas), une caténine impliquée dans l’adhérence cellule-cellule et pour le récepteur FGFR2. Dans le cas de CTNND1, l’épissage alternatif qui maintient l’exon 2 dans l’ARNm mature au cours de l’EMT génère une isoforme qui déstabilise les adhérences intercellulaires. Dans le cas de FGFR2, l’inclusion de l’exon IIIc change la spécificité du récepteur pour ses ligands ce qui influence les capacités de migration (Segelle et al., 2022).
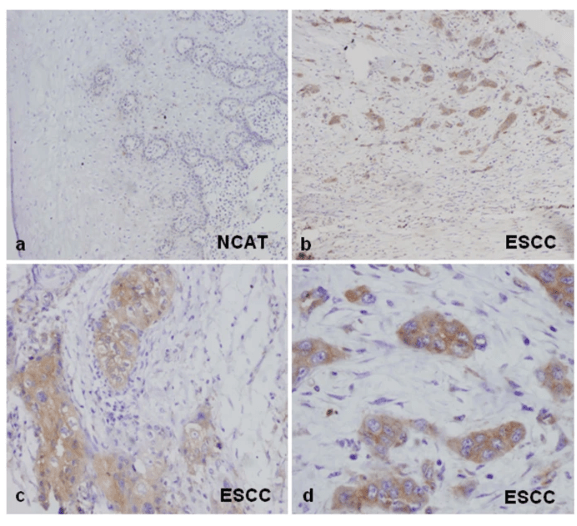
Au cours de l’EMT, la lame basale sous la couche épithéliale se décompose sous l’action des protéines MMP (métalloprotéases matricielles caractérisées par un site catalytique avec ion Zn2+ lié à trois histidines) (Horejs, 2016). L’expression des MMP augmente de manière importante au cours de l’EMT. Selon les MMP, elles agissent soit en étant accrochées à la membrane plasmique (en étant transmembranaires ou ancrées par le GPI (glycosylphosphatidylinositol)), soit secrétées dans la lame basale (Itoh, 2015). L’expression des MMP dans les cellules tumorales est un facteur de mauvais pronostic car cela veut dire qu’une EMT a lieu ou a eu lieu et que des métastases peuvent être produites.
De très nombreuses voies de signalisation convergent pour activer l’EMT et concentrent leur contrôle sur un petit nombre de facteurs de transcription qui coordonnent l’EMT à l’échelle cellulaire et moléculaire.
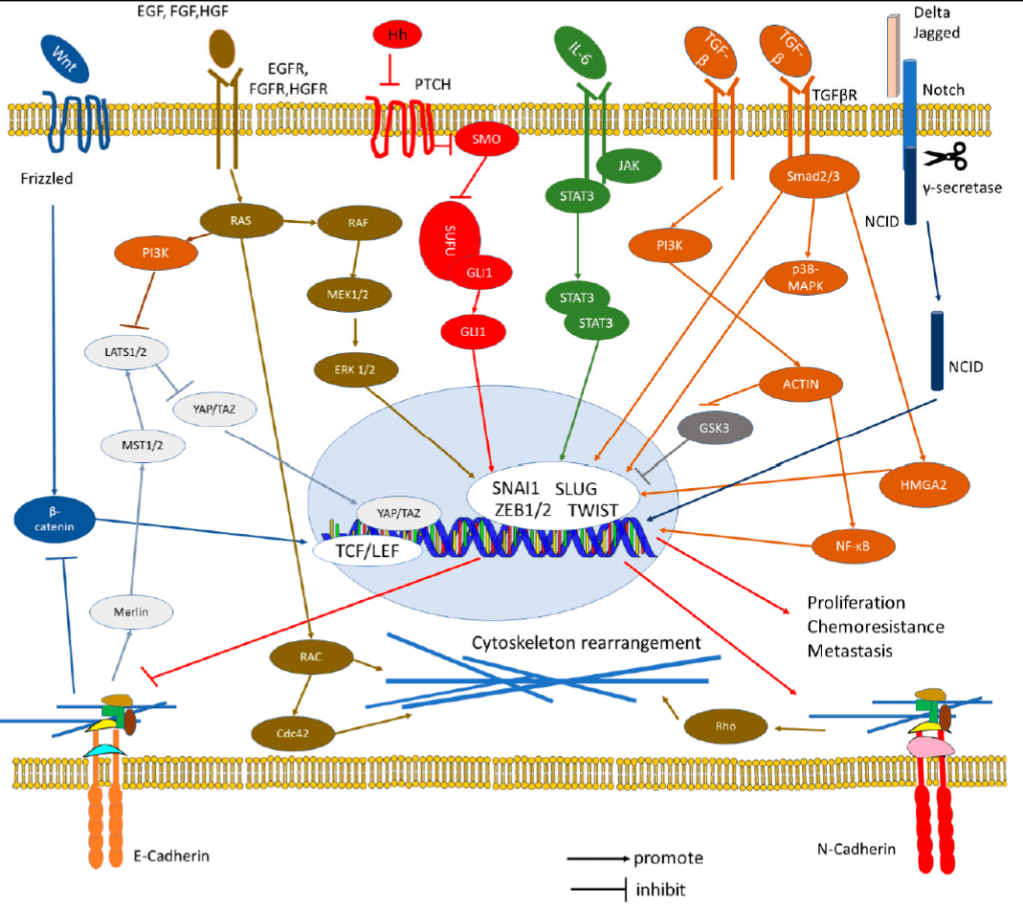
Bien que diverses voies de signalisation puissent réguler l’EMT en fonction du contexte cellulaire, l’activation des répresseurs transcriptionnels des familles Snail, Twist et Zeb est une étape précoce largement conservée.
Une version commentée de cette figure est disponible en vidéo.
Source : https://www.sciencedirect.com/science/article/pii/S0012160616303657
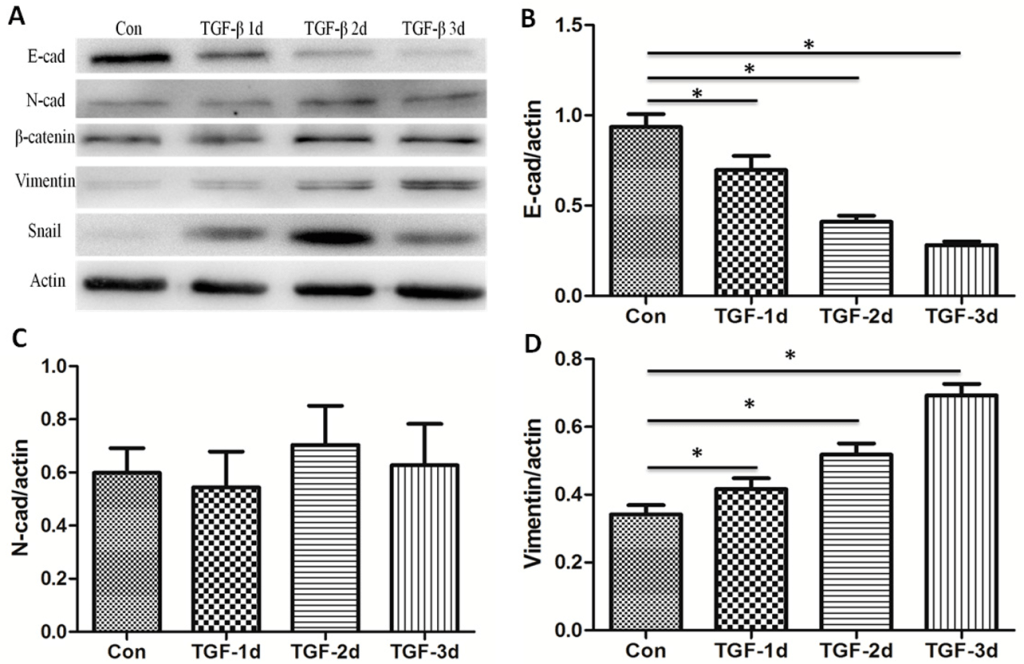
Au cours de l’EMT, les protéines à doigt de zinc Snail et Slug, transcrits respectivement à partir des gènes Snai1 et Snai2, répriment directement la transcription des gènes impliqués dans le phénotype épithélial, notamment les composants des protéines des jonctions serrées et d’adhérence telles que l’E-cadhérine.
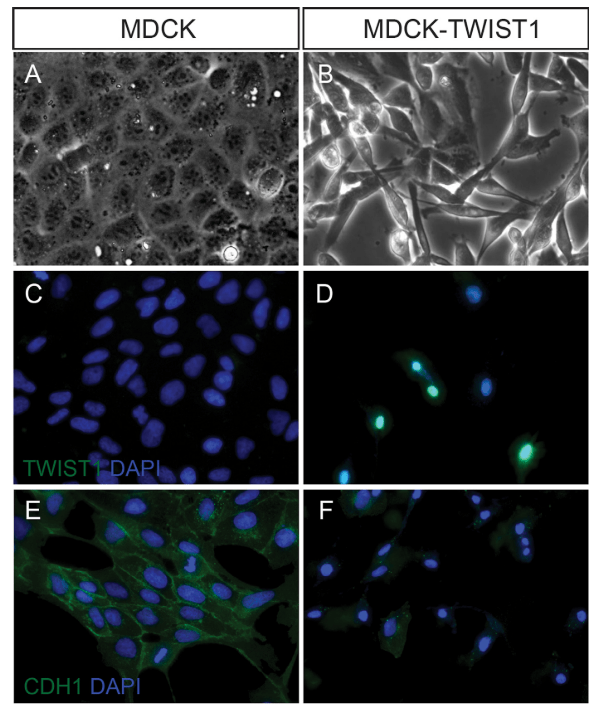
Twist1, quant à lui, est un facteur de transcription de type bHLH (hélice-boucle-hélice basique) et il se fixe aussi directement sur le promoteur du gène codant la E-cadhérine et réprime son expression. Cette inhibition a été observée au cours du développement embryonnaire mais aussi dans des cancers du sein (Vesuna et al., 2008). Twist1 active aussi directement l’expression du gène codant PCOLCE (pour Procollagen C-Endopeptidase Enhancer), une protéine secrétée impliquée dans la maturation du procollagène en collagène (Bildsoe et al., 2016). Ainsi, les cellules exprimant Twist1 remodèlent la MEC autour d’elles.
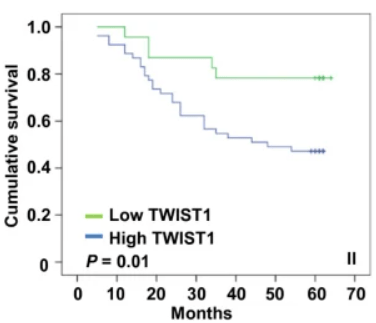
Le facteur de transcription TWIST1 est exprimé dans de nombreux types de cancers (Yang et al, 2004), et son expression est associée à de mauvais pronostics pour les patients (Banerjee et al, 2011; Riaz et al, 2012).
BILAN DE L’EMT
La compréhension du contrôle des EMT est crucial pour comprendre la formation de métastases à partir de tumeurs in situ. On retrouve de nombreux facteurs découverts en embryologie qui jouent un rôle lors de la progression des tumeurs.
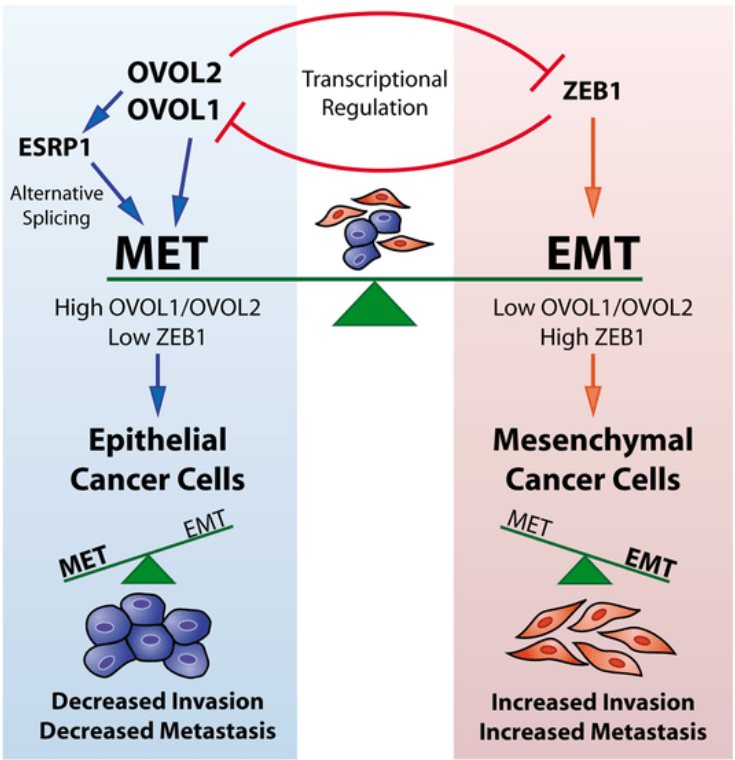
Dans les cellules cancéreuses humaines, les états mésenchymateux et épithéliaux sont induits et maintenus par des programmes de régulation transcriptionnels et post-transcriptionnels. Ces programmes sont contrôlés entre autres par la régulation par rétroaction entre les facteurs de transcription OVOL et ZEB1, inducteurs critiques de MET et EMT respectivement. De plus, ces facteurs de transcription contrôlent l’expression d’ESRP1, un régulateur de l’épissage crucial pour le MET et réprimé dans l’EMT. Par conséquent, un niveau d’OVOL élevé et un niveau de ZEB1 faible stabilisent l’état épithélial en diminuant l’invasion des cellules cancéreuses et les métastases, et inversement pour l’état mésenchymateux. Source : https://journals.plos.org/plosone/article?id=10.1371/journal.pone.0076773
Les migrations cellulaires
VIDEO 2 :
La migration cellulaire est essentielle lors de l’embryogenèse notamment lors de la gastrulation qui repositionne les feuillets embryonnaires les uns par rapport aux autres et pour distribuer les cellules dans l’embryon permettant le développement et le fonctionnement correct des organes (par exemple, la migration des cellules germinales vers les gonades). La complexité du microenvironnement embryonnaire signifie que les cellules en migration doivent changer rapidement leur forme, développer des protubérances qui pénètrent dans des espaces de différentes tailles, parcourir des environnements où les signaux envoyés par les autres cellules et la matrice extracellulaire (MEC) sont différents. Cela nécessite de la part des cellules en migration une grande souplesse d’adaptation et une grande réactivité.
Comme dit plus haut lors de la partie sur les EMT, il ne faut pas avoir une image trop caricaturale : cellules épithéliales = immobile, cellule mésenchymateuse = mobile. Des cellules épithéliales peuvent migrer collectivement à la suite d’un processus nommé récemment « unjamming transition » que l’on pourrait traduire par transition de déblocage ou de libération (de Marzio et al., 2021).
Dans la plupart des cellules migrantes, les microfilaments d’actine forment de longues structures parcourant une bonne partie du cytoplasme et accrochés à la membrane plasmique et, indirectement, à la MEC par les points focaux d’adhérence. Ces fibres d’actine sont appelés fibres de tension ou fibres de stress. Les microfilaments sont accrochés entre eux par de l’ α-actinine pour former une fibre. Les fibres de tension peuvent être associées à la myosine-II non musculaire ce qui permet le déplacement de la cellule (Burridge et Wittchen, 2013).
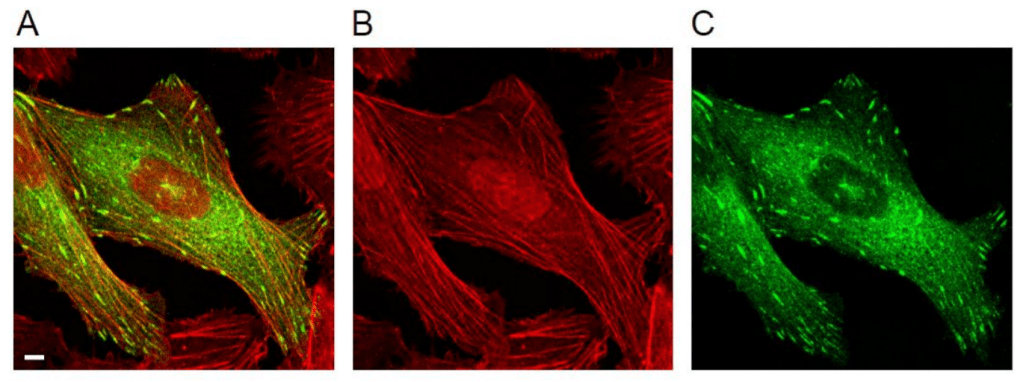
Une version commentée de cette figure est disponible en vidéo.
Source : https://www.mdpi.com/2079-7737/10/11/1189
La régulation dynamique de la signalisation d’adhésion est importante pour que la motilité cellulaire se produise et il faut que les points focaux d’adhérence s’assemblent et se désassemblent continuellement pour que la cellule avance. La tyrosine kinase FAK agit comme un nœud de signalisation au niveau des points focaux d’adhérence pour favoriser la réorganisation continuelle du cytosquelette que nécessite la migration. FAK régule la motilité cellulaire initiée par les intégrines qui interagissent avec la matrice extracellulaire (MEC) et les récepteurs de facteurs de croissance. La liaison d’un élément de la MEC comme la fibronectine à une intégrine provoque l’autophosphorylation de FAK au niveau du résidu Tyr397. Cela révèle un motif de liaison pour les protéines contenant le domaine SH2 telles que Src, qui phosphoryle davantage FAK sur Tyr861, Tyr925, Tyr576 et Tyr577.
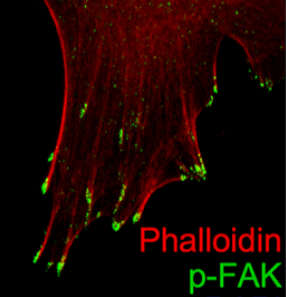
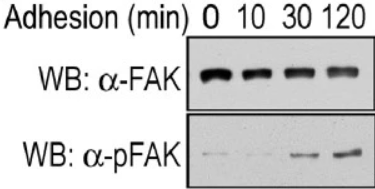
Des mutants de FAK non phosphorylables sur Tyr397 ou Tyr925 stabilisent les adhérences et ralentissent leur désassemblage, ce qui diminue la vitesse de migration (Hamadi et al., 2005; Deramaudt et al., 2011).
Lors de la migration, des points focaux d’adhérence doivent se désassembler pour que de nouveaux puissent se mettre en place. Lors du désassemblage, les intégrines subissent une endocytose dans des puits bordés de clathrine.
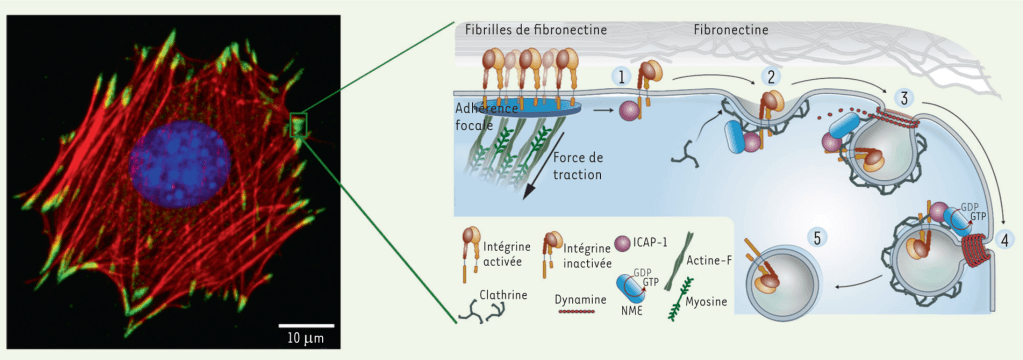
La polarisation des cellules en un front protrusif et un dos rétractile est la caractéristique déterminante de la migration de type mésenchymateux. Le front protrusif comprend des prolongements épais (lamellipodes) ou fins (filopodes) formés par la polymérisation de l’actine. Fait intéressant, un certain nombre d’études ont rapporté que les ARNm des protéines ribosomiques (RP) peuvent fortement se localiser sur les fronts protrusifs de certaines cellules migratrices (Mardakheh et al., 2015; Wang et al., 2017). C’est logique car des protéines essentielles sur le front de migration sont traduites sur place au plus près de leur localisation finale. C’est le cas notamment de la β-actine.
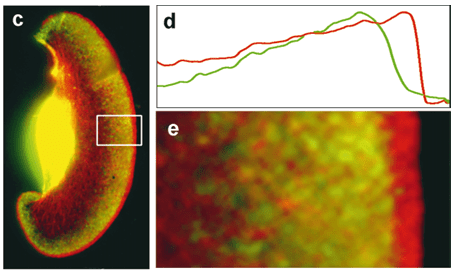
La traduction de la β-actine se fait au plus proche des structures qui en ont besoin. Dynamique en temps réel de l’ARNm de la β-actine dans une cellule en migration. La technique de marquage MS2-GFP (MS2 est une protéine qui a une forte affinité pour les ARN et que l’on peut cibler sur un ARNm particulier) a été utilisée pour visualiser l’ARNm endogène de la β-actine. La carte des couleurs montre l’intensité de fluorescence représentant la concentration d’ARNm de β-actine. Plus c’est vers les couleurs chaudes (jaune-rouge), plus c’est concentré (Hye Yoon Park and Robert H. Singer, Albert Einstein College of Medicine).
La localisation des ARNm de protéines ribosomiques (RP) dépend de la protéine LARP6. Sa présence entraîne une activation de la synthèse de RP, conduisant à une stimulation de la biogenèse des ribosomes et à une capacité de synthèse des protéines accrue requise pour soutenir la migration. Dans les carcinomes mammaires humains, une expression plus élevée de LARP6 est associée aux sous-types invasifs de type mésenchymateux.
La partie la plus à l’arrière de la cellule en migration peut s’allonger et quelque fois se détacher.
Quand il n’y a pas détachement, la membrane plasmique postérieure peut être « recyclée » vers l’avant, par endocytose puis transport vésiculaire.
Diversité des modes de migration
Les cellules présentent différentes manières de migrer : de manière isolée ou collective.
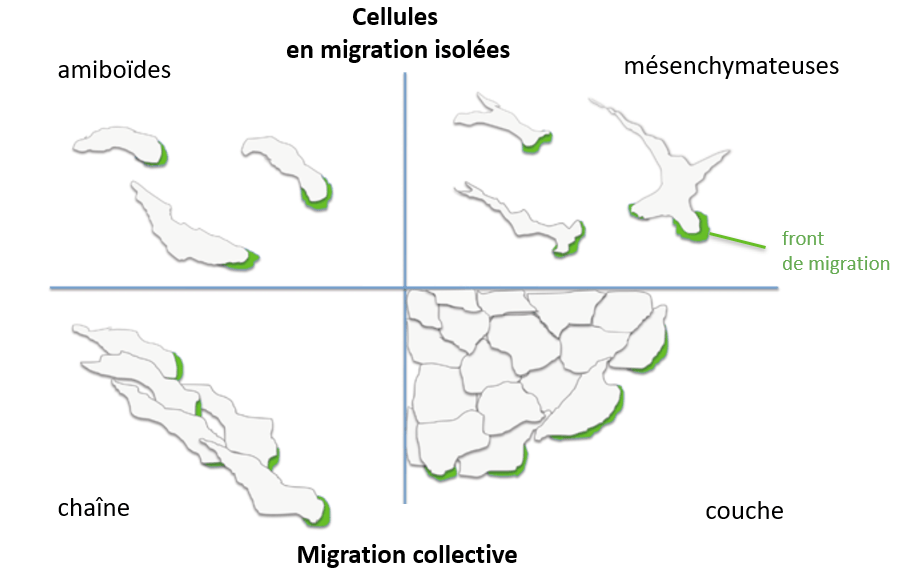
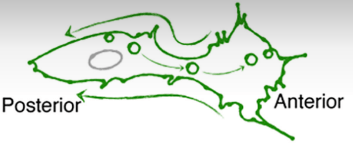
Une cellule isolée en migration est une cellule polarisée avec une protrusion membranaire à l’avant, suivie de forces de poussées. Puis à l’arrière du noyau, des forces contractiles et la rétraction membranaire.
La migration amiboïde présente des protrusions membranaires très larges, sans présence de filopodes, ni de fibres de tension d’actine, ni de points focaux d’adhérence tandis que la migration mésenchymateuse présente un ou plusieurs lamellipodes ponctués de filopodes, des fibres de tension d’actine reliés à des points focaux d’adhérence. A la place des fibres de tension, les cellules en migration amiboïde ont un réseau d’actine sous la membrane plasmique à l’arrière de la cellule. La migration amiboïde est rapide (de l’ordre de 10 µm par seconde) tandis que la migration mésenchymateuse est plus lente (moins de 1 µm par seconde).
Les cellules peuvent migrer individuellement mais aussi en groupe. Dans la vidéo ci-dessous on peut observer la migration de cellules MDCK, des cellules rénales de chien. Les cellules migrent ensemble (et sont parcourues par des vagues d’activité de la kinase ERK mises en évidence par un biosenseur EKAREV-NLS) (Hino et al., 2020) :
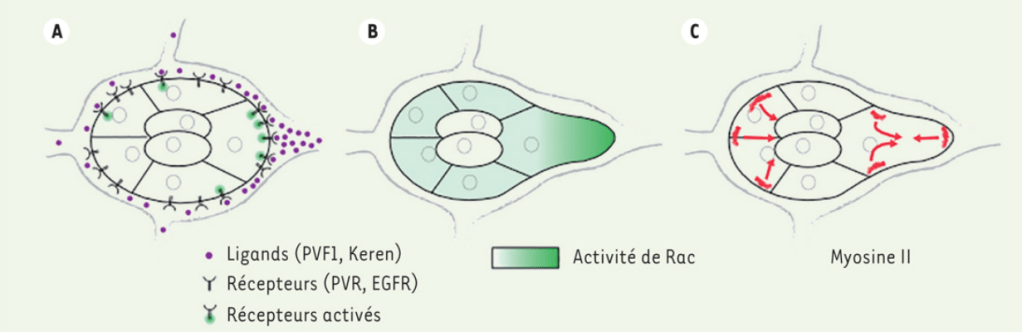
Les repères directionnels pour une migration collective orientée sont perçus par les cellules à l’avant appelées cellules leader puis transmis vers les cellules plus en arrière via des forces mécaniques transmises via des jonctions cellule-cellule (Omelchenko et al., 2003, Yamaguchi et al., 2015; Tambe et al., 2011). Les cellules en arrière peuvent aussi transmettre des informations vers les cellules leader via des tensions mécaniques transmises par l’adhérence cellulaire (mécanotransduction) (Boutillon et al., 2022).
La formation des lamellipodes et des filopodes
C’est la polymérisation de l’actine qui est le principal moteur de la formation des lamellipodes. Ces expansions cellulaires peuvent faire jusqu’à 200 nm d’épaisseur répartis sur jusqu’à plusieurs dizaines de µm le long de l’avant de la cellule.
Les microfilaments d’actine constituant le lamellipode sont orientés avec leurs extrémités barbelées (+) à croissance rapide dirigées vers l’extérieur.
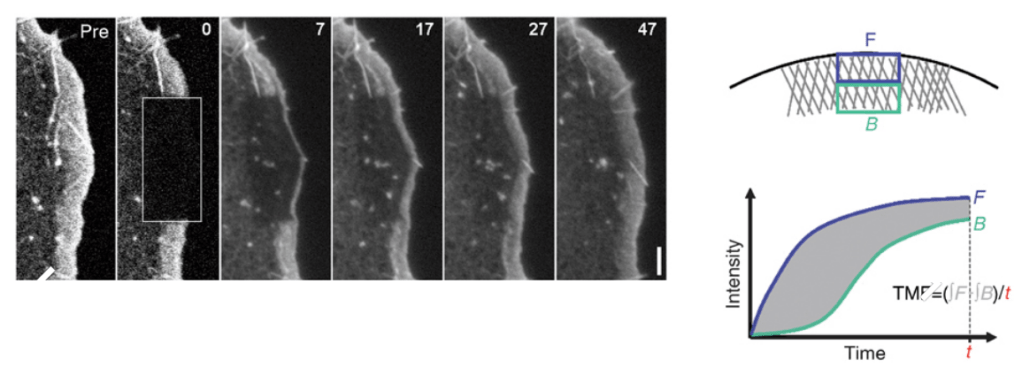
Le complexe Arp2/3 est constitué de 7 sous-unités et est associé aux microfilaments d’actine au niveau du lamellipode.
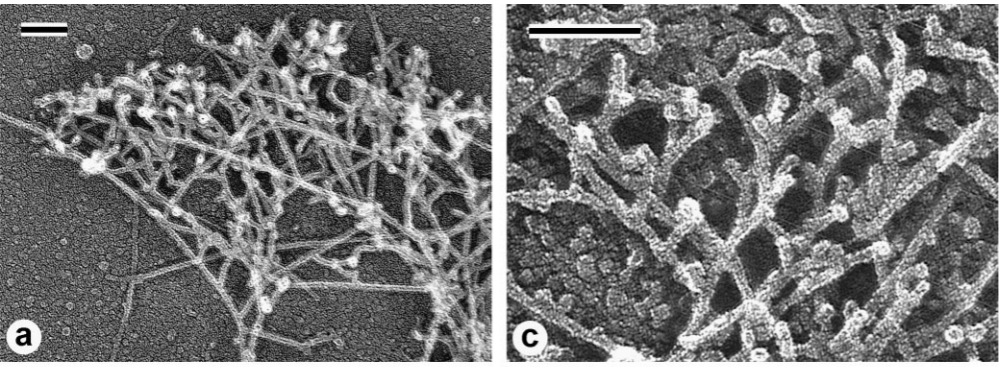
dans les lamellipodes d’un kératocyte de xénope en migration. Immunofluorescence de Arp2/3 (a) et de l’actine (b) puis addition des deux colorations (c). Source : https://rupress.org/jcb/article-pdf/145/5/1009/1285979/9903075.pdf
La suppression des composants du complexe Arp2/3 par ARN interférence (ARNi) ou la séquestration du complexe dans le cytosol inhibe la formation de lamellipodes (Kunda et al, 2003; Steffen et al, 2006). Arp2/3 contribue à générer des nouveaux microfilaments en les branchant sur des filaments préexistants ce qui permet d’expliquer l’aspect en maille du réseau d’actine dans les lamellipodes. De nouveaux microfilaments branchés se forment à l’avant tandis que les plus anciens se désassemblent à l’arrière, comme dans un tapis roulant. C’est la cofiline qui est responsable du désassemblage à l’arrière qui permet de rendre à nouveau disponible des monomères d’actine G pour la polymérisation à l’avant (Carlier et al, 1999; Ghosh et al, 2004; Hotulainen et al, 2005).
L’activation du complexe Arp2/3 dans les lamellipodes est médiée par le complexe WAVE (Stradal et al, 2004) et par les protéines de la famille WASP.
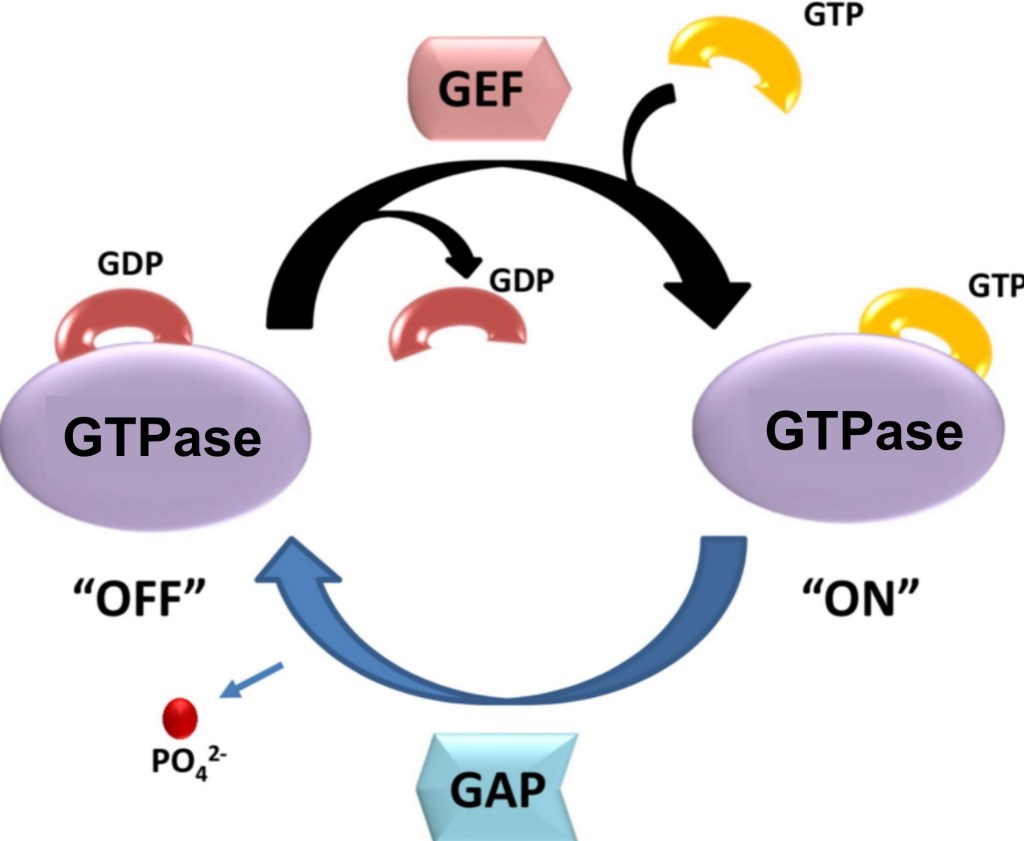
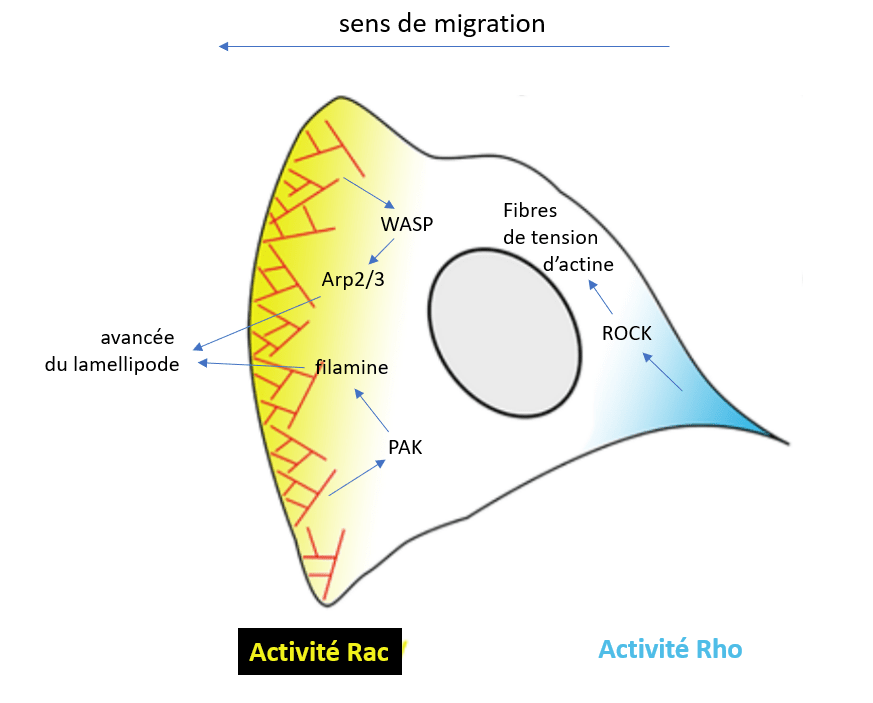
La formation des lamellipodes est aussi sous le contrôle de la petite GTPase Rac qui active les protéines de la famille WASP qui activent ensuite Arp2/3. La formation des filopodes est en revanche sous le contrôle de la petite GTPase Cdc42 tandis que les fibres de tension de l’actine sont mises en place sous l’action de la petite GTPase Rho qui active ROCK (laquelle augmente l’activité de la myosine II) et qui active les formines. Il y a donc une répartition des rôles des 3 GTPases, Rac, Cdc42 et Rho. Il peut y avoir des antagonismes : Rac active PAK qui inhibe l’activité de la myosine II associée aux fibres de tension d’actine. Ce mécanisme assure que les fibres de tension se forment à l’arrière, à une certaine distance du lamellipode.
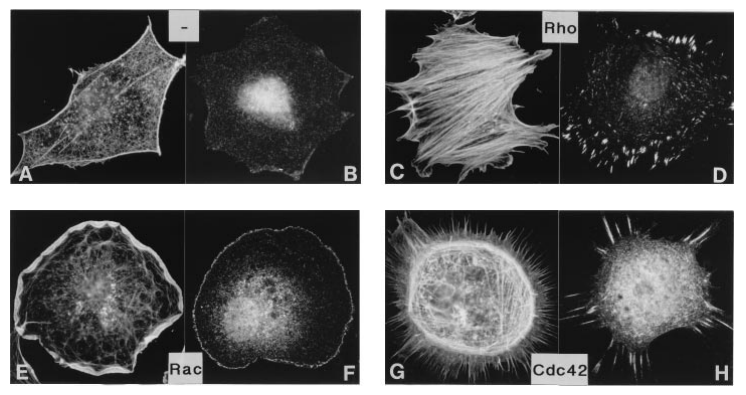
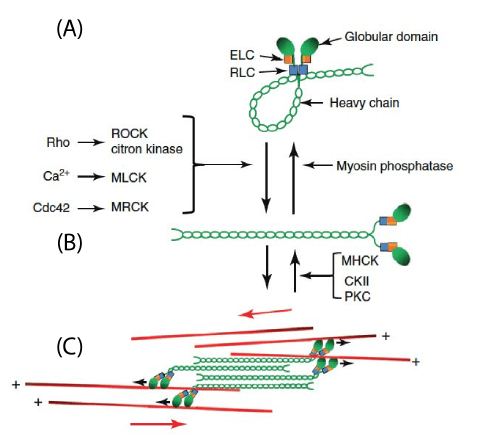
(B) L’activation de la myosine II dépend de la phosphorylation des chaînes légères régulatrices, catalysée par différentes kinases : MLCK (myosin light chain kinase) activée par Ca²⁺, ROCK et citron kinase activées par Rho, et MRCK activée par Cdc42. La déphosphorylation est assurée par la myosine phosphatase. La myosine activée adopte une conformation étendue, permettant son assemblage en filaments.
(C) Les myosines assemblées en filaments bipolaires peuvent interagir avec les filaments d’actine (en rouge), générant une force contractile grâce à leur activité motrice dirigée vers l’extrémité (+) de l’actine. Source : https://www.sciencedirect.com/science/article/abs/pii/S0962892411002108
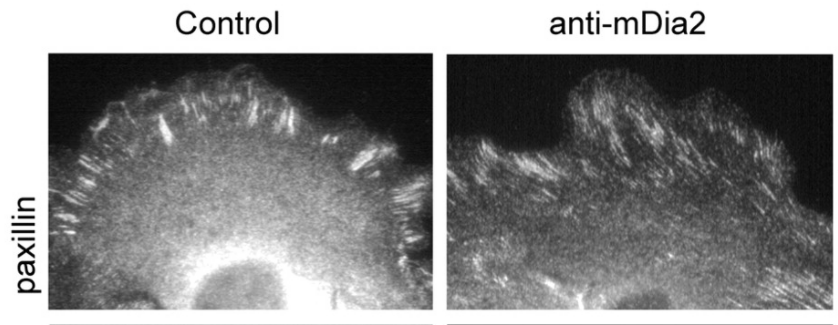
Comme effecteurs des GTPases de la famille Rho citons aussi les protéines mDia, qui font partie des formines. Les formines mDia sont des protéines conservées au cours de l’évolution qui initient, allongent et, dans certains cas, regroupent les filaments de F-actine qui forment les filopodes, les lamellipodes et les ruffles (des ondulations de la membrane plasmique caractéristiques de l’avant des cellules en migration). mDia2 contrôle aussi la stabilité des points focaux d’adhérence durant la migration collective de cellules épithéliales (Gupton et al., 2007).
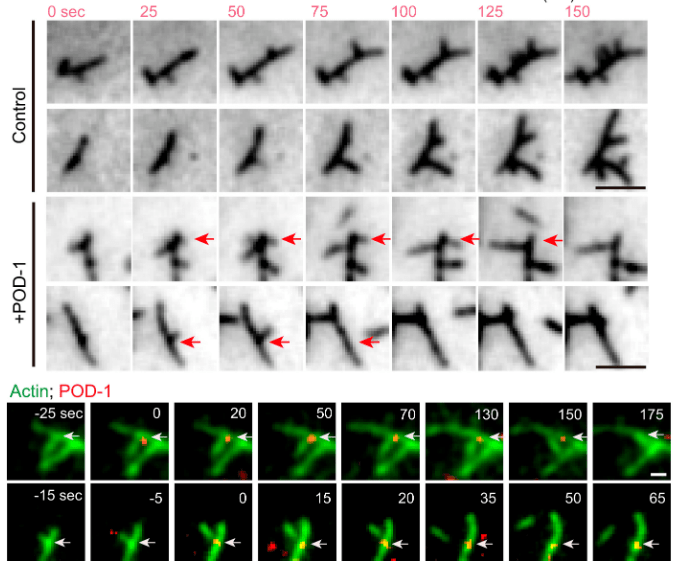
Tout aussi importante que la polymérisation des microfilaments d’actine, la dépolymérisation de ces microfilaments est essentielle pour le dynamisme nécessaire à la migration et pour que des monomères actine G puissent être remobilisés ailleurs. La protéine POD-1 chez C. elegans est un exemple de protéine qui débranche les microfilaments branchés formés par Arp2/3 (Xie et al., 2021). En absence de POD-1, les cellules embryonnaires de C. elegans ont de graves défauts de polarisation et de migration.
Parmi les paramètres importants pour la migration, citons la directionalité du mouvement, ou la capacité pour des cellules à maintenir un cap. Prenons un exemple pour montrer que ce paramètre est crucial. β-Pix (Arhgef7) est une GEF des GTPases Rac1 et Cdc42 qui se localise sur les points focaux d’adhérence. Les embryons de souris mutantes nulles β-Pix arrêtent leur développement avant E8.0 et ne parviennent pas à mettre en place un axe corporel antéro-postérieur car β-Pix est requis pour la migration épithéliale collective des cellules de l’AVE (endoderme viscéral antérieur) et aussi du mésoderme. Etudions la migration de cellules d’explants du mésoderme plus en détail :
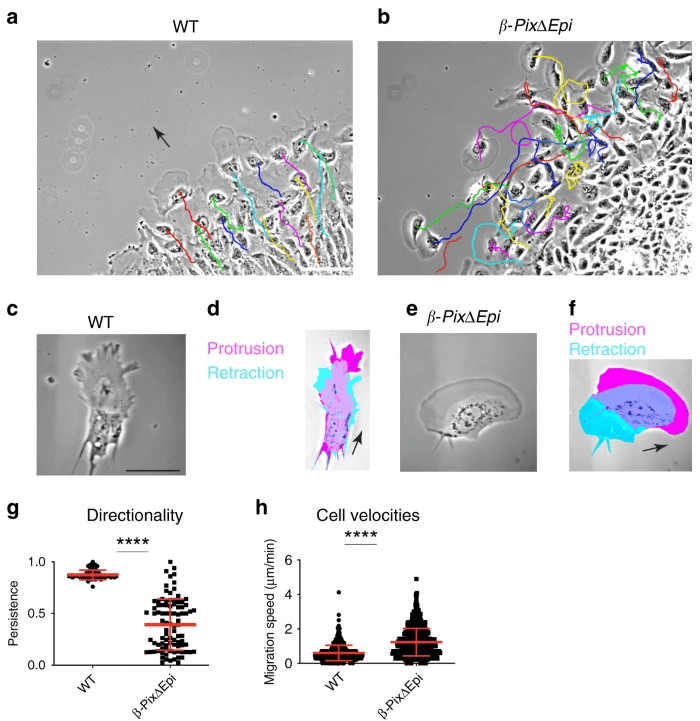
On constate que la vitesse de migration est plus élevée dans des cellules sans β-Pix mais la persistance de la migration dans une direction donnée n’est pas assurée générant des défauts majeurs au cours de la gastrulation (Omelchenko et al., 2020). Des expériences complémentaires ont montré que β-Pix interagit avec Scribble et ensemble, ces protéines contrôlent la polarité cellulaire et l’activité de Cdc42 (Zaritsky et al., 2017).
Au cours de la migration, la membrane plasmique est déformée par le microenvironnement que traverse la cellule. De nombreuses cellules migratrices expriment diverses protéines sensibles à la courbure de la membrane plasmique, qui interagissent directement avec la membrane plasmique et le réseau d’actine sous-jacent (Carman et al., 2018). En particulier, la famille des protéines à domaine BAR facilite la détection de la courbure membranaire. Ces protéines forment des dimères en forme de croissant qui peuvent détecter une courbure de la membrane plasmique, et elles interagissent avec les régulateurs du réseau d’actine tels que le complexe Arp2/3, les formines ou les Rho GTPases. La protéine à domaine BAR Snx33 joue un rôle important pour que les cellules en migration puissent contourner les obstacles (Sitarska et al. 2023).
POUR D’AUTRES INFOS SUR L’EMT ET LA MIGRATION, VOIR LE CHAPITRE SUR LES CELLULES DE CRETES NEURALES
LA CARTE MENTALE :

EN DIRECT DES LABOS : Rétroaction mécanique lors de la formation de protrusions cellulaires.
QUELQUES EQUIPES FRANCOPHONES QUI TRAVAILLENT SUR LE SUJET :
Dynamique du cytosquelette et motilité – I2BC, Université Paris-Saclay
- Adhérences cellule-cellule
- Arabidopsis thaliana
- Axe antéro-postérieur chez la drosophile
- Biomécanique du développement
- Caenorhabditis elegans
- Concepts principaux
- Contrôle de la traduction
- Contrôle de la transcription
- Contrôle génétique et épigénétique
- Croissance du tube pollinique et double fécondation chez les Angiospermes
- Croissance et guidage axonal
- Des modèles animaux moins classiques
- Développement de l’oeil des Vertébrés
- Développement et évolution
- Et l’Humain ?
- Exercices sur l’ovogenèse, la spermatogenèse et la fécondation
- Exercices sur le contrôle de l’expression des gènes
- Exercices sur le développement des bourgeons de membre
- Exercices sur le développement des muscles striés squelettiques
- Exercices sur le développement des végétaux et les hormones végétales
- Exercices sur les cycles et les divisions cellulaires
- Exercices sur les étapes du développement, les inductions embryonnaires et la mise en place des axes de polarité
- Exercices sur les matrices extracellulaires, le cytosquelette et les adhérences cellule-cellule
- Exercices sur les voies de signalisation
- Glossaire
- Glossaire des termes liés à la génétique
- Glossaire des termes liés au cytosquelette, la matrice extracellulaire, l’adhérence et la migration cellulaire
- Hématopoïèse et développement des cellules du système immunitaire
- Histoire de la biologie cellulaire et de la biologie du développement
- L’acide rétinoïque
- L’apoptose
- L’autophagie
- L’organogenèse
- L’ovogénèse prépare le développement embryonnaire
- La drosophile
- La fécondation
- La formation des somites
- La gastrulation
- La gastrulation (version allégée)
- La métamorphose chez les Hexapodes et les Amphibiens
- La neurogénèse chez les mammifères adultes
- La neurulation
- La poule
- La signalisation calcique
- La souris
- La superfamille TGFβ et ses voies de signalisation
- La voie de signalisation de l’auxine et ses rôles
- La voie de signalisation Hedgehog
- La voie de signalisation Hippo et ses composants YAP/TAZ
- La voie de signalisation Notch
- Le clivage
- Le cytosquelette
- Le destin des cellules et les réseaux de régulation génique
- Le développement des bourgeons de membre
- Le développement des muscles striés squelettiques
- Le développement des organes génitaux et des cellules germinales
- Le développement du cortex
- Le méristème apical caulinaire en phase végétative et lors de la formation d’une fleur
- Le poisson zèbre
- Le xénope
- Les cellules des crêtes neurales
- Les cellules et les gènes en action dans le développement
- Les cellules souches
- Les cellules tumorales
- Les cycles et les divisions cellulaires
- Les étapes du développement
- Les étapes du développement embryonnaire d’Arabidopsis thaliana et leur contrôle
- Les inductions embryonnaires et les gradients de morphogène
- Les matrices extracellulaires animales
- Les organismes modèles
- Les outils pour étudier l’expression et la fonction des gènes
- Les parois des cellules végétales
- Les techniques et les outils pour la biologie cellulaire
- Les vésicules extracellulaires
- Les voies de signalisation
- Les voies de signalisation FGF
- Mise en place des axes chez les Vertébrés
- Structures et processus cellulaires
- Voies de signalisation WNT
