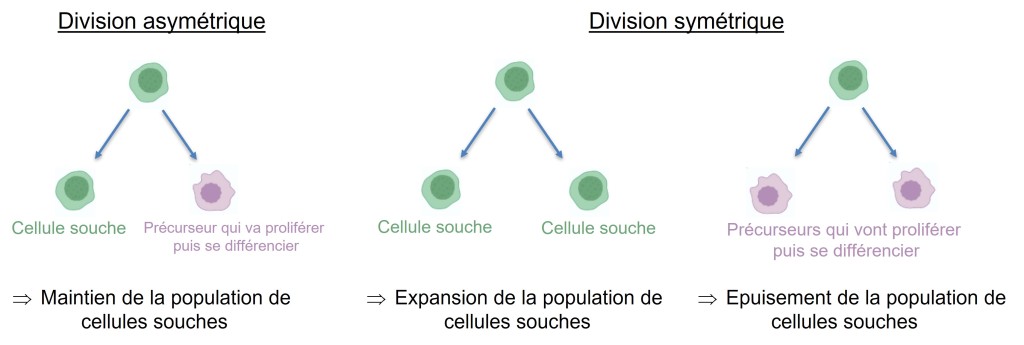
Les divisions asymétriques
A l’issue de la mitose, les 2 cellules-fille ont certes reçu le même patrimoine génétique mais le contenu cytoplasmique reparti entre elles n’est pas forcément le même.
Les cellules filles de telles divisions peuvent différer non seulement par leur héritage des déterminants cytoplasmiques, mais aussi par leur taille relative. De telles divisions asymétriques sont répandues au cours du développement. Elles peuvent notamment concerner les cellules souches : les divisions asymétriques assurent leur maintien.
Pour que les divisions asymétriques se fassent selon le bon axe ou la bonne orientation (ce qui est particulièrement crucial pour les cellules végétales qui ne peuvent pas migrer à cause de la paroi), la position et l’orientation des fuseaux mitotiques est très étroitement contrôlée. La cellule doit ainsi être polarisée avant que ne se mette en place le fuseau mitotique.
Divisions asymétriques lors de l’embryogenèse précoce de C. elegans
L’embryogenèse précoce chez le nématode C. elegans présente plusieurs divisions asymétriques qui produisent des cellules filles de différentes tailles et de différentes destinées. La première division asymétrique est le clivage inégal du zygote en une grande cellule antérieure AB et la plus petite cellule postérieure P1, correspondant respectivement à environ 60 % et 40 % de la taille totale de l’embryon.
La symétrie du zygote est brisée par le centrosome apporté par le spermatozoïde (Goldstein et Hird, 1996; Sadler et Shakes, 2000). Si ce centrosome est détruit par un rayon laser UV, la première division n’est pas asymétrique comme normalement.
En parallèle de la réorganisation du réseau de microtubules autour du centrosome paternel, le réseau cortical d’actine-myosine contractile se déplace vers le futur embryon antérieur (Munro et al., 2004), accompagné de l’établissement de domaines corticaux mutuellement exclusifs des protéines PAR, avec aPKC-3/PAR-3/PAR-6 du côté antérieur et PAR-1/PAR-2/LGL-1 du côté postérieur (Rose et Gönczy, 2014). L’inhibition réciproque des protéines PAR antérieures et postérieurs est un élément essentiel de la polarisation. PAR-1 est capable de phosphoryler PAR-3 ce qui mène à sa dégradation et la phosphorylation de PAR-2 par aPKC empêche sa bonne localisation.
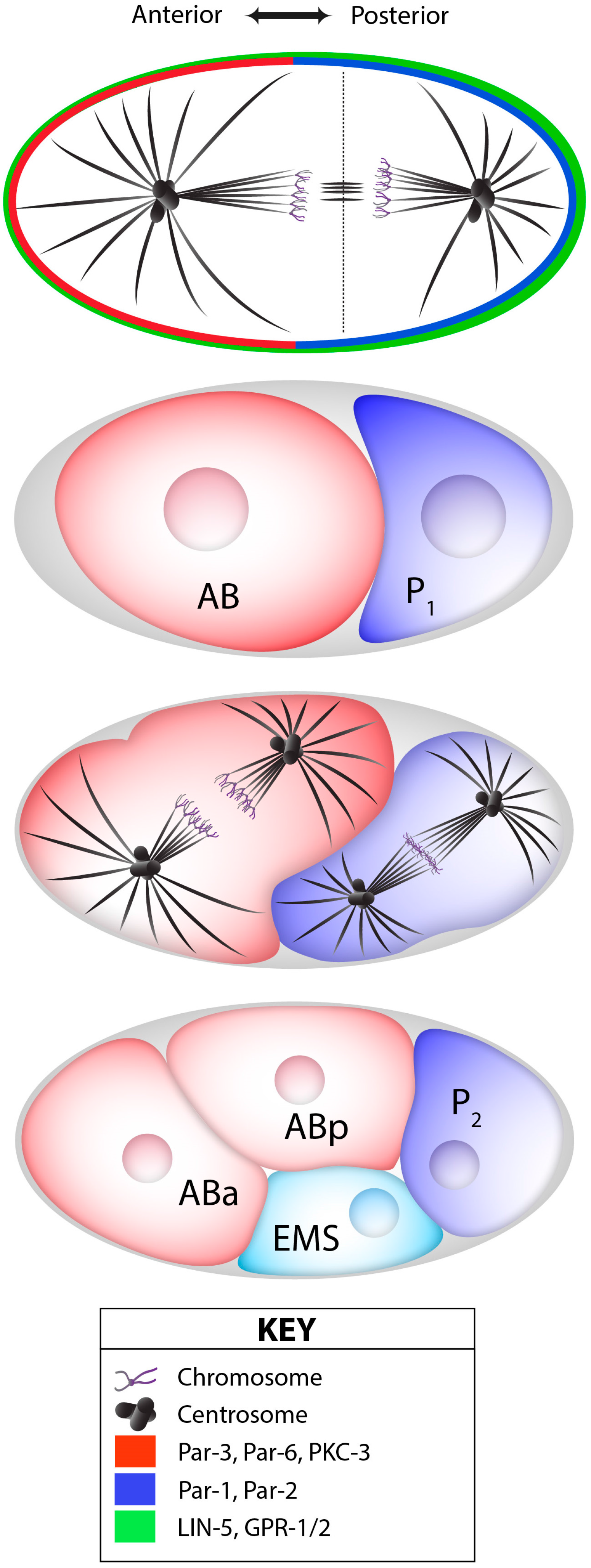
Le réseau de polarité PAR assure ensuite la distribution asymétrique des protéines et des ARNm par l’action de médiateurs de polarité, dont les protéines de liaison à l’ARN MEX-5/6, qui sont présentes selon un gradient antéro-postérieur (AP) juste avant le premier clivage (Schubert et al., 2000).
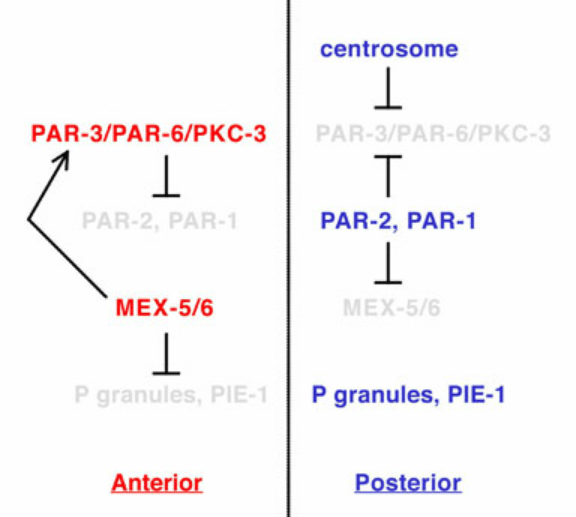
Les marqueurs de polarité antéro-postérieure dirigent également le positionnement asymétrique du fuseau mitotique, qui est situé légèrement décentré vers le côté postérieur à la fin de l’anaphase, provoquant ainsi un premier clivage inégal (Grill et al., 2001). Ce positionnement asymétrique du fuseau repose sur un complexe conservé au cours de l’évolution qui ancre la dynéine motrice au cortex cellulaire (Kotak et Gönczy, 2013). Chez C. elegans, ce complexe ternaire comprend les protéines associées à la membrane GOA-1 et GPA-16, les protéines GPR-1/2, ainsi que la protéine LIN-5, qui interagit avec la dynéine (Srinivasan et al., 2003). La dynéine ainsi ancrée dans le cortex cellulaire exerce une force de traction sur l’extrémité + des microtubules astraux en dépolymérisation et, par conséquent, sur les pôles attachés du fuseau. En réponse aux signaux de polarité antéro-postérieure, davantage de GPR-1/2 et de LIN-5 sont présents dans le cortex postérieur, ce qui provoque une force nette plus importante tirant sur le pôle postérieur du fuseau, entraînant le clivage inégal du zygote en une grande cellule AB et une petite cellule P1 (Park et Rose, 2008).
Au cours des stades ultérieurs de l’embryogenèse de C. elegans, la plupart des cellules dérivées de AB se divisent symétriquement de manière synchrone, tandis que les descendants de P1 subissent trois divisions asymétriques supplémentaires. Globalement, cela conduit à la génération de sept des cellules fondatrices qui produiront chacune des tissus spécifiques ; par exemple, E donnera naissance à l’intestin et P4 à la lignée germinale. Le destin de chaque cellule fondatrice est spécifié par des composants maternels distribués de manière asymétrique, ainsi que par des mécanismes régulés de traduction et de dégradation des protéines (Zacharias et Murray, 2016).
La ségrégation asymétrique des déterminants est également utilisée lors des premiers clivages de l’embryon de C. elegans pour spécifier la lignée germinale et la lignée somatiques. Le zygote subit quatre divisions asymétriques, dont chacune donne naissance à un blastomère somatique plus grand (AB, EMS, C et D) et à un blastomère germinal plus petit (P1, P2, P3 et P4). Au cours de ces divisions, les granules P et les protéines nécessaires au développement de la lignée germinale sont hérités préférentiellement par l’une des 2 cellules-filles. Les granules P sont de gros complexes ribonucléoprotéiques que l’on trouve exclusivement dans la lignée germinale.
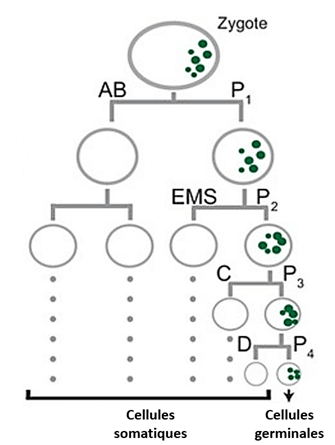
L’observation dans le zygote de granules P marqués par fluorescence dans des embryons vivants a révélé que la ségrégation des granules P implique à la fois un mouvement dirigé et une dégradation localisée. Avant le premier clivage, les granules P sont dispersés dans tout le cytoplasme puis migrent vers le pôle postérieur où se formera le blastomère germinatif P1. Les granules P qui restent dans la partie antérieure sont dégradés (ou désassemblés). Le cytosquelette d’actine et plusieurs protéines corticales localisées de manière asymétrique le long de l’axe antéro-postérieur sont nécessaires à la ségrégation des granules P. Un autre facteur qui sépare la lignée germinale dans les embryons précoces est PIE-1, une protéine codée par la mère nécessaire pour inhiber la transcription de certains ARNm et bloquer ainsi le développement somatique dans les blastomères de la lignée germinale. Comme les granules P, la protéine PIE-1 se trouve initialement dans tout le cytoplasme des embryons nouvellement fécondés et s’enrichit dans le cytoplasme postérieur avant le premier clivage. En conséquence, PIE-1 est présent principalement dans P1 au stade 2 cellules. La ségrégation asymétrique de PIE-1 est répétée dans les blastomères germinaux P1, P2 et P3.
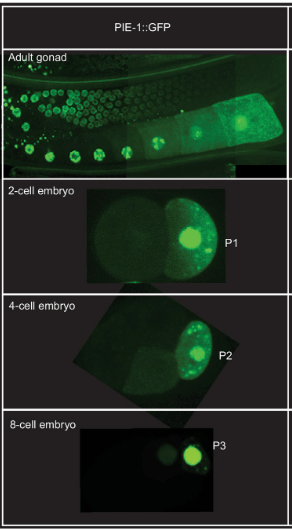
Dans P4, qui se divise également et sépare les granules P à ses deux descendants (Z2 et Z3), PIE-1 reste uniforme et est également réparti entre les deux filles.
Comme de nombreux ARN maternels, l’ARN pie-1 est présent dans tous les blastomères jusqu’au stade 4 cellules. Après le stade de 4 cellules, il est perdu dans les blastomères somatiques et conservé uniquement dans les blastomères de la lignée germinale. Il est donc peu probable que la localisation de l’ARN contribue à la localisation de PIE-1 avant le stade 4 cellules, mais il pourrait être impliqué dans les stades ultérieurs. La traduction localisée de l’ARNm pie-1 pourrait également concentrer PIE-1 dans la lignée germinale. La capacité de PIE-1 à s’associer aux centrosomes pendant la mitose peut contribuer aussi à sa distribution asymétrique. Au début de chaque mitose, PIE-1 s’accumule autour des deux centrosomes du fuseau naissant. Au fur et à mesure que le fuseau tourne en vue du clivage, PIE-1 disparaît du centrosome destiné à la fille somatique (« centrosome somatique ») et n’est retenu que sur le centrosome destiné à la fille germinale (« centrosome germinal »).
Divisions asymétriques lors de la formation du système nerveux de la drosophile
L’autre modèle abondamment étudié pour examiner la distribution asymétrique des déterminants du destin cellulaire est le neuroblaste de la drosophile, le type cellulaire à l’origine du développement du système nerveux central. Les neuroblastes se divisent de manière asymétrique le long d’un axe apical-basal pour produire un grand neuroblaste apical (auto-renouvellement) et une petite cellule mère ganglionnaire du côté basal (GMC). Bazooka (Baz, l’homologue de Par-3) interagit physiquement avec Par-6 et la protéine kinase atypique C (aPKC), formant le complexe Par, localisé sur la membrane cellulaire apicale du neuroblaste mitotique qui établit un repère apical pour la division asymétrique (Wodarz et al., 2000). aPKC phosphoryle Miranda (Mira) et Numb qui ne peuvent plus s’associer à la membrane plasmique du côté apical et qui forment alors un croissant localisé du côté basal (Atwood et al., 2009).

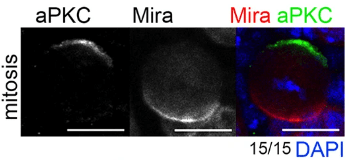

La polarisation est suivie d’un alignement du fuseau mitotique le long de l’axe de polarité apico-basal, conduisant à une ségrégation asymétrique des déterminants du destin cellulaire.
Mira est héritée par la GMC mais pas par le neuroblaste. Elle fonctionne comme une protéine adaptatrice qui lie Prospero (Pros, orthologue du mammifère Prox1), le facteur de transcription à homéodomaine qui contrôle la différenciation de la GMC qui génère deux neurones post-mitotiques ou deux cellules gliales (Shen et al., 1997). Grâce à Mira, Pros se retrouve uniquement dans la GMC et pas dans le neuroblaste.
De son côté, Numb, qui s’accumule aussi du côté basal puis uniquement dans la GMC, facilite l’endocytose du récepteur Notch, conduisant à l’inhibition de la signalisation Notch dans la GMC, ce qui rend possible la différenciation neuronale. Du La cellule issu de la mitose du côté apical n’a pas de Numb et donc la signalisation peut continuer et la différenciation neuronale du neuroblaste est impossible.
Semblable aux neuroblastes de drosophile, les progéniteurs épidermiques de souris maintiennent le contact avec la membrane basale pour établir la polarité initiale pour leur division (Poulson et Lechler, 2010; Williams et al., 2011). La polarisation de la distribution de Inscutable, LGN, NuMA et dynéine est nécessaire pour diriger l’axe de division. La perte de polarité dans les progéniteurs épidermiques de la souris entraîne des défauts de stratification de la peau et une différenciation incorrecte (Lechler et Fuchs, 2005).
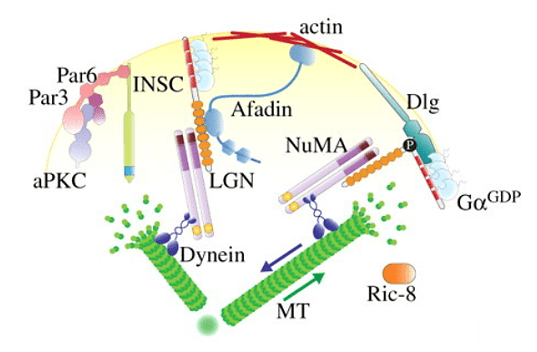
Dans les neuroblastes de drosophile, tout comme d’ailleurs dans les progéniteurs épidermiques de souris, on retrouve les orthologues des protéines PAR que l’on a rencontré lors des premières divisions chez C. elegans. Un domaine Par se forme au niveau du cortex apical pendant la mitose où il empêche l’accumulation de déterminants du destin neuronal, les restreignant au cortex basal. Les domaines corticaux résultants sont coupés en deux par le sillon de clivage conduisant à la ségrégation des déterminants dans la cellule fille basale où ils favorisent la différenciation au détriment de l’auto-renouvellement (Homem et Knoblich, 2012).
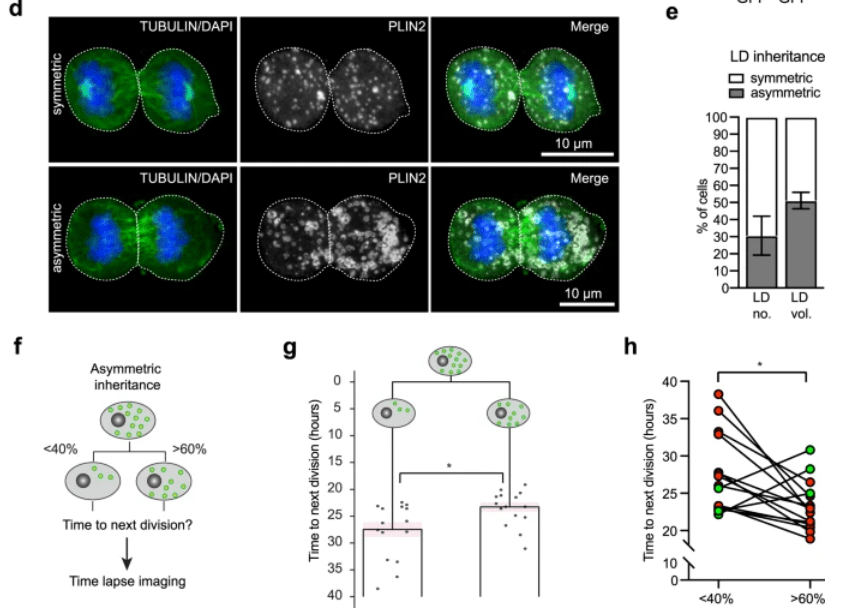
Lors des divisions asymétriques, des organelles et des vésicules peuvent se répartir de manière inégale entre les cellules filles. Par exemple, dans les cellules souches neurales de la zone sous-ventriculaire du cerveau de la souris adulte, les gouttelettes lipidiques peuvent se répartir de manière inégale et la cellule souche neurale fille qui en hérite le plus prolifère plus vite (Ramosaj et al., 2021).
La détermination des stomates
Chez Arabidopsis, un modèle classique de division asymétrique est apporté par le lignage qui donne naissance aux stomates (Lee and Bergmann, 2019).

L’initiation du lignage stomatique correspond à la spécification des cellules mères méristémoïdes (MMC) qui déclenche une division asymétrique qui crée une petite cellule qui est un précurseur stomatique transitoire appelé cellule méristémoïde (M) et une grande cellule appelée SLGC. La spécification des MMC dépend de l’expression de SPEECHLESS (SPCH) et de son partenaire hétérodimérique SCREAM (SCRM) tout en étant restreinte par les protéines EPF2, ERECTA et TMM, ce qui assure que des stomates ne seront pas trop rapprochés au sein de l’épiderme (Horst et al., 2015). La cellule méristémoïde continue à exprimer SPCH tandis que cette expression est perdue par la cellule SLGC. Les cellules méristémoïdes peuvent ensuite subir elle-même des divisions asymétriques avec auto-renouvellement ce qui leur donne un caractère de cellule souche. Puis lorsqu’une cellule méristémoïde cesse ses divisions asymétriques, elle cesse d’exprimer SPCH et commence à exprimer MUTE, devenant une cellule-mère des cellules de garde (GMC) (Pillitteri et al., 2007). Celle-ci subit une division symétrique pour donner les deux cellules de garde d’un stomate.
EN DIRECT DES LABOS
LA CARTE MENTALE

AUTRES RESSOURCES SUR LE SUJET :
Mitose et régulation du cycle cellulaire (RNBio – Sciences Sorbonne Université)
EXERCICES SUR LES CYCLES ET DIVISIONS CELLULAIRES
QUELQUES EQUIPES DE RECHERCHE TRAVAILLANT SUR LE SUJET :
Equipe « Biologie des centrosomes et de l’instabilité génomique » – Institut Curie, Paris
- Adhérences cellule-cellule
- Arabidopsis thaliana
- Axe antéro-postérieur chez la drosophile
- Biomécanique du développement
- Caenorhabditis elegans
- Concepts principaux
- Contrôle de la traduction
- Contrôle de la transcription
- Contrôle génétique et épigénétique
- Croissance du tube pollinique et double fécondation chez les Angiospermes
- Croissance et guidage axonal
- Des modèles animaux moins classiques
- Développement de l’oeil des Vertébrés
- Développement et évolution
- Et l’Humain ?
- Exercices sur l’ovogenèse, la spermatogenèse et la fécondation
- Exercices sur le contrôle de l’expression des gènes
- Exercices sur le développement des bourgeons de membre
- Exercices sur le développement des muscles striés squelettiques
- Exercices sur le développement des végétaux et les hormones végétales
- Exercices sur les cycles et les divisions cellulaires
- Exercices sur les étapes du développement, les inductions embryonnaires et la mise en place des axes de polarité
- Exercices sur les matrices extracellulaires, le cytosquelette et les adhérences cellule-cellule
- Exercices sur les voies de signalisation
- Glossaire
- Glossaire des termes liés à la génétique
- Glossaire des termes liés au cytosquelette, la matrice extracellulaire, l’adhérence et la migration cellulaire
- Hématopoïèse et développement des cellules du système immunitaire
- Histoire de la biologie cellulaire et de la biologie du développement
- L’acide rétinoïque
- L’apoptose
- L’autophagie
- L’organogenèse
- L’ovogénèse prépare le développement embryonnaire
- La drosophile
- La fécondation
- La formation des somites
- La gastrulation
- La gastrulation (version allégée)
- La métamorphose chez les Hexapodes et les Amphibiens
- La neurogénèse chez les mammifères adultes
- La neurulation
- La poule
- La signalisation calcique
- La souris
- La superfamille TGFβ et ses voies de signalisation
- La voie de signalisation de l’auxine et ses rôles
- La voie de signalisation Hedgehog
- La voie de signalisation Hippo et ses composants YAP/TAZ
- La voie de signalisation Notch
- Le clivage
- Le cytosquelette
- Le destin des cellules et les réseaux de régulation génique
- Le développement des bourgeons de membre
- Le développement des muscles striés squelettiques
- Le développement des organes génitaux et des cellules germinales
- Le développement du cortex
- Le méristème apical caulinaire en phase végétative et lors de la formation d’une fleur
- Le poisson zèbre
- Le xénope
- Les cellules des crêtes neurales
- Les cellules et les gènes en action dans le développement
- Les cellules souches
- Les cellules tumorales
- Les étapes du développement
- Les étapes du développement embryonnaire d’Arabidopsis thaliana et leur contrôle
- Les inductions embryonnaires et les gradients de morphogène
- Les matrices extracellulaires animales
- Les organismes modèles
- Les outils pour étudier l’expression et la fonction des gènes
- Les parois des cellules végétales
- Les techniques et les outils pour la biologie cellulaire
- Les transitions épithélio-mésenchymateuses et les migrations cellulaires
- Les vésicules extracellulaires
- Les voies de signalisation
- Les voies de signalisation FGF
- Mise en place des axes chez les Vertébrés
- Structures et processus cellulaires
- Voies de signalisation WNT
