Le squelette cranio-facial
Le façonnement de la forme de la tête et de ses composants est un apport essentiel des CCN au développement des Vertébrés par rapport aux Cordés non vertébrés qui n’ont pas de véritables CCN. Le développement de la mâchoire et donc de la prédation au sein des Vertébrés est un apport évolutif fonctionnel majeur dû aux crêtes neurales (Northcutt, 2005). Les CCN contribuent essentiellement au squelette cranio-facial ventral. Dans la partie dorsal, le mésoderme céphalique forme quelques pièces squelettiques.
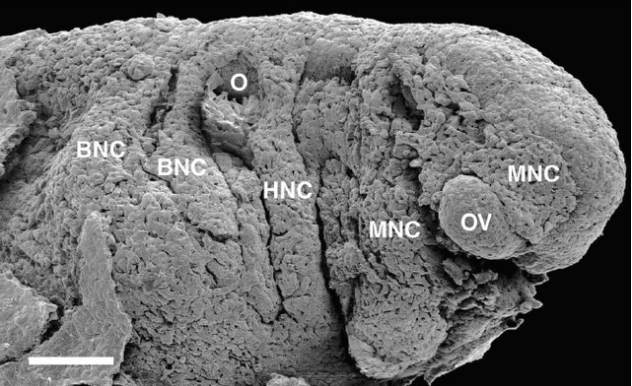
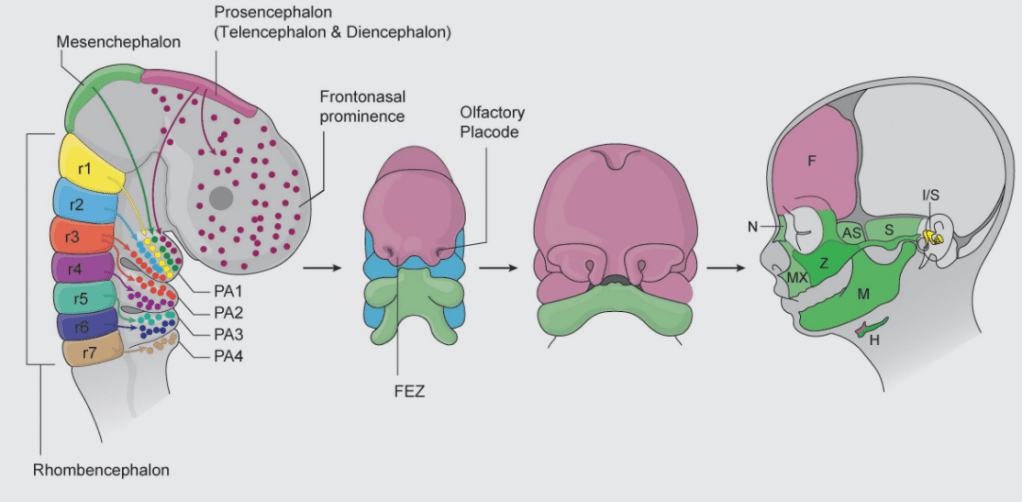
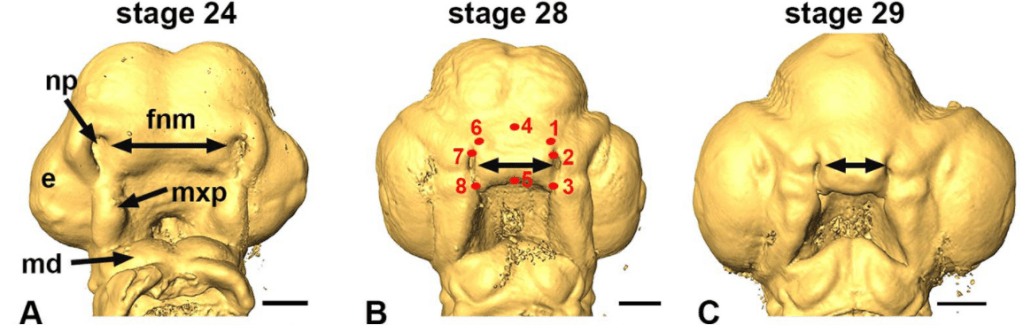
Les CCN qui contribuent au squelette cranio-facial colonisent le premier arc pharyngien (ou branchial) et le processus frontonasal. Les marquages par greffe caille-poulet ont permis de montrer que les CCN qui migrent du diencéphale postérieur se retrouvent dans le bourgeon naso-frontal, les CCN qui migrent du mésencéphale antérieur se retrouvent dans le processus maxillaire et dans la région rétro-oculaire, les CCN qui migrent du mésencéphale postérieur et des 2 premiers rhombomères se retrouvent dans l’arc mandibulaire (Couly et al., 1996). Les CCN qui migrent à partir du rhombomère 4 forment l’arc hyoïde (l’arc pharyngien 2) et des neurones du ganglion crânien facial VII.
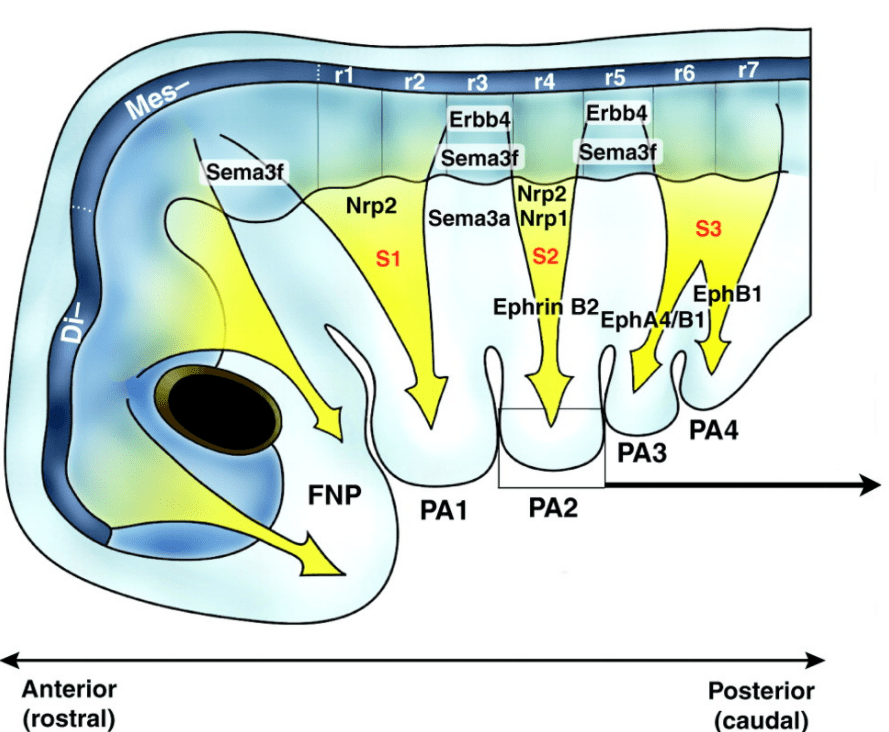
Chez les Mammifères, les trois osselets de l’oreille moyenne (marteau, enclume, étrier) sont évolutivement issus des arcs pharyngiens et donc des CCN céphaliques. Ce sont des signaux provenant de l’endoderme adjacent (Shh et BMP4) qui contrôlent leur spécification et leur différenciation (Ankamreddy et al., 2019).
Durant leur migration, les CCN céphaliques doivent aussi proliférer pour coloniser de vastes territoires.
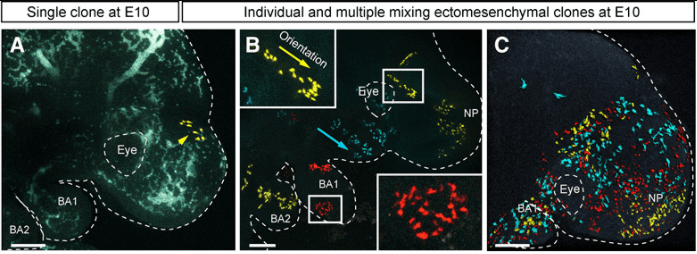
Traçage génétique des cellules de la crête neurale et de leurs descendances clonales induites à E8.5 dans des embryons Sox10-CreERT2/R26Confetti et analysées à E9.5 à E10. (A) Tête de l’embryon E10 avec un seul clone YFP+. Notez la structure compacte du clone. (B) Plusieurs clones séparés dans différentes régions du visage de l’embryon. Les pointes de flèches jaunes et bleues indiquent l’orientation de migration des groupes cellulaires. (C) Exemple de plusieurs clones qui se chevauchent dans le visage en développement précoce. Source : https://www.science.org/doi/10.1126/sciadv.1600060
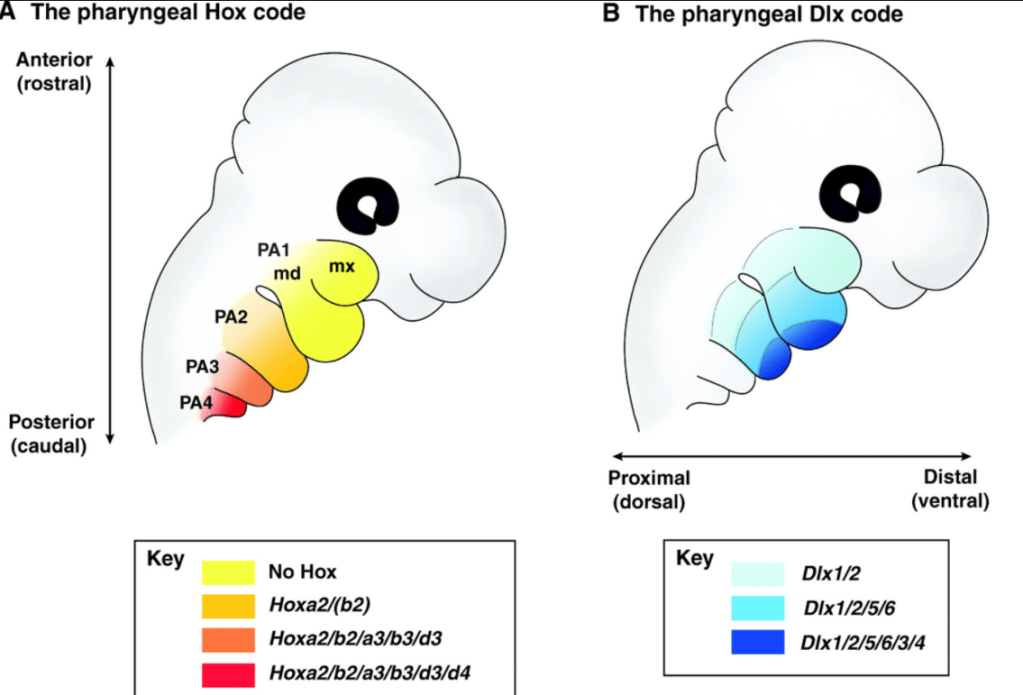
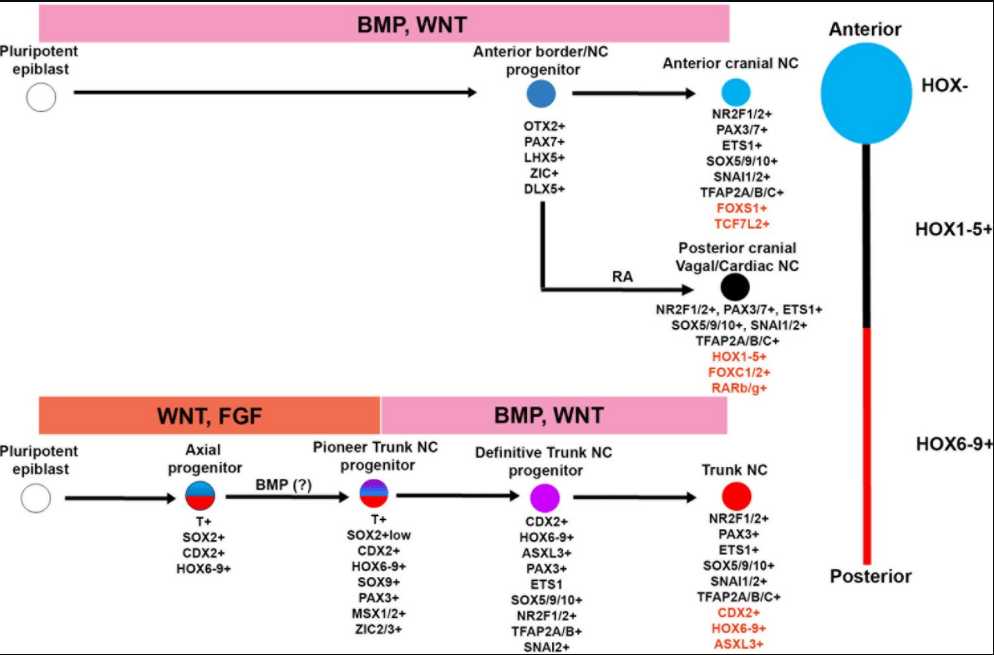
Les CCN céphaliques doivent acquérir une information de position pour migrer correctement et se différencier en structures adéquates. Elles sont régionalisées entre autres par les gènes Hox. Les CCN les plus antérieures jusqu’au rhombomère 2 inclus n’expriment pas de gène Hox tandis que les CCN plus postérieures en expriment. Cela a un impact sur leur détermination. Seules les CCN qui n’expriment pas les gènes Hox peuvent donner du tissu osseux (Creuzet et al., 2005). Si on force l’expression de gènes Hox dans les CCN les plus antérieures, elles perdent leur capacité à former du tissu osseux.
La migration en flux bien distincts et définis, sans mélange, entre les différents niveaux de l’axe AP permet de préserver ces identités spécifiques des CCN et de les « transporter avec elles » vers leurs tissus de destination. Cependant, ces derniers peuvent dans une certaine mesure influencer le devenir des cellules et des régions du mésoderme céphalique peuvent induire des destinées nouvelles dans des CCN greffées ectopiquement, surtout si celles-ci sont en petit nombre (Trainor et Krumauf, 2000). Il y a ainsi mise en évidence d’un effet de communauté où de grandes populations de CCN ont une plasticité moindre que des petites populations isolées où la détermination n’est pas aussi fermement établie.
Un code impliquant une combinaison des gènes Dlx permet de spécifier les structures dérivées des CCN du premier arc branchial : Dlx1 et Dlx2 sont exprimés dans les processus mandibulaire et maxillaire, Dlx5 et Dlx6 uniquement dans le processus mandibulaire et Dlx3 et Dlx4 que dans la région la plus distale du processus mandibulaire (Minoux et Rijli, 2010). Les gènes Dlx codent des facteurs de transcription à homéodomaine, comme les gènes Hox.
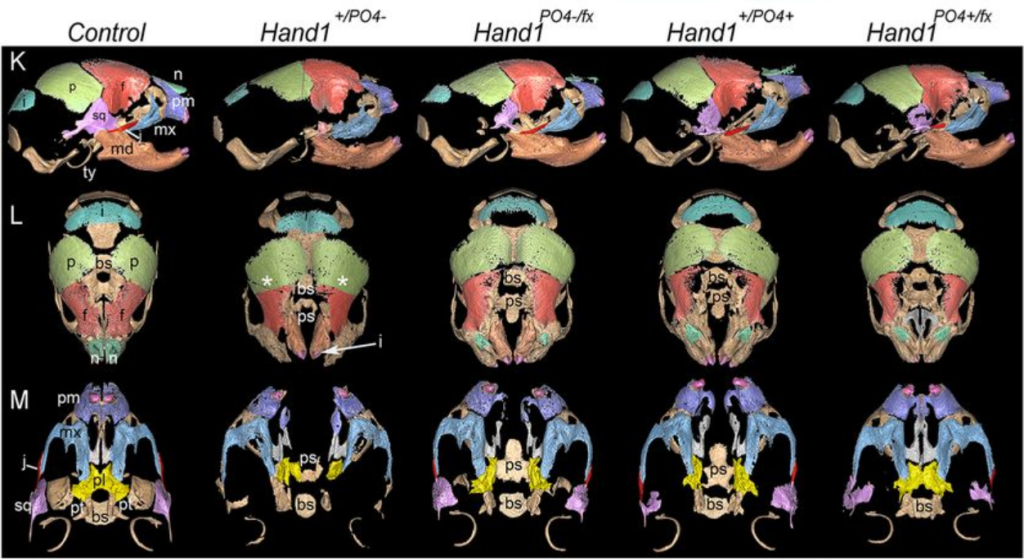
Les facteurs de transcription de type hélice-boucle-hélice basique Hand1 et Hand2 jouent un rôle essentiel dans le développement des crêtes neurales céphaliques. La délétion spécifique de Hand2 dans les CCN aboutit à la quasi-disparition de la mâchoire inférieure et de la langue (Barron et al., 2011). Un phénotype important des mutations perte-de-fonction de Hand1 n’apparait que si on les met dans un contexte hétérozygote pour Hand2, montrant une compensation fonctionnelle partielle (Barbosa et al., 2007). Non seulement, l’expression de ces facteurs de transcription est importante mais aussi leur phosphorylation sur des sérines/thréonines (Firulli et al., 2014). Des formes déphosphorylées favorisent les formations d’homodimères alors que les formes phosphorylées favorisent les formations d’hétérodimères (comme Hand1/Hand2 par exemple) et les cibles génétiques activées entre ces deux formes ne sont pas les mêmes.
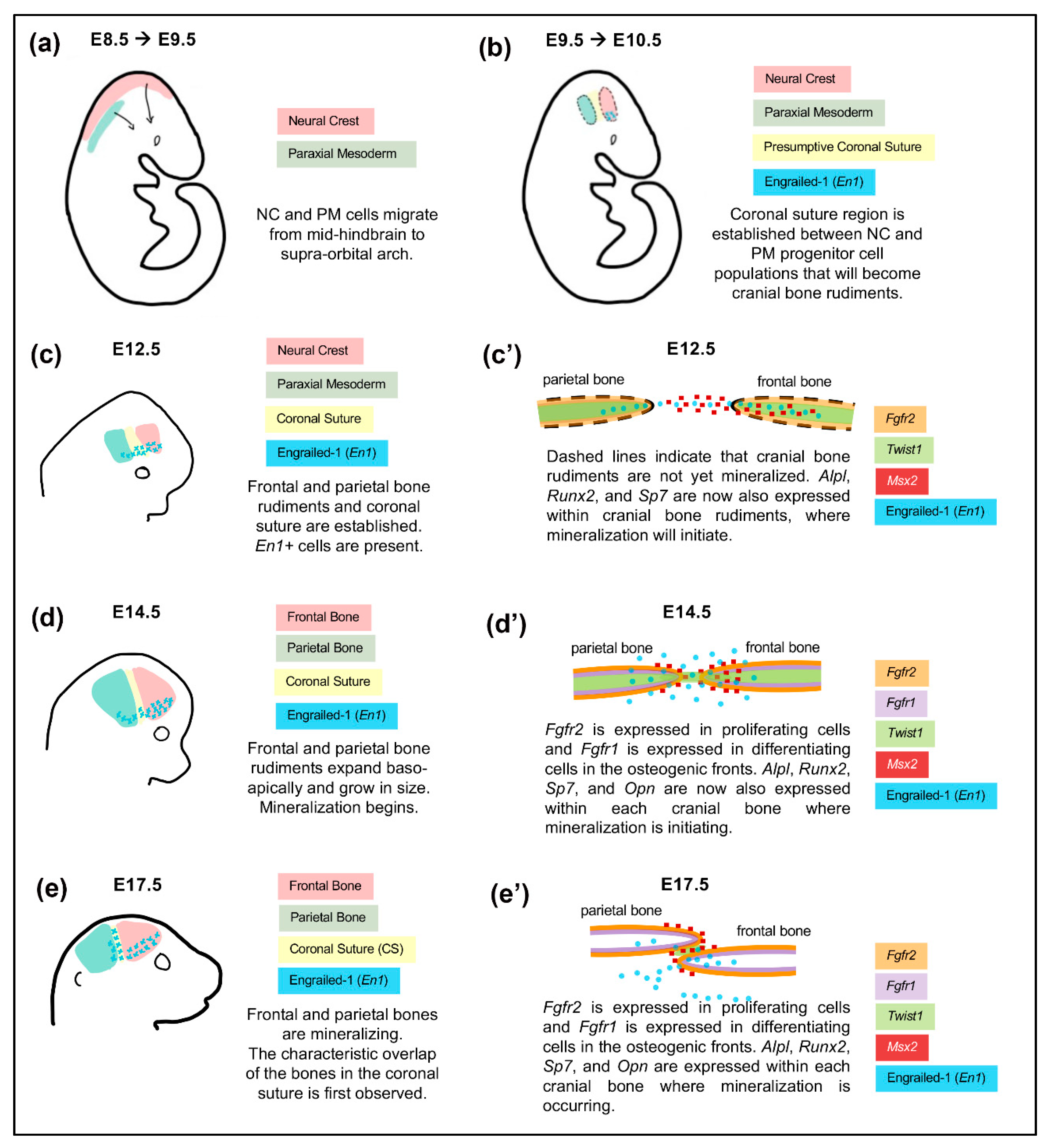
Les mutations du facteur de transcription TWIST1 chez l’homme sont associées à la craniosynostose (El Ghouzzi et al., 2000) et à des anomalies vasculaires cérébrales (Tischfield et al., 2017). La craniosynostose est la fusion prématurée des sutures crâniales. Elle concerne 1 naissance sur 2000. Les mutations perte-de-fonction de TWIST1 constituent la deuxième cause de craniosynostose et prennent phénotypiquement la forme du syndrome de Saethre-Chotzen.

Les analyses phénotypiques de la souris knock-out conditionnelle Twist1 ont révélé que TWIST1 est nécessaire dans les CCN pour la formation du squelette facial, la voûte crânienne antérieure et la structuration des nerfs crâniens (Soo et al., 2002; Ota et al., 2004; Bildsoe et al., 2009; Bildsoe et al., 2016).
Twist1 a été impliqué dans l’activation de la migration des CCN. Il active l’expression de gènes nécessaires à cette migration en recrutant notamment des modificateurs de la chromatine tels que les hélicases à chromodomaine Chd7 et Ched8 ainsi que l’histone-méthyltransférase Whsc1 (Fan et al., 2021).
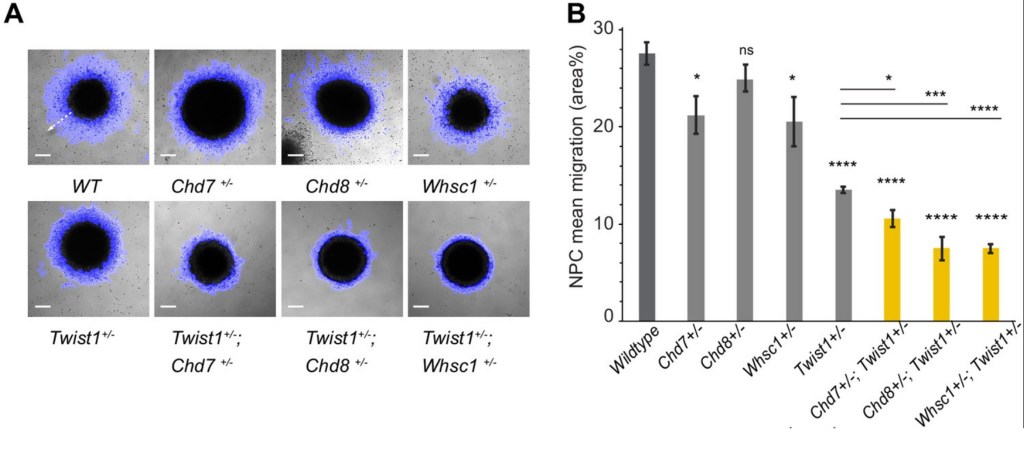
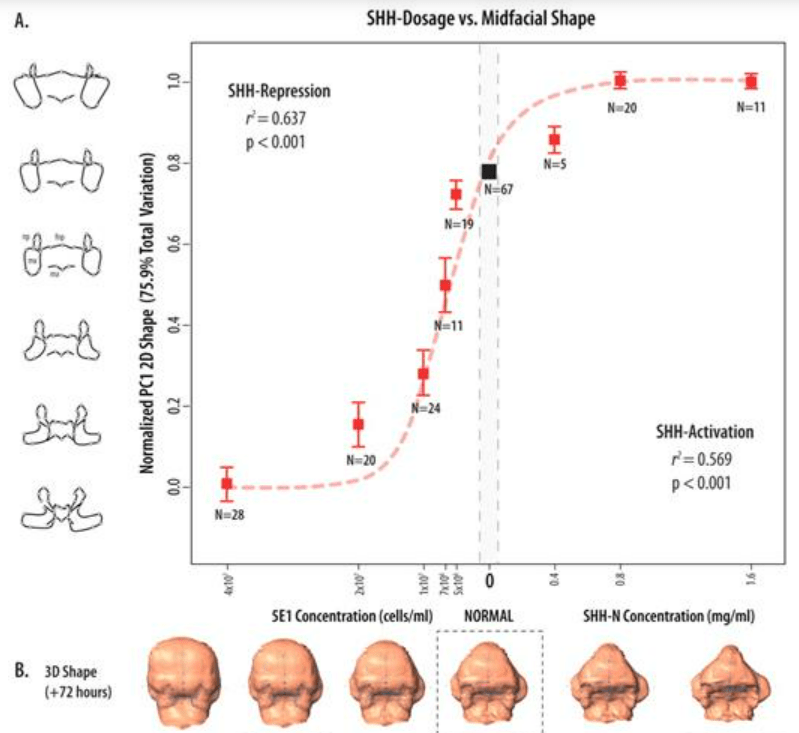
Le développement des CCN céphaliques est bien sûr influencé par des molécules de signalisation produites dans leur environnement. Par exemple, Sonic Hedgehog (Shh) est exprimé dans la zone épidermique fronto-nasale (FEZ) et il contrôle notamment la prolifération. Une inhibition de l’action de Shh aboutit à une figure étroite et tronquée alors qu’une suractivation de la voie de signalisation Shh produit une mâchoire supérieure très large (Hu et Marcucio, 2009).
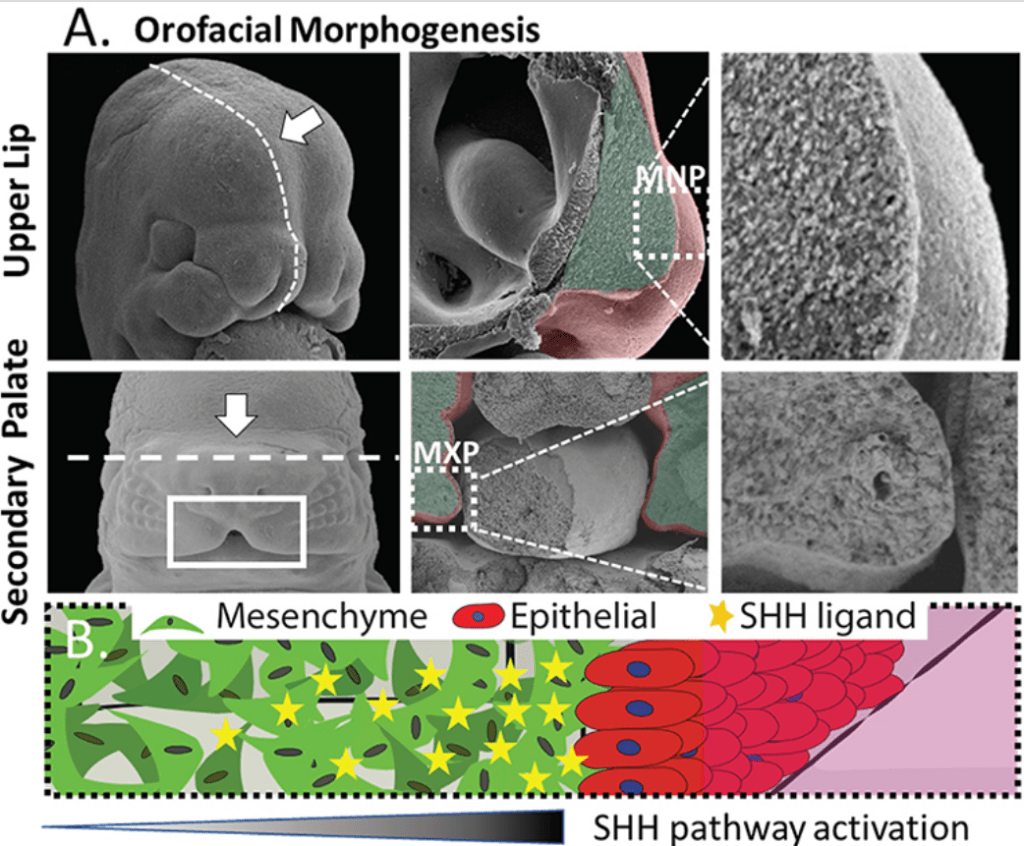
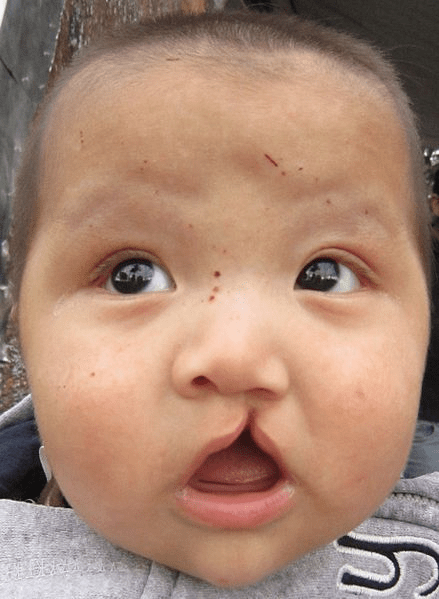
Shh a été directement impliqué dans le développement de la lèvre supérieure et du palais, ce qui en fait une des voies de signalisation qui peut être perturbée en présence d’une fente labiale et d’une fente palatine (« bec-de-lièvre ») (1 naissance sur 1000 environ).
Une activité de signalisation Wnt altérée est fortement associée à la présence d’une fente palatine. Par exemple, Wnt5a est exprimé dans le mésenchyme dérivé des CCN et les souris dépourvues de Wnt5a ou de son récepteur Ror2 ont une mandibule raccourcie et une fente palatine (He et al., 2008). De plus, une déficience mésenchymateuse de Porcn, codant pour une O-acyltransférase nécessaire à la modification lipidique des WNT, entraîne également une fente palatine (Bankhead et al., 2015).
Les facteurs BMP interviennent également. Une déficience en BMP4 entraîne des anomalies cranio-faciales, telles qu’une fente labiale et palatine, chez la souris comme chez l’homme (Liu et al., 2005; Suzuki et al., 2009). BMP4 régule la configuration proximodistale et le moment de la différenciation osseuse dans le mésenchyme mandibulaire (Liu et al., 2005; Merrill et al., 2008). Par exemple, l’une des cibles directes de la voie BMP est le gène Satb2 codant un facteur important pour le développement des ostéoblastes. Le gène Hand1 est également une des cibles directes (nous avons vu l’importance de ce gène plus haut) (Bonilla-Claudio et al., 2012). Des changements dans la signalisation BMP4 jouent un rôle significatif dans l’évolution comme le montre l’exemple des pinsons de Darwin (Abzhanov et al., 2004; Wu et al., 2004) ou celui des poissons cichlidés (Albertson et al., 2005).
Des facteurs environnementaux tératogènes peuvent affecter le développement des CCN céphaliques. Le plus répandu d’entre eux est l’alcool (l’éthanol) qui cause le syndrome d’alcoolisation fœtale qui touche environ 0,5 % des nouveaux nés et s’accompagne de déficiences mentales et de malformations craniofaciales (milieu de la figure plus aplati, nez plus petit, philtrum (sillon entre l’axe du nez et la lèvre supérieure) réduit…) Ces malformations ont été reliées à des défauts de survie d’une fraction des CCN céphaliques.
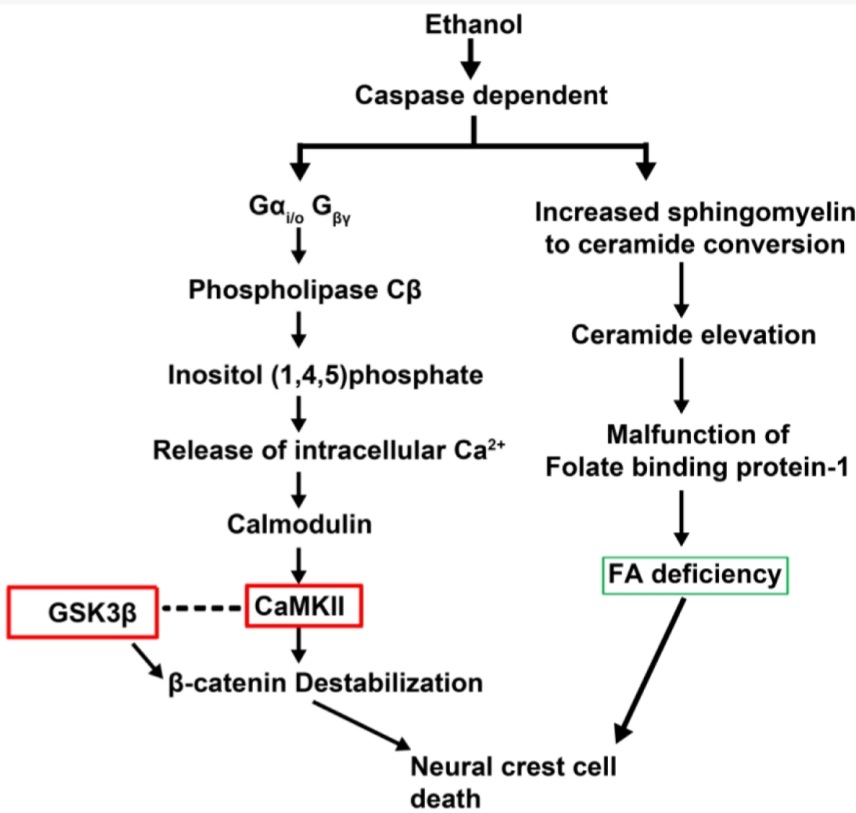
Des mutations dans le gène Vangl2 dont le produit est impliqué dans la voie de polarité planaire Wnt rendent plus sensibles à l’alccol un modèle de poisson-zèbre de syndrome d’alcoolisation foetale, montrant les interactions entre facteurs génétiques et facteurs environnementaux (Sidik et al., 2021).
Egalement, une partie d’une des anomalies congénitales les plus fréquentes, la présence d’une fente labiale et d’une fente palatine (« bec-de-lièvre ») (1 naissance sur 1000 environ) est causée par l’exposition à des facteurs tératogènes environnementaux (alcool, fumée de cigarette, dioxine, déxaméthasone, métaux lourds) (Buser et Pohl, 2015; Carlson et al., 2022). Des mutations sont aussi associées avec ce phénotype (au moins une cinquantaine de loci ont été impliqués) et des interactions complexes environnement/génotype sont à l’origine de ce type d’anomalies (Beaty et al., 2016).
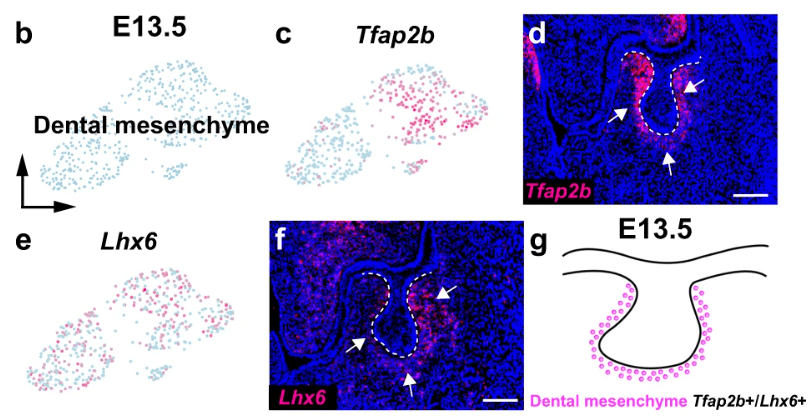
Lors de la formation des dents, les cellules des crêtes neurales (CCN), interagissent avec l’épithélium oral compétent des placodes dentaires. Cette interaction initie la formation de la lame dentaire, puis du bourgeon épithélial, et conditionne la condensation mésenchymateuse qui donnera les odontoblastes sécréteurs de dentine ainsi que les cellules de la papille dentaire. Des expériences classiques, comme celles de Lumsden en 1984 sur des recombinaisons ex vivo chez la souris, démontrent que seules les CCN associées à l’épithélium oral spécifique permettent le développement d’un germe dentaire fonctionnel.
Différenciation in vitro des cellules de crêtes neurales à partir de cellules pluripotentes humaines
Les neurocristopathies sont des maladies liées à des défauts de développement des crêtes neurales. Pour mieux comprendre l’enchaînement des évènements qui mènent de la ou des mutation(s) jusqu’à la malformation, la culture de cellules de crêtes neurales humaines in vitro est un grand atout. De nombreuses équipes ont mis au point divers protocoles pour produire des CCN à partir de cellules ES ou de cellules iPS humaines. Les protocoles sont inspirés de l’enchaînement de l’activation des voies de signalisation dans l’embryon. Les CCN sont obtenus avec une activation modérée de la voie BMP (mimant ce qu’il se passe dans la bordure neurale) et la voie WNT doit être activée. Il s’agit non seulement d’obtenir des CCN mais aussi des CCN du bon niveau antéro-postérieur (céphalique, vagal, troncal…). L’activation de la voie de signalisation FGF est utilisée pour postérioriser des CCN qui, par défaut dans les protocoles utilisés, sont plutôt céphalique. Cette même modulation peut être obtenue dans d’autres protocoles avec un renforcement de la voie WNT. L’acide rétinoïque peut également être utilisé pour postérioriser des CCN et obtenir des CCN vagales et cardiaques.
DES EQUIPES FRANCOPHONES TRAVAILLANT SUR LE SUJET :
Equipe « Destin, plasticité et reprogrammation cellulaire » – Institut Cochin, Paris
- Adhérences cellule-cellule
- Arabidopsis thaliana
- Axe antéro-postérieur chez la drosophile
- Biomécanique du développement
- Caenorhabditis elegans
- Concepts principaux
- Contrôle de la traduction
- Contrôle de la transcription
- Contrôle génétique et épigénétique
- Croissance du tube pollinique et double fécondation chez les Angiospermes
- Croissance et guidage axonal
- Des modèles animaux moins classiques
- Développement de l’oeil des Vertébrés
- Développement et évolution
- Et l’Humain ?
- Exercices sur l’ovogenèse, la spermatogenèse et la fécondation
- Exercices sur le contrôle de l’expression des gènes
- Exercices sur le développement des bourgeons de membre
- Exercices sur le développement des muscles striés squelettiques
- Exercices sur le développement des végétaux et les hormones végétales
- Exercices sur les cycles et les divisions cellulaires
- Exercices sur les étapes du développement, les inductions embryonnaires et la mise en place des axes de polarité
- Exercices sur les matrices extracellulaires, le cytosquelette et les adhérences cellule-cellule
- Exercices sur les voies de signalisation
- Glossaire
- Glossaire des termes liés à la génétique
- Glossaire des termes liés au cytosquelette, la matrice extracellulaire, l’adhérence et la migration cellulaire
- Hématopoïèse et développement des cellules du système immunitaire
- Histoire de la biologie cellulaire et de la biologie du développement
- L’acide rétinoïque
- L’apoptose
- L’autophagie
- L’organogenèse
- L’ovogénèse prépare le développement embryonnaire
- La drosophile
- La fécondation
- La formation des somites
- La gastrulation
- La gastrulation (version allégée)
- La métamorphose chez les Hexapodes et les Amphibiens
- La neurogénèse chez les mammifères adultes
- La neurulation
- La poule
- La signalisation calcique
- La souris
- La superfamille TGFβ et ses voies de signalisation
- La voie de signalisation de l’auxine et ses rôles
- La voie de signalisation Hedgehog
- La voie de signalisation Hippo et ses composants YAP/TAZ
- La voie de signalisation Notch
- Le clivage
- Le cytosquelette
- Le destin des cellules et les réseaux de régulation génique
- Le développement des bourgeons de membre
- Le développement des muscles striés squelettiques
- Le développement des organes génitaux et des cellules germinales
- Le développement du cortex
- Le méristème apical caulinaire en phase végétative et lors de la formation d’une fleur
- Le poisson zèbre
- Le xénope
- Les cellules et les gènes en action dans le développement
- Les cellules souches
- Les cellules tumorales
- Les cycles et les divisions cellulaires
- Les étapes du développement
- Les étapes du développement embryonnaire d’Arabidopsis thaliana et leur contrôle
- Les inductions embryonnaires et les gradients de morphogène
- Les matrices extracellulaires animales
- Les organismes modèles
- Les outils pour étudier l’expression et la fonction des gènes
- Les parois des cellules végétales
- Les techniques et les outils pour la biologie cellulaire
- Les transitions épithélio-mésenchymateuses et les migrations cellulaires
- Les vésicules extracellulaires
- Les voies de signalisation
- Les voies de signalisation FGF
- Mise en place des axes chez les Vertébrés
- Structures et processus cellulaires
- Voies de signalisation WNT
