Le développement des cellules germinales
A la fin du XIXème siècle, Auguste Weissmann proposa sa théorie du plasma germinatif où il distingue les cellules germinales, qui assurent la pérennité de l’espèce à travers la continuité de la descendance des individus, des cellules somatiques, responsables de la construction d’un individu mais par définition « mortelles ». Les cellules germinales gardent aussi leur totipotence, contrairement aux cellules somatiques qui la perdent au cours de leur différenciation. En règle générale, cette totipotence ne peut s’exprimer qu’en cas de fécondation mais des cas de parthénogenèse où l’ovocyte se développe seul en embryon existent dans divers groupes de Métazoaires.
Dans de nombreux organismes, la lignée germinale est parmi les premiers types de cellules à être mis de côté. Une lignée germinale séparée tôt du reste des cellules empêche la transmission de mutations somatiques aux générations futures, ce qui peut être un avantage. Les cellules germinales précoces, appelées cellules germinales primordiales (PGC), sont spécifiées par des facteurs maternels ou par des signaux inductifs (Lawson et al., 1999). Une fois spécifiées, les PGC ignorent les programmes de différenciation somatique et migrent vers le site dans lequel se forme la gonade (Braat et al., 1999; Gross-Thebing et al., 2017; Extavour et Akam, 2003; Marlow, 2015). Là, les PGC prolifèrent, entrent en méiose (avec un délai plus ou moins long) et se différencient pour produire les gamètes: spermatozoïdes chez les mâles et ovocytes chez les femelles.
Les animaux dit clonaux tels que les Cnidaires ne séparent pas une lignée germinale pendant l’embryogenèse. Au lieu de cela, ils possèdent des cellules souches adultes qui contribuent aux tissus somatiques, mais aussi aux gamètes. Ce sont des animaux qui ont en général de très bonnes capacités de régénération. Ainsi, toute partie du corps possédant ces cellules souches peut régénérer un individu qui pourra produire des cellules germinales et transmettre ses gènes à une nouvelle génération. Le facteur de transcription AP2 (Tfap2), un régulateur de la lignée germinale chez les Mammifères, est nécessaire et suffisant pour engager les cellules souches adultes, appelées cellules i, à devenir des cellules germinales chez le cnidaire Hydractinia symbiolongicarpus.
On pense qu’une lignée germinale non séparée à l’état embryonnaire est un trait ancestral chez les Métazoaires. Dans cette hypothèse, un évènement clé dans l’évolution des lignées germinales aura été le décalage du programme d’induction de cellules germinales depuis les adultes vers l’embryon.
La définition clinique de l’infertilité est définie comme l’incapacité des couples à concevoir un enfant après 18 mois de rapports sexuels réguliers non protégés. Selon les statistiques de l’Organisation Mondiale de la Santé, l’infertilité affecte environ 12 à 15 % des couples dans le monde (American Society for Reproductive Medicine, 2015). Les facteurs masculins sont responsables de 50 % des cas d’infertilité, parmi lesquels 20 % à 30 % sont dus uniquement à des facteurs masculins et 20 à 30 % sont dus à des facteurs affectant les deux partenaires (Tournaye et al., 2017). La prévalence de l’infertilité masculine a augmenté de 0,291 % par an de 1990 à 2017 dans le monde, et pourrait approcher la limite de 50 %. L’étude du développement des cellules germinales et de leur physiologie sert aussi à trouver des solutions pour les patient.e.s infertiles.
Chez Caenorhabditis elegans
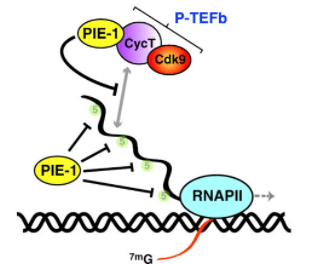
Chez le nématode, la lignée germinale est mise en place à la fin de la quatrième division de clivage. Toutes les cellules germinales sont dérivées du blastomère P1. L’ovocyte contient des granules P dans son cytoplasme qui au cours de divisions asymétriques successives finissent dans les cellules P. Un composant de granule P, le produit du gène pgl est nécessaire pour le développement des cellules germinales, et régule certains aspects du métabolisme des ARNm. Le facteur de transcription à doigts de zinc PIE-1, produit par la mère, est impliqué dans le maintien des propriétés de cellules germinales dans les blastomères dérivés de P. En effet, chez les mutants pie-1, la lignée germinale se différencie en cellules intestinales surnuméraires (Mello et al., 1992). Alors que la transcription est activée dans les cellules somatiques au stade 3-4 cellules, PIE-1 réprime la nouvelle transcription des gènes zygotiques dans les blastomères dérivés de P jusqu’à ce qu’il disparaisse aux alentours du stade 100 cellules. Cette répression générale protège les cellules germinales des actions de facteurs de transcription qui favorisent le développement en cellules somatiques (Nakamura et Seydoux, 2008).
Une caractéristique commune des cellules germinales est la présence de granules germinaux (nous venons de voir les granules P chez C. elegans). Il s’agit de compartiments cytoplasmiques sans membrane qui se forment par séparation en phase liquide-liquide (LLPS) à partir du cytoplasme (Brangwynne et al., 2009). Riches à la fois en ARN et en protéines de liaison à l’ARN, les granules germinaux contiennent un grand nombre de molécules ayant des rôles dans la régulation post-transcriptionnelle de l’ARN et la préservation de l’intégrité du génome. Ces assemblages complexes de ribonucléoprotéines (RNP) sont importants pour la spécification, la maintenance et le développement normal de la lignée germinale (Knutson et al., 2017).
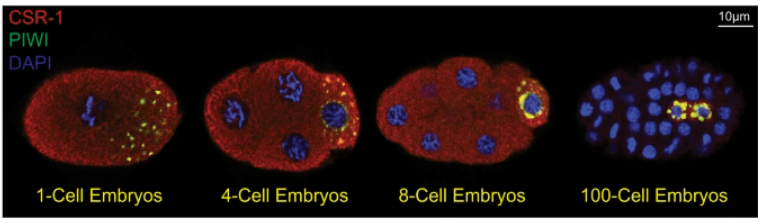
La spécification des PGC nécessite l’activité de régulateurs de la chromatine qui induisent des changements à l’échelle du génome dans l’expression des gènes. Chez C. elegans, la méthyltransférase MES-4 et le Polycomb Repressive Complex (PRC2, comprenant MES-2, 3 et 6) coopèrent pour ajouter des modifications épigénétiques sur les histones favorables à la transcription sur les gènes spécifiques de la lignée germinale (via MES-4) et répressives pour les gènes de la lignée somatique (via PRC2) (Gaydos et al., 2012).
L’activation dépendante de MES-4 des gènes de la lignée germinale est antagonisée dans les lignées somatiques par un groupe de régulateurs transcriptionnels (Curran et al., 2009 ; Petrella et al., 2011 ; Unhavaithaya et al., 2002). Parmi ceux-ci, DRM et LIN-15B répriment les gènes de détermination de la lignée germinale dans les cellules somatiques (Petrella et al., 2011). La perte de facteurs DRM ou LIN-15B provoque une activation ectopique des gènes de la lignée germinale dans les cellules somatiques.
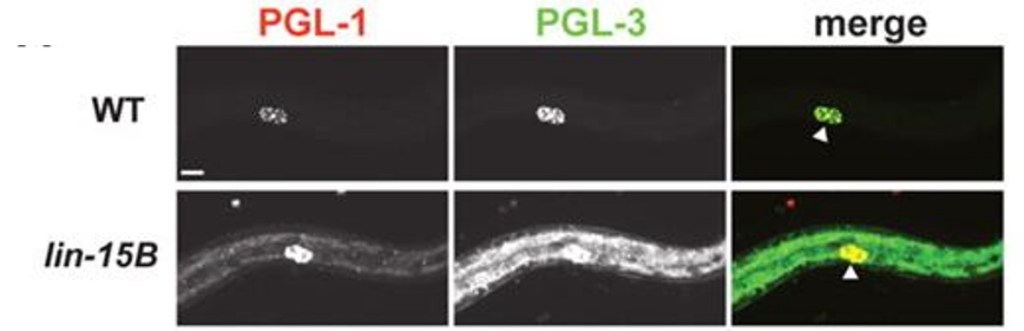
L’inactivation de MES-2/-3/-4/-6 supprime l’expression du gène de la lignée germinale ectopique des mutants lin-15B à 26°C. Ces observations suggèrent que les facteurs DRM et LIN-15B antagonisent l’activité du MES dans les lignées somatiques pour empêcher les gènes de la lignée germinale de s’exprimer.
Chez les Mammifères
Chez l’embryon de souris à E7,25, il y a apparition de 15 à 100 cellules germinales primordiales (PGC) dans l’endoderme du sac vitellin et dans la région de l’allantoïde proche de la ligne primitive. Elles ont été identifiées initialement par l’activité importante de leur alcaline phosphatase (Ginsburg et al., 1990), mais elles expriment d’autres protéines spécifiques comme par exemple Prdm1.

Les PGC sont spécifiés au même endroit chez l’embryon humain à la fin de la 2ème semaine après la fécondation (Chen et al., 2019).
Contrairement à beaucoup d’autres modèles, chez les Mammifères, les PGC ne se forment pas par héritage de matériel cytoplasmique mais par induction. Les souris Bmp4-/- ne forment pas de cellules germinales et l’expression ectopique de BMP4 dans un épiblaste compétent peut induire des cellules germinales ectopiques. On en déduit que le destin des cellules germinales est induit dans l’épiblaste vers le jour embryonnaire E6 par BMP4 produit dans l’ectoderme extra-embryonnaire (Lawson et al., 1999). En réponse au BMP4, les cellules induites en PGC activent l’expression de Oct4 et de Sox2 qui codent des facteurs de transcription impliqués dans la pluripotence et le profil de méthylation de l’ADN de ces cellules change. Blimp1 (Prdm1) et Prdm14 sont des régulateurs transcriptionnels critiques pour le devenir des PGC (Kurimoto et al., 2008, Ohinata et al., 2005, Vincent et al., 2005, Yamaji et al., 2008), de même que AP2γ (codé par Tfap2C) qui agit en coordination avec d’autres facteurs de transcription, tels que PAX5 et SOX17. La spécification des PGC nécessite l’activité de régulateurs de la chromatine qui induisent des changements à l’échelle du génome dans l’expression des gènes. Par exemple, chez la souris, le répresseur transcriptionnel Prdm1 initie la spécification des PGC en bloquant l’expression d’un programme mésodermique qui reste actif dans les cellules somatiques voisines sans Prdm1 (Ohinata et al., 2005) et il réprime également l’expression des gènes Hox (Yabuta er al., 2006). Le génome devient globalement hypométhylé, une caractéristique qui rapproche les PGC des cellules pluripotentes telles que les cellules de la masse cellulaire interne, les cellules ES et les cellules iPS.
Malgré le fait que les PGC des Mammifères sont spécifiés par des signaux inductifs et non pas par héritage maternel comme dans beaucoup d’autres animaux, leur profil transcriptomique est assez similaire : par exemple, 80% des transcrits sont similaires entre les cellules germinales humaines et celles du xénope (Butler et al., 2018).
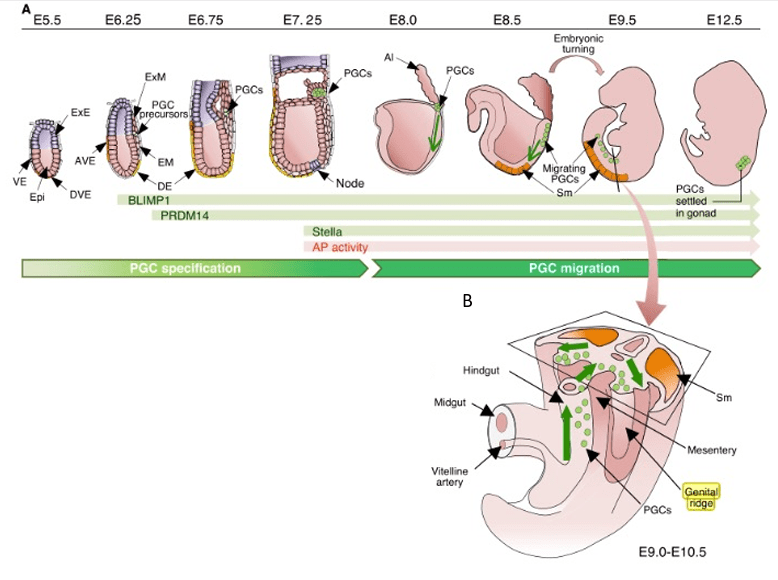
Les PGC migrent dans l’épithélium endodermique de l’intestin postérieur où 170 à 350 PGC se trouvent au jour 9 du développement fœtal chez la souris, puis le long du mésentère dorsal vers les crêtes génitales situées dans le toit du cœlome qui est le site du développement des gonades (Molyneaux et al., 2001).
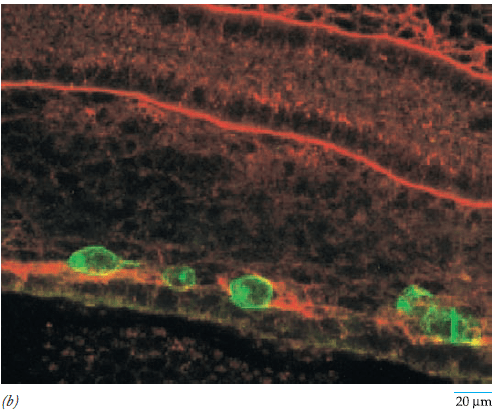
Durant cette migration, les PGC sont entourées de cellules sécrétant SCF (pour Stem Cell Factor) qui est indispensable pour leur survie et leur migration (Yan et al., 2000). Le récepteur de SCF est une tyrosine-kinase transmembranaire, c-kit. Les PGC ont aussi besoin du ligand SDF-1 pour migrer correctement et elles expriment son récepteur CXCR4 (Ara et al., 2003).
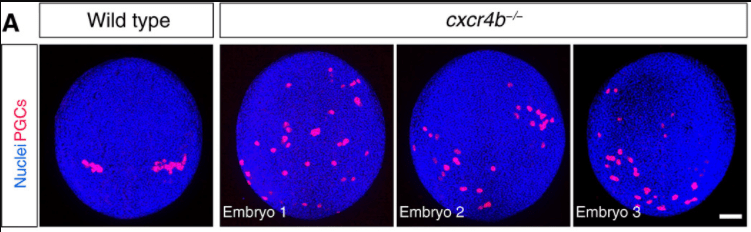
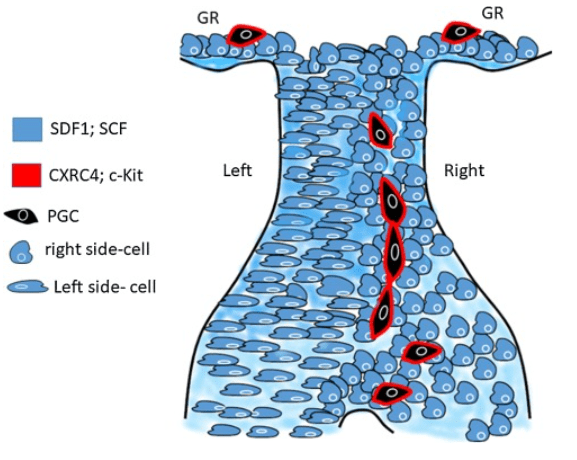
Les PGC migrent dans le mésentère dorsal lors de leur trajet de l’endoderme vers les crêtes génitales (GR) (futures gonades). Les PGC expriment le récepteur de chimiokine CXCR4 et le récepteur tyrosine kinase c-Kit. Les cellules du mésentère dorsal sécrètent les facteurs solubles SDF1 et SCF. Les interactions entre SDF1/CXCR4 et SCF/c-Kit sont nécessaires la migration des PGC le long du mésentère vers les crêtes génitales. Source : https://www.sciencedirect.com/science/article/pii/S1084952117305396
L’expression par les PGC de l’intégrine β1 est également nécessaire à leur migration (Anderson et al., 1999). Les PGC migrent aussi durant une partie de leur trajectoire dans le mésentère dorsal le long de fibres nerveuses du système nerveux autonome, et des échanges de signaux sont possibles entre les deux populations (Mollgard et al., 2010).
Il ne semble pas y avoir de signaux chémoattracteurs à distance en provenance de la destination des PGC, c’est-à-dire les crêtes génitales, car dans des souris mutantes où les crêtes génitales sont absentes, les PGC migrent quand même dans la bonne direction. Ce n’est alors que la toute dernière phase de migration (et de prolifération) qui est affectée (Chen et al., 2013).
Il y a environ 5 000 PGC dans les embryons de souris de 11 à 12 jours et plus de 20 000 PGC au moment où les crêtes génitales sont complètement colonisées aux jours 13-14. Chez l’humain, les crêtes génitales sont colonisées au cours de la 5ème semaine après la fécondation. Ces PGC sont la seule source de cellules germinales adultes. Ce n’est qu’une fois arrivées dans les crêtes génitales que les PGC activent l’expression de Dazl (une protéine se liant aux ARN) et qu’ainsi leur devenir est totalement restreint à la production de gamètes (des études récentes ont montré que les PGC en migration gardent des potentialités différentes (Nicholls et al., 2019).
L’origine et la migration des PGC vers les crêtes génitales sont les mêmes chez les mâles et les femelles. Ces cellules sont bipotentielles, c’est-à-dire qu’elles peuvent donner des ovocytes ou des spermatozoïdes. La différenciation sexuelle des gonades, en testicules ou en ovaires, se produit dans l’embryon de 12 à 13 jours. C’est cet environnement qui va orienter la différenciation des PGC en ovocytes ou en spermatozoïdes (Nicholls et al., 2019).
Durant le début de leur développement, les PGC subissent une reprogrammation épigénétique importante qui permet, entre autres, d’effacer des marques épigénétiques d’origine parentale ou provenant du début du développement embryonnaire. Les premières étapes de cette reprogrammation se produisent pendant la migration, et sont caractérisées par une perte de diméthylation de l’histone H3 lysine 9 (H3K9me2) à l’échelle du génome et par une augmentation de la triméthylation de l’histone H3 lysine 27 (H3K27me3) (Seki et al., 2005, Hajkova et al., 2008). De plus, une élimination globale de la méthylation de l’ADN, notamment dans les séquences impliquées dans l’empreinte parentale est observée et la méthylation de l’ADN atteint son minimum dans les gonades à environ E13,5 (Hajkova et al., 2002; Guibert et al., 2012). Les PGC réactivent l’expression de gènes de pluripotence comme Oct4/Pou5f1, Nanog ou Sox2 (Yabuta et al., 2006).
Ovogenèse et folliculogenèse
L’embryon femelle de souris de 13 jours possède un ovaire différencié avec toutes les PGC converties en ovogonies en division active. Le développement des ovaires est sous le contrôle d’une isoforme de la protéine WT1. Les deux principales isoformes de WT1 résultent de deux sites d’épissage alternatifs à l’extrémité de l’exon 9. Ces isoformes ne diffèrent que par la présence ou l’absence des trois acides aminés KTS (K pour lysine, T pour thréonine et S pour sérine). L’isoforme dépourvue de KTS, appelée -KTS, qui est un facteur de transcription est indispensable pour initier le développement des ovaires (Gregoire et al., 2023). On ne peut donc pas dire que les ovaires se forment par défaut, juste par absence d’expression du gène SRY présent sur le chromosome Y.
Dès le 12ème jour de l’embryogenèse, quelques ovogonies entrent dans la première prophase méiotique. Au jour 14, à peu près la moitié des cellules germinales sont entrées en méiose. Au jour 15, l’ovaire ne contient que des ovocytes à divers stades de la prophase I de méiose (cela correspond à la 9ème semaine du développement chez l’Homme). C’est une très grande différence avec le développement des cellules germinales mâles qui n’entrent en méiose qu’à la puberté. Cette entrée précoce en méiose des ovogonies est sous le contrôle de la protéine Stra8 (Baltus et al., 2006).
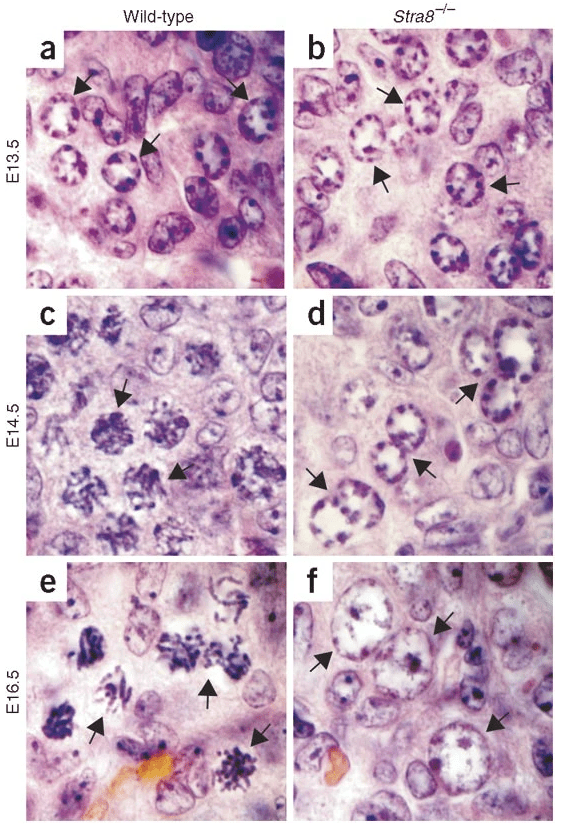
Signalons que Stra8 joue le même rôle lors de la spermatogenèse (Anderson et al., 2008).
L’expression de Stra8 est activée par l’acide rétinoïque secrété par le mésonéphros juste à côté. Dans les testicules en développement, l’acide rétinoïque ne peut pas agir car les cellules y produisent Cyp26b1 qui est une enzyme qui dégrade l’acide rétinoïque (Saba et al., 2014). Au moment de la puberté chez le mâle, les cellules de Sertoli commencent à produire de l’acide rétinoïque et l’expression de Cyp26b1 baisse, ce qui permet à Stra8 d’être activé et à des cellules germinales mâles de commencer leur méiose.
Chez la souris, il faut environ 4 jours aux ovocytes pour réaliser les recombinaisons homologues des crossing-overs, et au jour 18, certains ovocytes ont atteint le stade diplotène de la première prophase méiotique. Au jour 5 après la naissance, presque tous les ovocytes sont arrêtés au stade diplotène tardif où ils restent jusqu’à ce qu’ils soient stimulés pour reprendre la méiose au moment de l’ovulation. On considère qu’à ce stade, il n’y a plus de cellules souches germinales (Lei et Spradling, 2013).
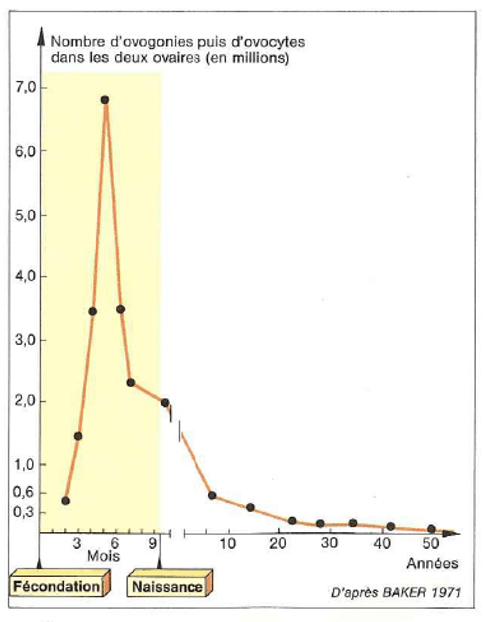
Près de la moitié de la population d’ovocytes de souris est perdue au cours des 2 à 3 premières semaines après la naissance ; une perte d’ovocytes encore plus importante se produit chez la femme qui passe de 7 millions d’ovocytes à 6 mois de développement à 1 million autour de la naissance et à 400.000 au début de la puberté.
L’unité fonctionnelle dans l’ovaire n’est pas l’ovocyte tout seul mais le follicule ovarien où les ovocytes sont entourés par des cellules somatiques (les cellules folliculaires) qui assurent le bon développement des ovocytes et produisent aussi des hormones qui auront une action locale et également endrocrine à distance, notamment sur l’utérus.
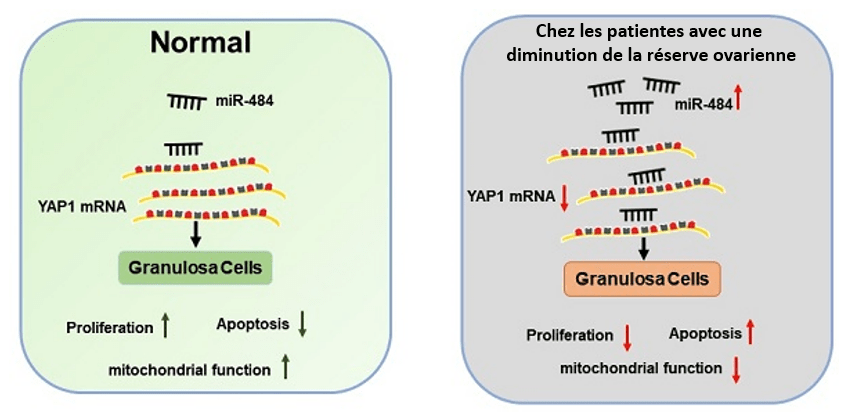
Les ovocytes sont contenus initialement dans des follicules primordiaux qui se structurent autour des ovocytes d’abord par des couches simples de 4 à 6 cellules de type épithéliales aplatie. Les follicules primordiaux produits chez le fœtus sont très stables et ont une demi-vie d’environ 10 mois à l’âge adulte chez la souris et de plusieurs décennies chez la femme (Lei et Spradling, 2013). Le maintien et la survie de ces follicules primordiaux sont importants pour la fertilité et certaines femmes peuvent avoir une fertilité diminuée à cause d’une diminution de la réserve ovarienne en follicules. Les mécanismes en sont encore peu connus mais une étude récente a montré une augmentation de l’expression d’un microARN, miR-484 dans les cellules folliculaires des patientes atteintes de diminution de la réserve ovarienne. Ce miR-484 a pour cible YAP1 un co-facteur de transcription qui stimule l’expression de protéines importantes pour la prolifération et l’inhibition de l’apoptose dans les cellules folliculaires (Li et al., 2022).
Source : https://openstax.org/books/anatomy-and-physiology/pages/27-2-anatomy-and-physiology-of-the-female-reproductive-system
Les ovocytes sont bloqués en prophase I de méiose et entrent en quiescence. C’est un cas exceptionnel car habituellement la quiescence concerne des cellules en G0 et ici, les cellules sont en méiose. Cet état de quiescence peut persister des décennies chez la femme (Kim and Kurita, 2018). PTEN, un inhibiteur de la PI3kinase (car il reconvertit PIP3 en PIP2) a été impliqué dans le maintien de cette quiescence.

Également, l’inactivation de mTORC1, une sérine/thréonine kinase par le complexe TSC1/TSC2 assure le maintien de l’arrêt de la méiose. Chez les souris Tsc1-/-, tous les follicules primordiaux sont activés à la puberté aboutissant à une déplétion prématurée du stock conservé depuis la naissance (Adhikari et al., 2010).
L’activation physiologique des follicules primordiaux a lieu à partir de la puberté et concerne une cohorte d’un nombre variable de follicules selon les espèces. Dans les ovocytes correspondant, la voie PI3K/Akt n’est plus freinée par PTEN et Akt phosphoryle FOXO3, le principal facteur de transcription responsable de l’arrêt de la maturation. FOXO3 ne peut alors plus entrer dans le noyau (John et al., 2008). Dans des modèles murins d’endométriose, la voie PI3K/Akt/FOXO3 est trop activée et aboutit à une activation excessive des follicules primordiaux (Takeuchi et al. 2019).
La couche externe d’environ 1,5 mm de l’ovaire, le cortex ovarien, contient les follicules primordiaux au repos, qui constituent la réserve folliculaire, ainsi que des follicules primaires et de transition. Elle est identifiée par sa structure tissulaire dense et son système vasculaire réduit. La partie interne de l’organe, la medulla, contient les follicules secondaires et antraux en croissance, ainsi que les corps jaunes, et présente une structure de matrice extracellulaire (MEC) plus lâche et contient un système vasculaire plus abondant.
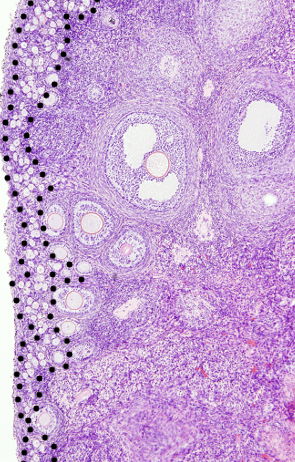
Lorsque les follicules sont activés, les cellules folliculaires prennent d’abord un aspect cuboïdal (stade follicule primaire) et leur nombre augmente jusqu’à > 50. 000 dans les follicules de De Graaf (provient de Regnier De Graaf, un physiologiste néerlandais du XVIIème siècle qui a découvert ces follicules). Chez la femme, le diamètre du follicule de De Graaf atteint 22 mm (donc bien visible à l’oeil nu).

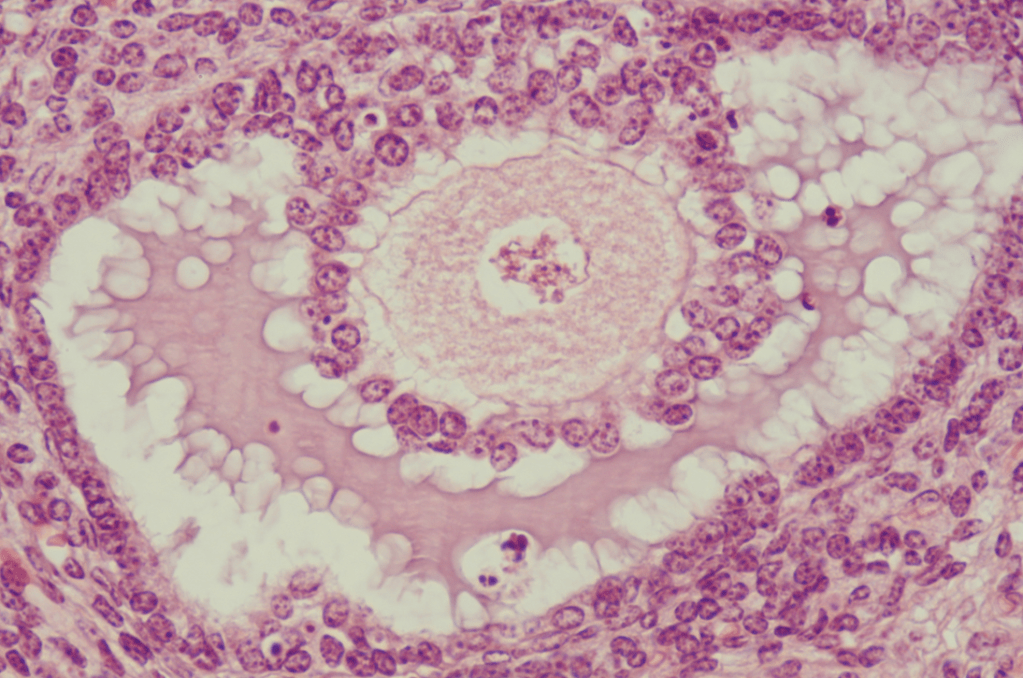
Une version commentée de cette photo est disponible en vidéo.
Le follicule en développement est un syncytium de cellules reliées par des canaux cytoplasmiques intercellulaires appelés jonctions communicantes ou jonction gap et cela inclut également l’ovocyte et les cellules qui l’entourent (Kidder et Mahwi, 2002; Wassarman, 2002).
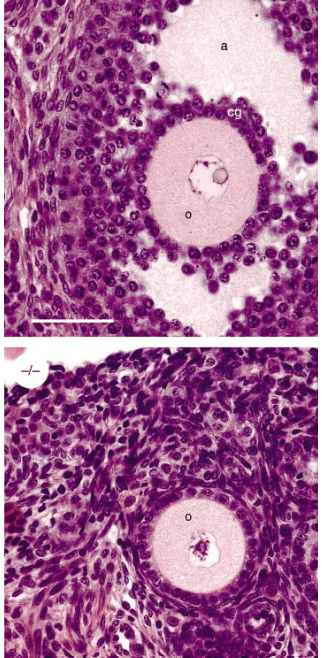
La communication entre l’ovocyte et les cellules folliculaires est bidirectionnelle ; les cellules folliculaires régulent la croissance des ovocytes et les ovocytes régulent le développement folliculaire. Des expériences de recombinaison d’ovocytes sortis de follicules âgés avec des follicules immatures ont montré que dans ce cas, les ovocytes sont capables d’accélérer la vitesse de maturation des follicules (Eppig et al., 2002).
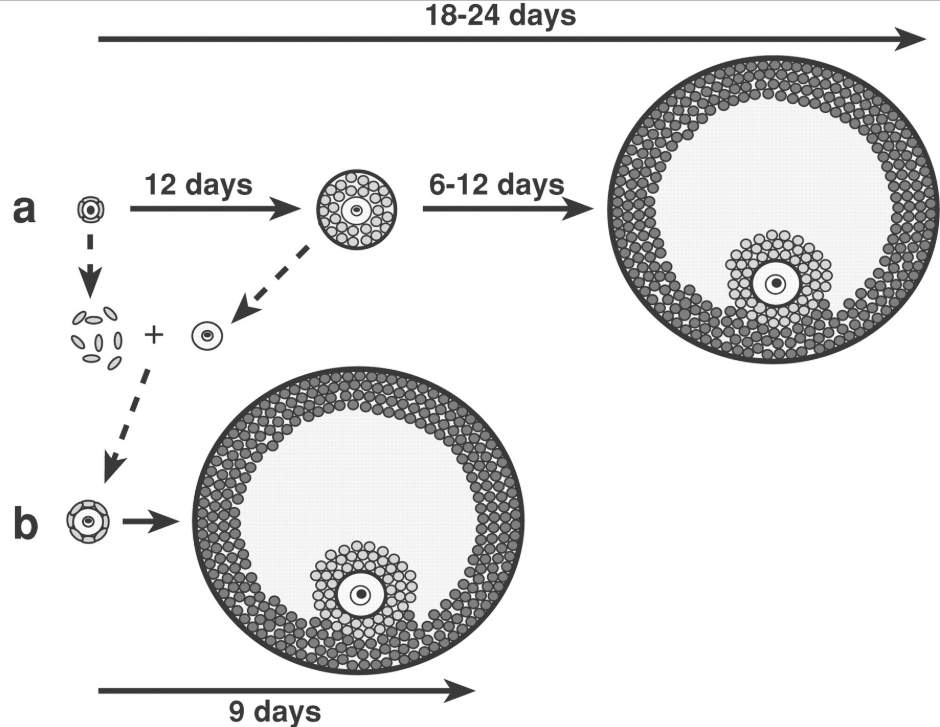
GDF-9 est une protéine secrétée par l’ovocyte de la famille des TGFβ et qui est nécessaire à la maturation des cellules de la granulosa et de la thèque (Otsuka et al., 2011). Des mutations gain-de-fonction dans le gène codant GDF-9 ont été découverts chez des familles qui produisent plus de (faux) jumeaux que la moyenne, indiquant qu’il favorise le développement des follicules jusqu’à provoquer des ovulations multiples (Palmer et al., 2006).
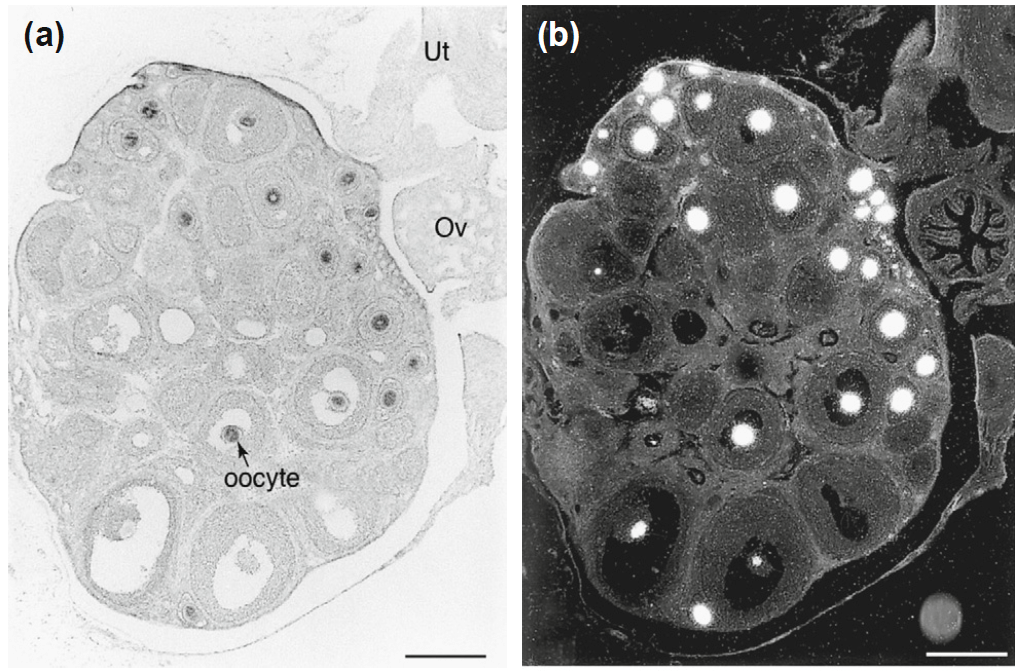
La réception du GDF-9 permet aux cellules de la granulosa de produire les protéines Desert Hedgehog (DHH) et Indian Hedgehog (IHH) après la naissance. Ces protéines de la famille Hedgehog activent le récepteur PTCH1 sur les précurseurs des cellules thécales, conduisant à l’expression de Gli1. La perturbation des voies DHH et IHH entraîne un échec de la différenciation des cellules thécales, une altération de la production d’hormones stéroïdes et un arrêt de la croissance folliculaire, avec seulement deux à trois couches de cellules de la granulosa (Liu et al., 2015).
Les follicules présentent un antre naissant lorsqu’ils ont plusieurs couches cellulaires d’épaisseur et, à mesure que l’antre se dilate, les ovocytes prennent une position acentrique entourés de deux ou plusieurs couches de cellules du cumulus oophorus. Les cellules du cumulus oophorus les plus proches de la zone pellucide en développement de l’ovocyte forment la corona radiata (et seront expulsées de l’ovaire avec l’ovocyte lors de l’ovulation).
A chaque cycle chez la femme, une cohorte de 5 à 10 follicules tertiaires de 5 mm de diamètre sont recrutés (ils ont commencé leur maturation 3 mois avant). Un seul appelé follicule dominant va complètement se développer (jusqu’à atteindre 22 mm de diamètre) et participer à l’ovulation. Il y a en effet une compétition entre les follicules pour les hormones qui stimulent leur développement. Les autres follicules dégénèrent.
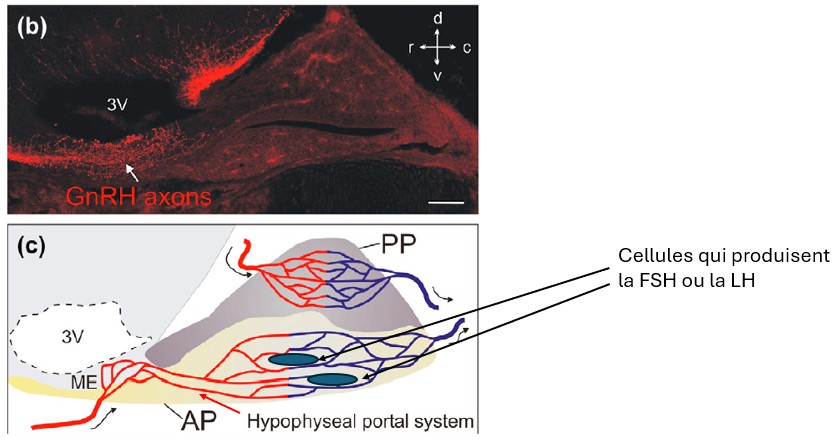
(b) Image en immunofluorescence montrant les axones des neurones à GnRH (en rouge) projetant vers l’éminence médiane (ME). 3V : troisième ventricule.
(c) Schéma illustrant le réseau vasculaire dans l’hypophyse. La GnRH libérée (de manière pulsatile) dans l’éminence médiane passe par le système porte hypophysaire, permettant d’atteindre et de stimuler les cellules gonadotropes de l’antéhypophyse ou adénohypophyse (AP) qui produisent la FSH (hormone folliculo-stimulante) et la LH (hormone lutéinisante). PP : hypophyse postérieure (neurohypophyse) qui n’intervient pas dans le contrôle des cycles ovariens (mais où se déverse l’ocytocine qui est importante pour la contraction des muscles lisses utérins lors de l’accouchement).
Le rétrocontrôle des oestrogènes sur la sécrétion de LH et de FSH passe en partie par un contrôle de la sécrétion de GnRH. Il ne se fait pas directement sur les neurones sécrétant du GnRH mais sur les neurones à kisspeptine dans l’hypothalamus. Ce sont des neurones qui ont pour cible les neurones produisant la GnRH (Skorupskaite et al., 2014).
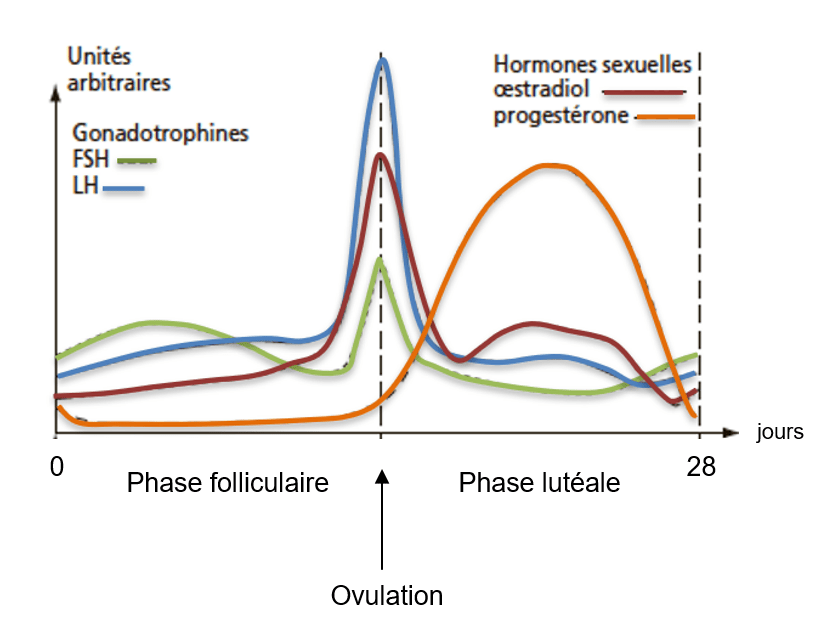
L’hormone lutéinisante (LH) produite dans l’adénohypophyse sous le contrôle de la GnRH secrétée par l’hypothalamus stimule la synthèse de la testostérone par les cellules de la thèque (c’est aussi la LH qui stimule la production de testostérone par les cellules de Leydig dans les testicules). De son côté, la FSH (également produite dans l’adénohypophyse) stimule la production d’aromatase dans les cellules de la granulosa, une enzyme qui convertit la testostérone en 17-estradiol (E2).
L’ovulation est déclenchée par un pic de concentration de LH produite par l’adénohypophyse : elle commence par une augmentation de la pression du liquide folliculaire (antral) dû à la sécrétion d’acide hyaluronique (HA) par les cellules du cumulus oophorus, ce qui crée un gradient osmotique. Puis il y a une contraction des muscles lisses de la thèque externe qui entourent le follicule, suivie de la lyse de la paroi du follicule par du plasminogène qui active des collagénases (étape initiée par la production locale de prostaglandines), à l’activité de la métalloprotéinase MMP2 et au dépôt de glycosaminoglycanes (GAG) entre les cellules de la corona radiata qui vont être expulsés avec l’ovocyte et les autres cellules folliculaires (qui restent dans l’ovaire et forment le corps jaune après l’ovulation) (Thomas et al., 2024).
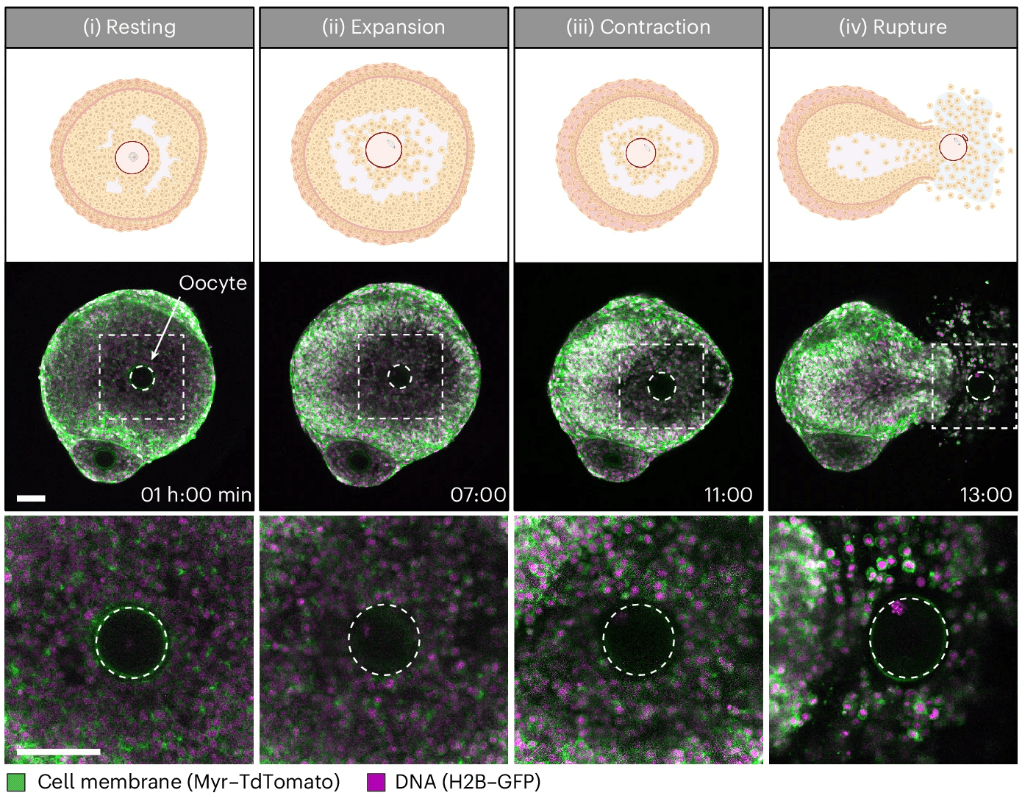
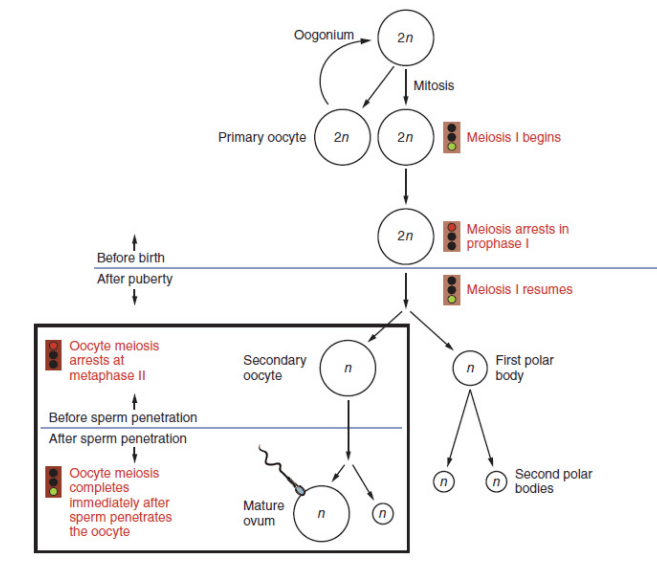
Des bouleversements importants ont lieu dans l’ovocyte lui-même : il y a une reprise de la méiose qui était bloquée en prophase I (quelques fois depuis des décennies chez la femme). Le premier signe de la reprise de la méiose est la désintégration de la membrane nucléaire (GVBD pour Germinal Vesicle Breakdown). A la fin de la méiose I, un premier globule polaire est émis. La méiose avance jusqu’en métaphase II où il y a un nouveau blocage.
Chez les Amphibiens, où la reprise de la méiose a été très étudiée comme un modèle de contrôle du cycle cellulaire c’est la progestérone qui a un rôle prépondérant (chez les Mammifères, c’est plutôt la LH). Le MPF (qui est le complexe constitué de CyclineB/Cdk1) est inactif lorsque la méiose est bloquée en prophase I et son activation est nécessaire pour que la méiose continue à progresser :
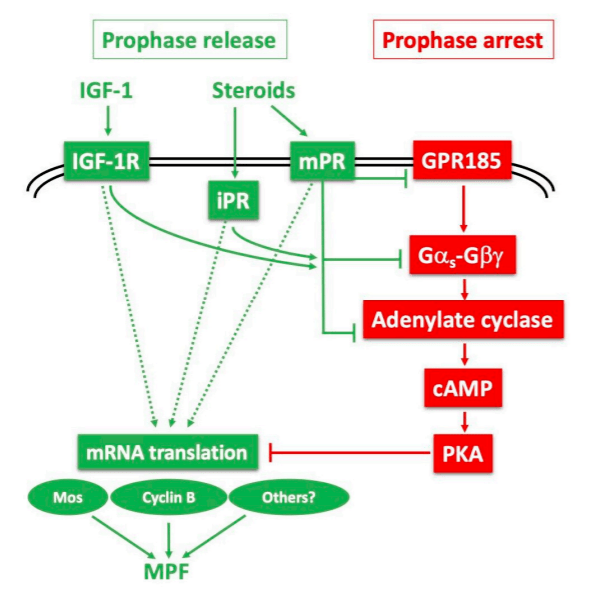
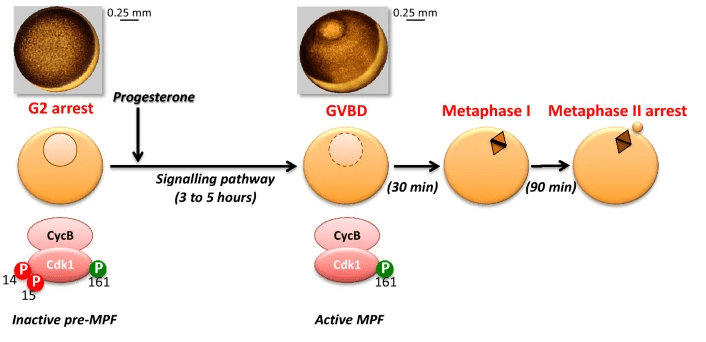
Les ovocytes sont ensuite à nouveau arrêtés en métaphase II (métaphase de la 2ème division de méiose) par la Cdk1 déphosphorylée et très active, jusqu’à la fécondation où la la fusion avec le spermatozoïde active une voie de signalisation impliquant l’entrée de Ca2+ dans le cytoplasme qui débloque la méiose et permet de la terminer (Nebreda et al., 2000).
Les cellules germinales où le contrôle du cycle cellulaire est altéré peuvent former des cellules tumorales qui donnent des tératomes : des tumeurs où des dérivés cellulaires variés se côtoient (contenant des poils, des dents, des bouts de cartilage, d’intestins, des cellules musculaires, des mélanocytes…). Cette caractéristique témoigne de la nature pluripotente (voire totipotente) des cellules germinales altérées. Elles sont plus fréquentes dans les ovaires que dans les testicules, et sont le plus souvent bénignes.
Spermatogenèse
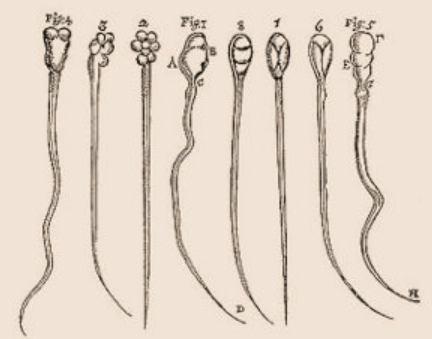
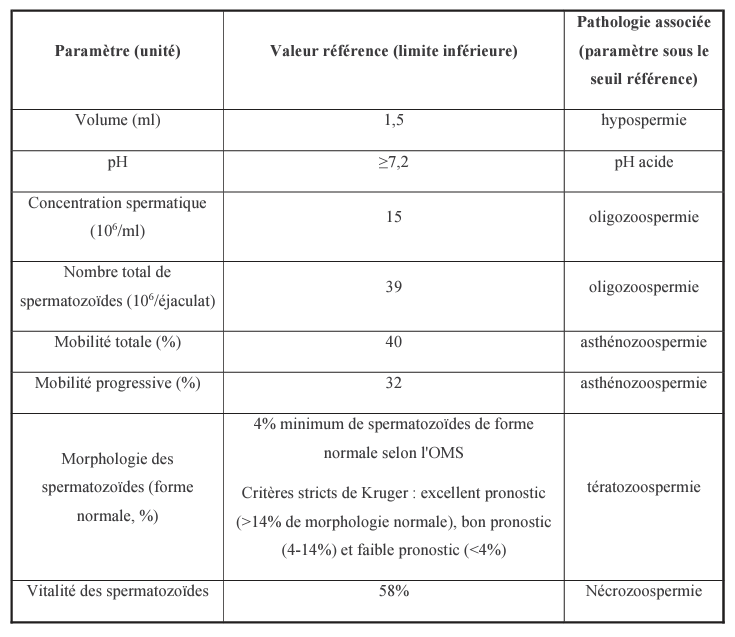
Une fertilité réussie nécessite une grande quantité de spermatozoïdes normaux. Afin de répondre à la norme de fertilité minimale, la concentration en spermatozoïdes doit être supérieure à 15 millions par ml de sperme, dont au moins 40 % doivent être de motilité normale et au moins 4 % avec une morphologie normale selon les critères pour l’examen en laboratoire du sperme humain paramètres de l’Organisation Mondiale pour la Santé (OMS, 2010).
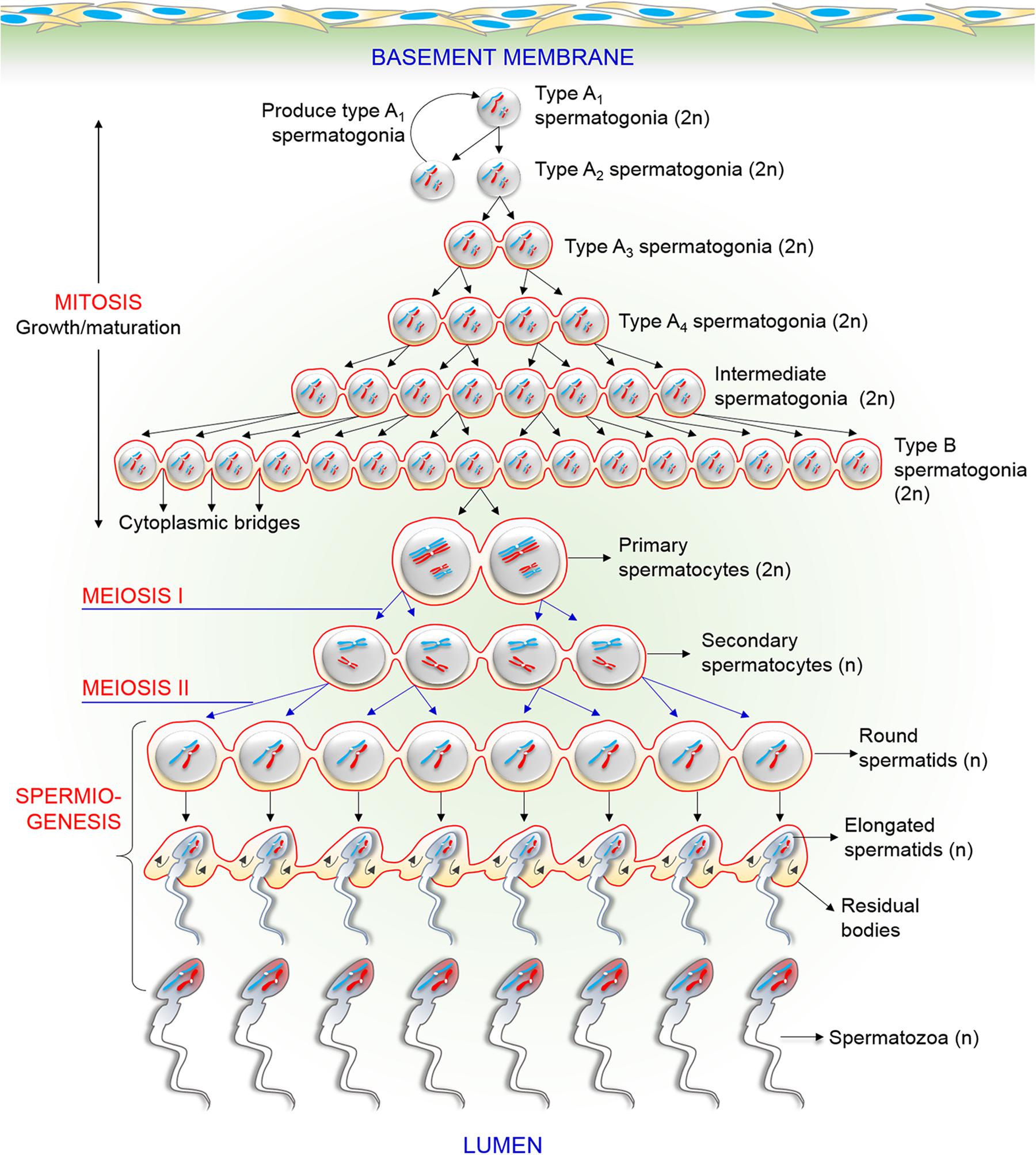
La génération de spermatozoïdes dépend d’un processus de différenciation cellulaire dans les tubules séminifères du testicule, appelé spermatogenèse (Griswold, 2016). Ce processus commence par l’auto-renouvellement et la différenciation des spermatogonies. L’auto-renouvellement et la différenciation de ces cellules doivent pouvoir s’équilibrer pour maintenir la population de cellules souches tout en formant des spermatozoïdes. Les caractéristiques de cellules souches des spermatogonies sont maintenues par le GDNF qui est produit par les cellules de Sertoli et par les cellules myoïdes péritubulaires (Meng et al., 2000). Dans les spermatogonies, le répresseur transcriptionnel Plzf (Costoya et al., 2014) et la protéine liant les ARN Nanos2 sont nécessaires à ce maintien. La perte de Nanos2 dans les spermatogonies aboutit à une perte de leur propriété de cellule souche et elles se différencient sur place de manière ectopique (Sada et al., 2009). Nanos2 agit notamment en réprimant la traduction de protéines qui déclenchent habituellement la méiose. Il se localise dans les corps P, un centre de dégradation des ARNm où il est associé avec des enzymes qui éliminent la queue polyA des ARNm, ce qui les amène à être dégradés (Saga, 2010).
Les cellules de Sertoli sont les cellules somatiques épithéliales de soutien des tubes séminifères, dont la principale fonction est d’assister et de nourrir les cellules germinales. Ce sont les premières cellules mâles spécifiques à se différencier dans la gonade fœtale et, conjointement avec les cellules germinales, elles subissent une morphogenèse tubulaire pour former des cordons testiculaires (Svingen et Coopman, 2013), qui sont les unités structurelles et fonctionnelles du testicule. Ces cordons donnent naissance ensuite aux tubules séminifères adultes. Au fur et à mesure que le testicule se développe, les cellules de Sertoli subissent des changements importants dans leur comportement cellulaire. Du stade fœtal jusqu’à environ 10 à 14 jours après la naissance chez les rongeurs, les cellules de Sertoli se divisent activement, augmentant le diamètre des tubes séminifères et le nombre de niches potentielles des spermatogonies dans les testicules (Oatley et al., 2011). À la fin de cette période, les cellules de Sertoli quittent le cycle cellulaire et restent au repos pour le restant de la vie. GATA1 est initialement exprimé dans les cellules de Sertoli postnatales immatures, puis à la maturation, son expression est augmentée uniquement dans un sous-ensemble de tubules séminifères d’une manière dépendante des stades spécifiques des cellules germinales dans le tubule (Yomogida et al., 1994). Le récepteur aux androgènes (AR), c’est à dire le récepteur de la testostérone (produite par les cellules de Leydig), est transféré du cytoplasme des cellules de Sertoli au noyau lors de la maturation (Sharpe et al., 2003).
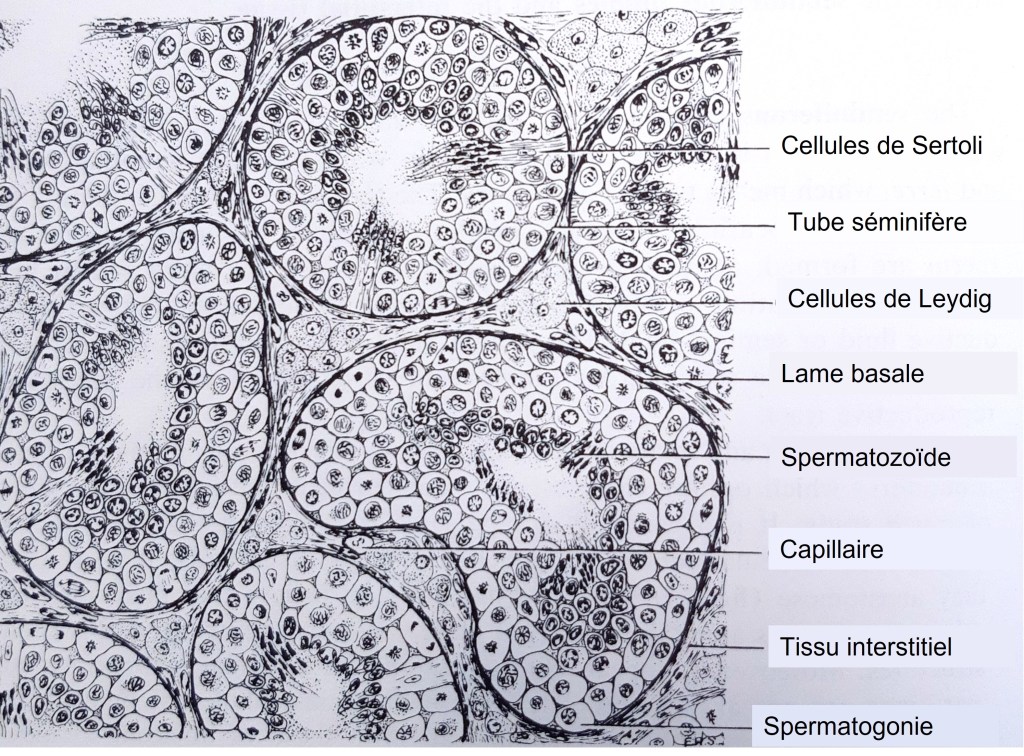
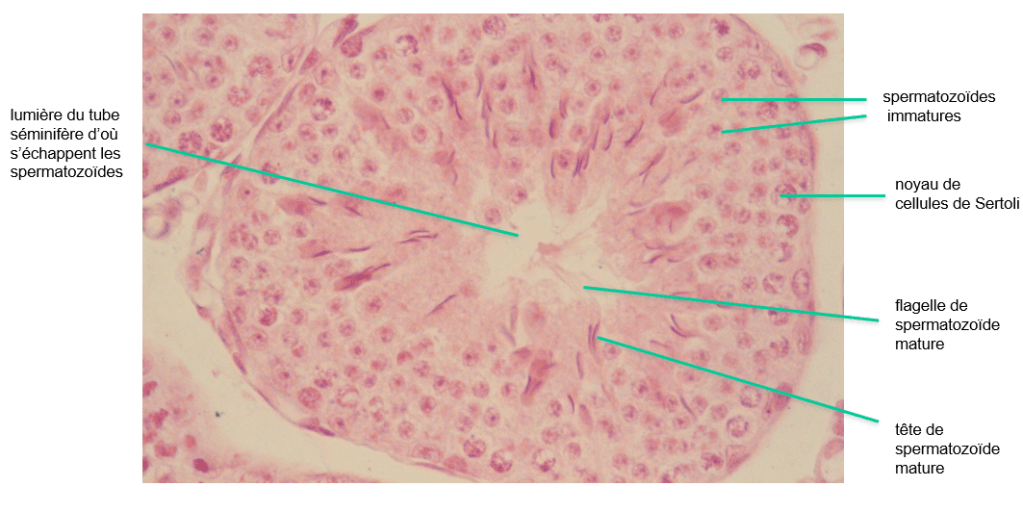
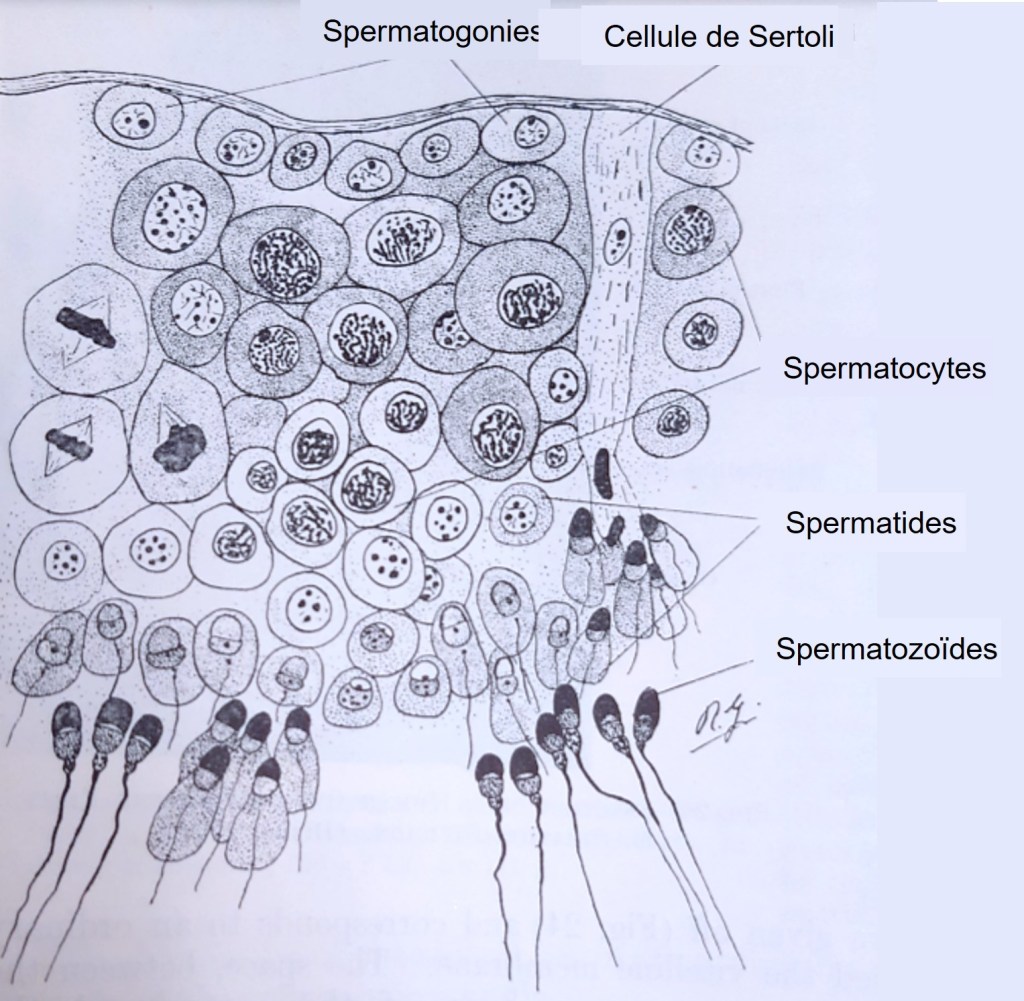
De leur côté, les spermatogonies prolifèrent et s’auto-renouvellent pour maintenir leur population, tandis qu’un sous-ensemble de ces cellules se transforment en progéniteurs spermatogoniaux indifférenciés amplificateurs transitoires (spermatogonies indifférenciées de type A2 à A4). Ces progéniteurs prolifèrent pour former des chaînes spermatogonales, puis procèdent à un programme de différenciation lancé en réponse à l’acide rétinoïque (RA) produit par les cellules de Sertoli. Les spermatogonies de type B qui en résultent initient ensuite la méiose et passent par plusieurs stades « spermatocytes ». Après la fin de la méiose, les stades spermatide ronds et spermatides allongés se succèdent avant de finalement devenir des spermatozoïdes différenciés (Griswold, 2016; Oatley et Brinster, 2012).
Au cours de toutes ces étapes, les cellules de Sertoli nourrissent les cellules germinales au fur et à mesure qu’elles prolifèrent et se différencient pour donner naissance aux spermatozoïdes. La polarisation des cellules de Sertoli est essentielle pour soutenir les différentes étapes de la spermatogénèse et pour compartimenter ses fonctions, notamment le maintien des cellules souches/progénitrices germinales dans le compartiment basal du tubule séminifère tout en favorisant simultanément la spermiogenèse dans le compartiment luminal apical (Oatley et Brinster, 2012). Ainsi, la fonction de la petite GTPase Cdc42 est nécessaire dans les cellules de Sertoli pour le maintien des caractères de cellules souches des spermatogonies (Heinrich et al., 2021). Cdc42 agit pour établir et maintenir la polarité des cellules de Sertoli et cette polarité est essentielle pour envoyer les bons signaux aux spermatogonies d’un côté (basal) et aux spermatides en cours de différenciation de l’autre côté (apical). Toute perte de polarité provoque un envoi de signaux incorrectement adressé qui aboutit à la perte des cellules souches.
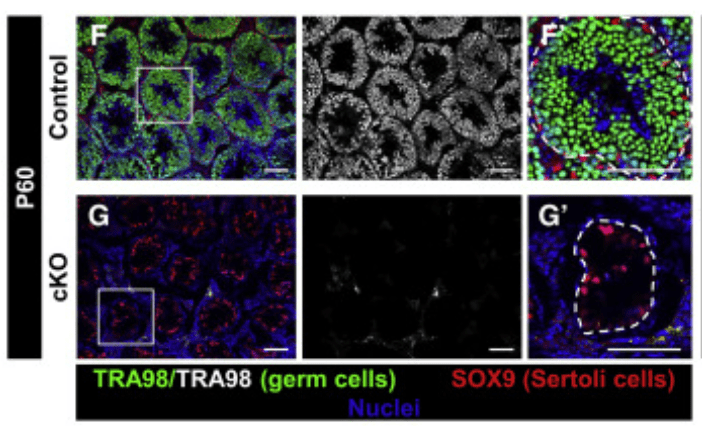
Les cellules de Sertoli sécrètent du GDNF que les spermatogonies reçoivent par leurs récepteurs RET et GFRα1. Cette signalisation paracrine inhibe la maturation des spermatogonies et permet de maintenir un pool de spermatogonies souches de type A1 (voir schéma précédent) (Meng et al., 2000). Les cellules myoïdes péritubulaires qui entourent les tubes séminifères et permettent leur contraction pour évacuer les spermatozoïdes produisent aussi du GDNF qui contribue au maintien de la niche des spermatogonies souches (Chen et al., 2016).
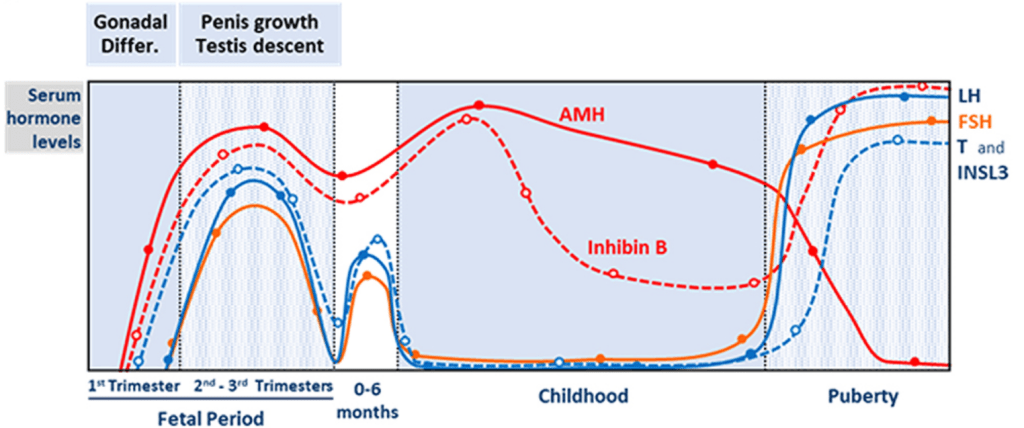
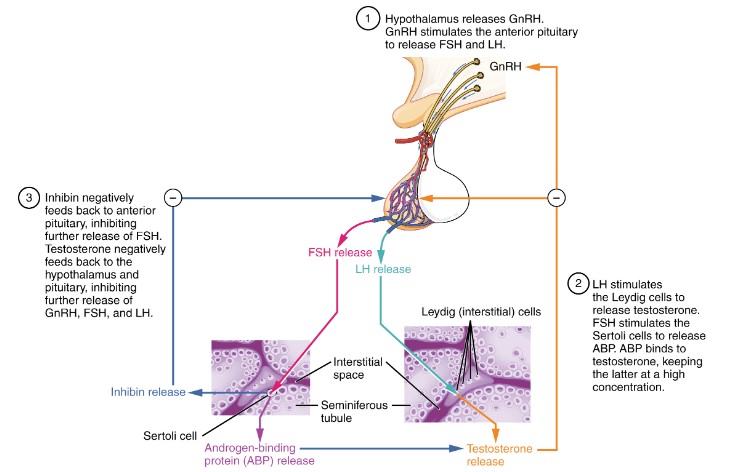
La spermatogenèse est bien entendu sous le contrôle d’hormones. Commençons par la FSH, une hormone produite dans l’adénohypophyse sous le contrôle de l’hypothalamus. Son récepteur est principalement exprimé sur les cellules de Sertoli (c’est un récepteur à 7 domaines transmembranaires couplé à une protéine G qui active l’adénylate cyclase et donc passe par l’AMPc comme second messager). La FSH contrôle la maturation, la prolifération et la fonction des cellules de Sertoli (Abel et al., 2008). Des mutations de la FSH ou de son récepteur ont été associées à une diminution du nombre de cellules de Sertoli et du nombre de spermatozoïdes (Tapanainen et al., 1997). Sous le contrôle de la FSH, les cellules de Sertoli sécrètent du GDNF qui est un facteur essentiel de maintien des spermatogonies (Meng et al., 2000; Kubota et al., 2004).
La LH est produite comme la FSH dans l’adénophypophyse. Son récepteur (un récepteur à 7 domaines transmembranaires couplé à une protéine G qui active l’adénylate cyclase et donc passe par l’AMPc comme second messager), est exprimé sur les cellules de Leydig et la fixation du ligand a pour effet de stimuler la production de testostérone (Narayan, 2015).
De manière plus surprenante, une hormone produite par les ostéoblastes (l’ostéocalcine, un peptide de 49 acides aminés) est aussi nécessaire pour une bonne production de testostérone par les cellules de Leydig (Oury et al., 2011). L’ostéocalcine se lie au récepteur GPRC6a et augmente la concentration d’AMPc dans les cellules de Leydig, ce qui stimule le facteur de transcription CREB qui augmente l’expression de plusieurs enzymes impliquées dans la synthèse de testostérone.
Les fonctions de la testostérone sont médiées par le récepteur aux androgènes (AR). Le récepteur aux androgènes est exprimé dans les cellules de Sertoli, les cellules de Leydig et le muscle lisse des artérioles des testicules, mais pas dans les cellules germinales (Smith et Walker, 2014). Les effets de la testostérone sur les cellules germinales est donc non cellulaire-autonome. La testostérone est cruciale pour le maintien du nombre de spermatogonies, l’intégrité de la barrière hémato-testiculaire, l’achèvement de la méiose, la maturation des spermatides et l’achèvement de la spermiation (O’Hara et Smith, 2015).
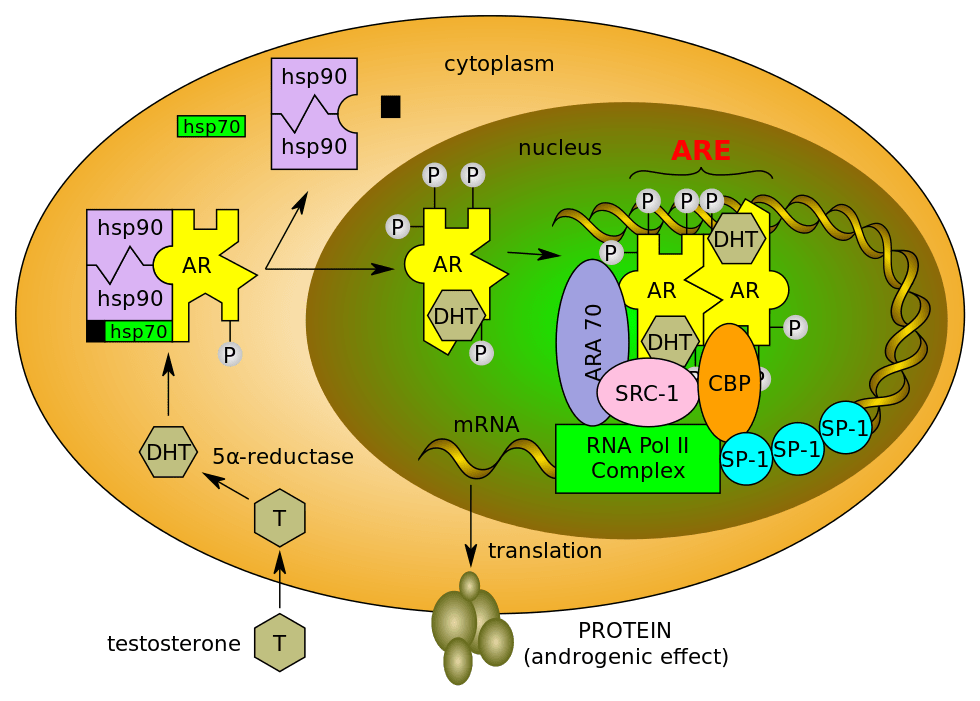
Il existe en réalité deux vagues de différenciation des cellules de Leydig qui produisent la testostérone : les cellules de Leydig fœtales (CLF) et les cellules de Leydig adultes (CLA) (DeFalco et al., 2011). Les CLF apparaissent pendant le développement testiculaire fœtal et régressent en grande partie après la naissance, et seule une petite fraction persiste à l’âge adulte (Shima et al., 2018). Les CLA se différencient à la puberté et sont responsables de l’augmentation puis du maintien de la production de testostérone tout au long de la vie adulte. Cependant, les CLA ont une capacité de prolifération ou de régénération limitée (Midzak et al., 2009). Cela rend la population de CL adultes susceptible de décliner ce qui peut contribuer à la baisse de la production de testostérone avec l’âge.
Contrairement à ce que l’on pourrait penser, la spermatogenèse a également besoin d’oestrogènes. L’enzyme aromatase qui convertit les androgènes en oestrogènes est exprimée dans les testicules et les oestrogènes sont essentiels pour de nombreuses fonctions, notamment la prolifération des spermatogonies, et la différenciation des spermatozoïdes via les récepteurs traditionnels ESR mais aussi via un récepteur membranaire couplé à une protéine G appelé GPER (Chimento et al., 2020).
L’activation de la méiose dans la lignée germinale mâle est sous le contrôle du ligand SCF (Stem Cell Factor) et de son récepteur tyrosine-kinase c-kit sur les spermatocytes primaires. Une entrée retardée en méiose est observée chez les souris haplodéficientes en c-kit et des études transcriptomiques ont montré que des spermatogonies isolées de testicules après une mise en présence de SCF activent l’expression de nombreux gènes impliqués dans les phases précoces de la méiose, notamment Dmc1 qui code une protéine impliquée dans les crossing-overs (Cardoso et al., 2014). Le niveau d’expression de Stra8 (qui déclenche aussi la méiose dans les ovocytes) augmente fortement.
Lors de la première division cellulaire méiotique, le spermatocyte primaire produit deux spermatocytes secondaires, qui entrent ensuite dans la deuxième division méiotique et se divisent en quatre spermatides rondes qui contiennent chacun soit un chromosome X ou un chromosome Y. Contrairement à l’ovogenèse, il n’y a pas de globules polaires et les 4 cellules issues de la méiose forment des gamètes.
Enfin, les spermatides rondes haploïdes se différencient en spermatides allongés et finalement en spermatozoïdes par le processus de spermiogenèse (Hendriksen, 1999). Pendant tout ce processus, les cellules migrent de la membrane basale vers le centre du tube séminifère et sont libérées dans la lumière. La cytokinèse n’est pas complète pendant les divisions mitotiques et méiotiques de ces processus (Hendriksen, 1999). En effet, maillage d’actomyosine du corps central est stabilisé pour bloquer l’abscission et maintenir l’anneau contractile de sorte que des canaux annulaires se forment entre les cellules connectées et les cellules sont reliées par des ponts intercellulaires qui persistent jusqu’à la fin de la spermatogenèse (Braun et al., 1989). Ce pont intercellulaire permet une libre communication cytoplasmique entre les cellules de génotypes différents. Étant donné que les ions et les molécules (dont des protéines) traversent facilement ces ponts intercellulaires, les cellules mûrissent de manière synchrone (Braun et al., 1989; Jasin et Zalamea, 1992).
La spermiogenèse représente une étape tardive de la spermatogenèse, au cours de laquelle les spermatides rondes post-méiotiques se différencient en spermatozoïdes matures par condensation de l’ADN et formation de la tête et de la queue des spermatozoïdes (O’Donnell, 2014). Une structure cytosquelettique transitoire appelée manchette apparaît parallèlement à l’élongation du noyau des spermatides. Elle est composée de réseaux parallèles de microtubules alignés avec le long axe du noyau et d’un anneau périnucléaire en forme de ceinture constitué d’actine. À mesure que les spermatides se différencient, la structure microtubulaire et l’anneau périnucléaire se déplacent vers le pôle postérieur du noyau des spermatides, « sculptant » le noyau en une morphologie en fuseau.
Les spermatozoïdes sont ensuite libérés dans la lumière des tubules séminifères, dans un processus appelé spermiation, qui implique le remodelage et la réduction du cytoplasme (França et al., 2016).
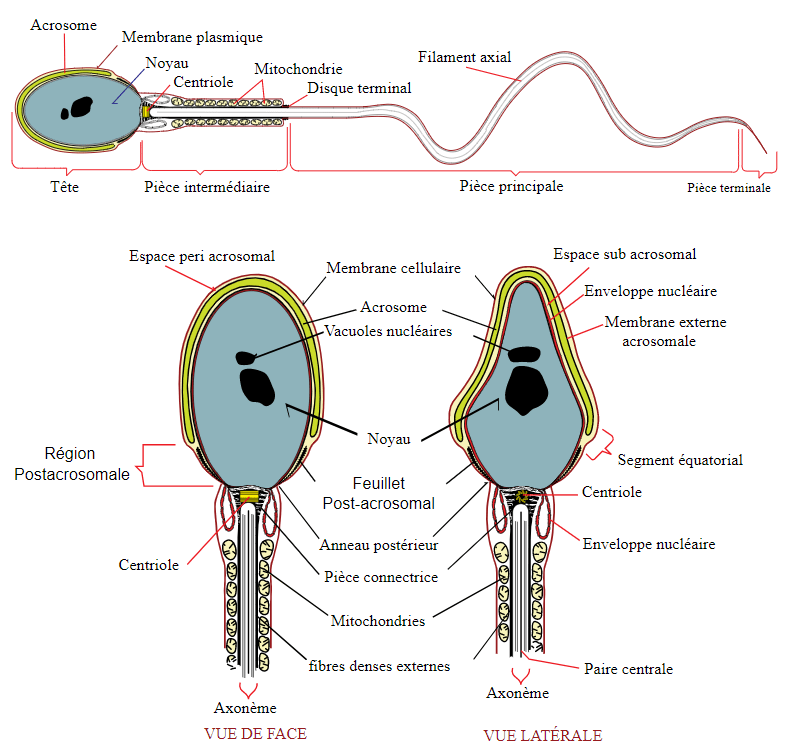
Durant la spermiogenèse, l’appareil de Golgi forme l’acrosome à l’avant du noyau. Le flagelle commence à croître à partir d’un centriole. Le noyau prend une forme aplatie et effilée et la chromatine se condense. Elle échange 90% de ses histones contre des protamines (chez la souris, même 95%) (Carrell, 2012). Riches en arginine et en cystéine, les protamines sont capables d’établir entre elles des ponts disulfures et contribuent ainsi à une forte condensation de la chromatine (la plus forte parmi les cellules eucaryotes). La transcription s’éteint complètement en conséquence. Les CTCF qui bornent les domaines TAD (les domaines topologiques d’association) restent présents et organisent la chromatine de manière similaire à celle des cellules souches pluripotentes (Balhorn, 2007; Hammoud et al., 2009; Jung et al., 2017).
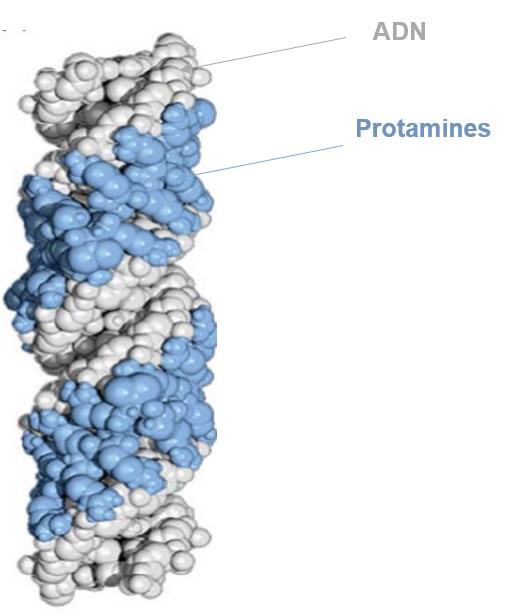
Certaines histones restent néanmoins en place à des positions « stratégiques » avec des modifications épigénétiques (méthylations, acétylations…) qui sont cruciales pour la régulation de la spermatogenèse et le début du développement embryonnaire (Luense et al., 2016; Lambrot et al., 2021).
Une partie du cytoplasme est éjecté sous la forme de corps résiduels qui sont phagocytés et éliminés par les cellules de Sertoli.
Toutes ces modifications permettent d’obtenir une cellule la plus « légère » et la plus mobile possible et également d’avoir un paysage chromatinien qui ressemble déjà à celui d’un embryon en développement précoce.
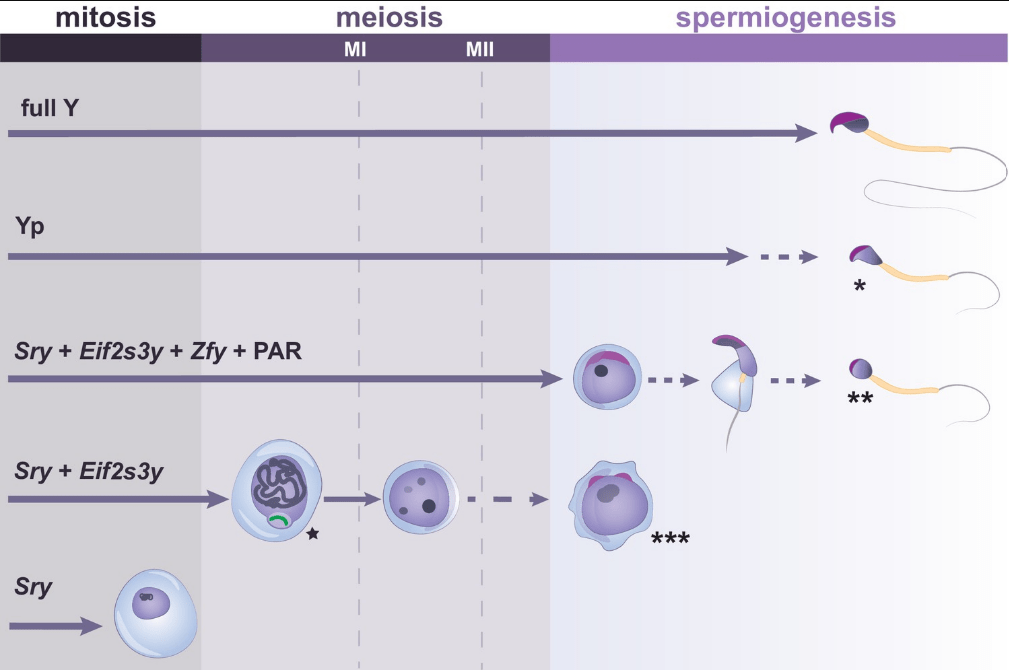
La présence du bras court Y (Yp) permet la formation de spermatozoïdes ayant des têtes anormales, présentant une courbure réduite et une faible compaction de la chromatine (indiquée par *). La présence des gènes Sry, Eif2s3y, Zfy et d’une région pseudo-autosomique (portion homologue à une portion du chromosome X) permet la progression vers le stade de spermatides rondes, mais l’élongation des spermatides est anormale et retardée, avec une production rare de spermatozoïdes à têtes mal structurées (indiquée par **). Les cellules germinales exprimant uniquement Sry et Eif2s3y ont une inhibition de la transcription incomplète à la méiose (indiqué par l’étoile à côté du chromosome X en vert). De plus, la plupart des cellules germinales de ce modèle s’arrêtent avant la deuxième division méiotique (MII), avec parfois une progression e pour former des spermatides principalement diploïdes et de forme ronde anormale (indiquée par ***). Lorsque seul Sry est exprimé, les spermatogonies ne parviennent pas à proliférer et à entrer en méiose. Les lignes fléchées montrent la progression des cellules germinales au cours de la spermatogenèse, les lignes pointillées indiquent une différenciation cellulaire anormale à faible fréquence. Source : https://elifesciences.org/articles/67345
Le système ubiquitine protéasome (UPS) joue un rôle important dans la spermatogenèse (Richburg et al., 2014). En effet, l’ubiquitination et la dégradation des protéines sont nécessaires lors de la différenciation finale des spermatozoïdes qui doivent se débarrasser de toutes les protéines qui avaient été nécessaires à leur développement mais qui ne sont plus utiles. La voie UPS dépend de manière critique des ligases d’ubiquitine E3, qui fournissent une spécificité de substrat en sélectionnant des protéines cibles pour l’ubiquitination (Metzger et al., 2014). RLIM, une E3 ubiquitine ligase joue un rôle important. Sans l’élimination des protéines qu’elle permet, une partie du cytoplasme ne peut être éliminée et les spermatozoïdes résultants sont peu mobiles.
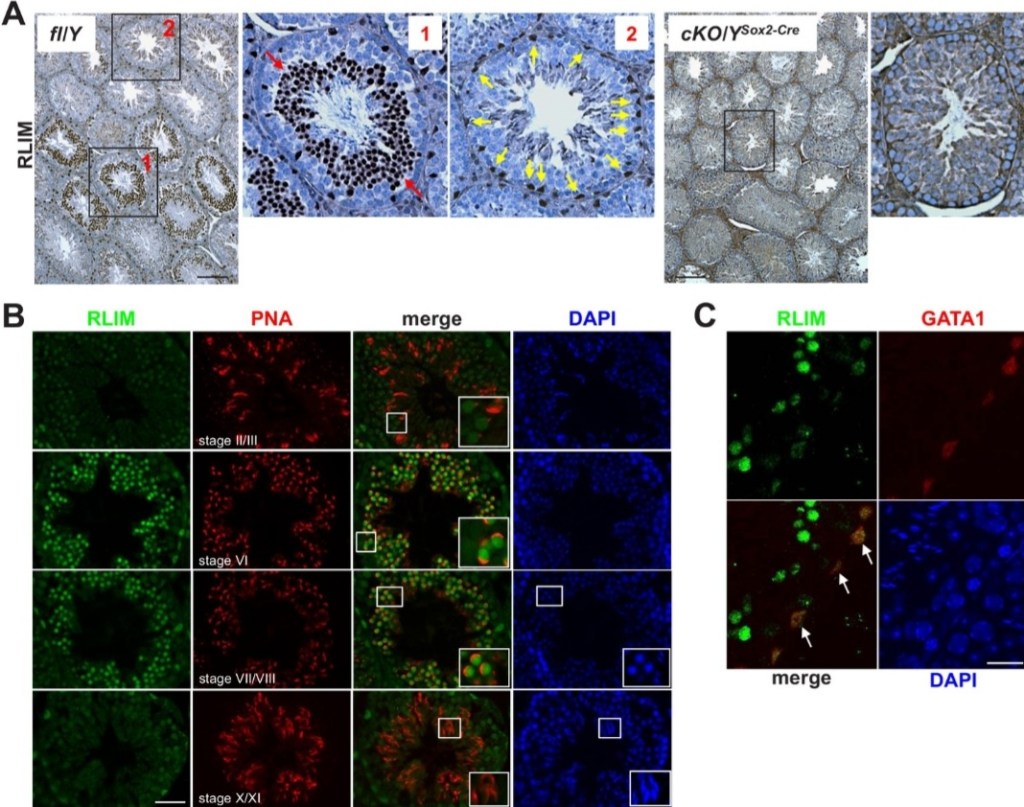
Le passage des spermatogonies à des spermatozoïdes matures prend 65 jours chez l’Homme (34,5 jours chez la souris). Les spermatozoïdes poursuivent ensuite leur maturation dans l’épididyme où ils passent quelques jours chez l’Homme (2 semaines chez la souris) (Cornwall, 2009). Notamment, les spermatozoïdes acquièrent des protéines nécessaires à leur motilité et aussi des ARN en fusionnant avec des vésicules extracellulaires appelées épididymosomes qui sont libérées de l’épithélium épididymaire (Sullivan, 2015, Sharma et al., 2018).
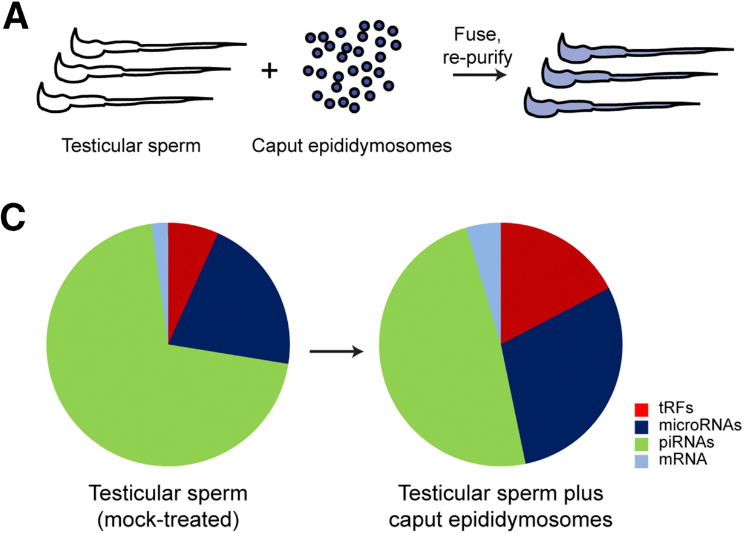
Notamment, les tRFs (fragments dérivés des ARN de transfert) sont très abondants dans les cellules épithéliales de l’épididyme et une partie de ces tRFs est transférée aux spermatozoïdes via les épididymosomes. La quantité des tRFs présents sont modulés par des facteurs environnementaux et peuvent influencer les phénotypes des descendants. Ainsi, des altérations du régime alimentaire (comme une alimentation riche en graisses, pauvre en protéines ou riche en sucres), le stress, l’inflammation, la déplétion du microbiote intestinal, le vieillissement, l’exposition à l’éthanol ou à différents agents toxiques (DDT, phtalates, méthotrexate, opioïdes) entraînent des modifications du profil des tRFs (Chen et al., 2016; Zhang et al., 2021). De plus, l’injection de tRFs extraits de spermatozoïdes exposés à ces facteurs ou de tRFs de synthèse sensibles à l’environnement dans des zygotes induit des modifications métaboliques chez la descendance (Sarker et al., 2019).
Le nombre de spermatozoïdes par éjaculat a diminué de moitié dans les pays occidentaux au cours des 40 dernières années. Les facteurs environnementaux ont été mis en cause. Les produits chimiques peuvent altérer les gamètes à différents stades de développement, c’est-à-dire à la spermatogenèse, lors de la maturation épididymaire et lors de la composition du sperme. Les produits chimiques peuvent être d’origine naturelle, comme les mycotoxines et les métaux, ou d’origine humaine, comme les produits pharmaceutiques et les pesticides. De nombreux produits chimiques fabriqués par l’homme sont considérés comme des perturbateurs endocriniens tels que les phtalates, les polychlorobiphényles (PCB) et le bisphénol A (BPA). Les effets indirects comprennent une stéroïdogenèse altérée et peuvent modifier les niveaux d’hormones, notamment de testostérone. Par ailleurs, les effets sur la reproduction peuvent être plus indirects et n’être révélés qu’à la génération suivante : l’exposition paternelle à certains produits chimiques environnementaux tels que le BPA et le DDT produit des effets épigénétiques sur l’embryon en développement (Komski-Elbaz et al., 2021).
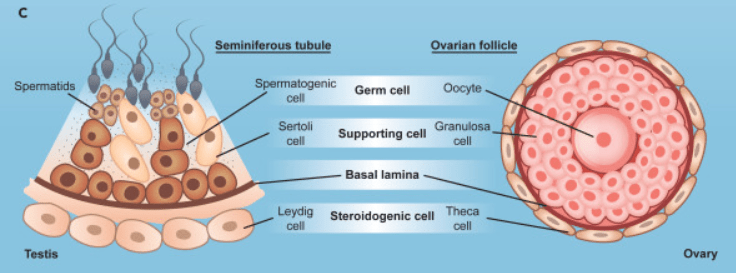
BILAN : Comparaison spermatogenèse/ovogenèse
EN DIRECT DES LABOS :
Décrypter le rôle de l’épigénétique dans la fertilité masculine (Institut Curie, Paris)
EQUIPES FRANCOPHONES TRAVAILLANT SUR LE SUJET :
Equipe « Différenciation gonadique et ses pertrubations » – INRAE Jouy-en-Josas
Equipe « Reproduction Humaine et Modèles Animaux » – INRAE Jouy-en-Josas
AUTRES RESSOURCES :
Le déterminisme du sexe chez les Mammifères – Institut Français de l’Education
La gamétogenèse chez l’Humain – Université de Berne
- Adhérences cellule-cellule
- Arabidopsis thaliana
- Axe antéro-postérieur chez la drosophile
- Biomécanique du développement
- Caenorhabditis elegans
- Concepts principaux
- Contrôle de la traduction
- Contrôle de la transcription
- Contrôle génétique et épigénétique
- Croissance du tube pollinique et double fécondation chez les Angiospermes
- Croissance et guidage axonal
- Des modèles animaux moins classiques
- Développement de l’oeil des Vertébrés
- Développement et évolution
- Et l’Humain ?
- Exercices sur l’ovogenèse, la spermatogenèse et la fécondation
- Exercices sur le contrôle de l’expression des gènes
- Exercices sur le développement des bourgeons de membre
- Exercices sur le développement des muscles striés squelettiques
- Exercices sur le développement des végétaux et les hormones végétales
- Exercices sur les cycles et les divisions cellulaires
- Exercices sur les étapes du développement, les inductions embryonnaires et la mise en place des axes de polarité
- Exercices sur les matrices extracellulaires, le cytosquelette et les adhérences cellule-cellule
- Exercices sur les voies de signalisation
- Glossaire
- Glossaire des termes liés à la génétique
- Glossaire des termes liés au cytosquelette, la matrice extracellulaire, l’adhérence et la migration cellulaire
- Hématopoïèse et développement des cellules du système immunitaire
- Histoire de la biologie cellulaire et de la biologie du développement
- L’acide rétinoïque
- L’apoptose
- L’autophagie
- L’organogenèse
- L’ovogénèse prépare le développement embryonnaire
- La drosophile
- La fécondation
- La formation des somites
- La gastrulation
- La gastrulation (version allégée)
- La métamorphose chez les Hexapodes et les Amphibiens
- La neurogénèse chez les mammifères adultes
- La neurulation
- La poule
- La signalisation calcique
- La souris
- La superfamille TGFβ et ses voies de signalisation
- La voie de signalisation de l’auxine et ses rôles
- La voie de signalisation Hedgehog
- La voie de signalisation Hippo et ses composants YAP/TAZ
- La voie de signalisation Notch
- Le clivage
- Le cytosquelette
- Le destin des cellules et les réseaux de régulation génique
- Le développement des bourgeons de membre
- Le développement des muscles striés squelettiques
- Le développement du cortex
- Le méristème apical caulinaire en phase végétative et lors de la formation d’une fleur
- Le poisson zèbre
- Le xénope
- Les cellules des crêtes neurales
- Les cellules et les gènes en action dans le développement
- Les cellules souches
- Les cellules tumorales
- Les cycles et les divisions cellulaires
- Les étapes du développement
- Les étapes du développement embryonnaire d’Arabidopsis thaliana et leur contrôle
- Les inductions embryonnaires et les gradients de morphogène
- Les matrices extracellulaires animales
- Les organismes modèles
- Les outils pour étudier l’expression et la fonction des gènes
- Les parois des cellules végétales
- Les techniques et les outils pour la biologie cellulaire
- Les transitions épithélio-mésenchymateuses et les migrations cellulaires
- Les vésicules extracellulaires
- Les voies de signalisation
- Les voies de signalisation FGF
- Mise en place des axes chez les Vertébrés
- Structures et processus cellulaires
- Voies de signalisation WNT
