La régénération des bourgeons de membre
Les Amphibiens Urodèles et tout particulièrement les salamandres et les axolotls ont d’excellentes capacités de régénération des membres et sont devenus des organismes modèles. La régénération implique non seulement le remplacement des tissus excisés (avec notamment une bonne régionalisation proximo-distale) mais aussi une bonne intégration avec les tissus restants.
Les membres d’axolotl sont composés de nombreux types de cellules différentes provenant de lignées neurales, myogéniques, épidermiques et de tissu conjonctif. Lors de l’amputation d’un membre, les cellules situées à proximité du plan d’amputation (jusqu’à 1 mm de profondeur) s’accumulent dans un tissu distinctif appelé blastème, qui sert de source de cellules progénitrices pour construire le nouveau membre. Par ailleurs, les éléments du squelette proches de la blessure sont dégradés par des ostéoclastes, ce qui permet d’avoir une pièce squelettique entièrement « rénovée » par la suite (Riquelme-Guzman et al., 2022).
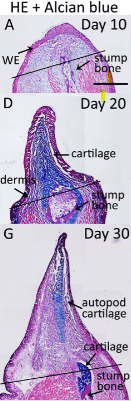
La source des cellules du blastème est locale. Si, par une irradiation aux rayons X, on détruit les cellules juste derrière la cicatrice, le membre ne régénère pas alors qu’il régénère si on irradie des cellules plus éloignées.
Une fois le blastème mis en place, ses cellules prolifèrent puis elles se différencient selon une séquence proximo-distale pour redonner les structures manquantes.
Le manchon épidermique qui recouvre le blastème produit du FGF qui est essentiel pour la prolifération des cellules du blastème, ce qui rappelle les fonctions de l’AER avec le mésenchyme sous-jacent durant le développement normal. On retrouve également l’expression de Shh dans la région postérieure. Les gènes Hox sont aussi activés précocement avec Hoxa9 et Hoxa13 exprimés dans tout le blastème puis progressivement l’expression caractéristique « en nid » des gènes Hox se met en place comme lors du développement normal.
Les souches d’axolotl transgéniques dans lesquelles les descendants de types cellulaires adultes distincts peuvent être marqués, suivis et isolés au cours du processus de régénération permettent de comprendre comment des lignées cellulaires particulières se développent pendant la formation du blastème et la régénération ultérieure des membres. La combinaison de ces souches d’axolotl transgéniques avec le séquençage d’ARN en cellules isolées (scRNA-seq) permet le suivi de types cellulaires individuels, ainsi que la reconstruction des étapes moléculaires (Gerber et al., 2018). Les cellules du tissu conjonctif, descendantes du mésoderme des lames latérales, sont la lignée la plus abondante contribuant au blastème (40% environ) et régénèrent les os et le cartilage, les tendons, le périsquelette et les fibroblastes dermiques et interstitiels. Les restrictions de lignage sont plus marquées pour les autres cas : les nouvelles cellules musculaires proviennent seulement de cellules musculaires, les nouvelles cellules de Schwann proviennent uniquement des cellules de Schwann et ainsi de suite.
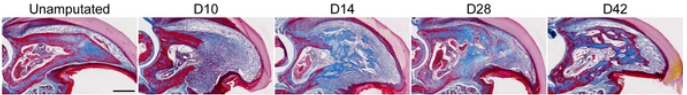
Chez les mammifères, les capacités de régénération sont très modestes comparées à l’axolotl et limitées au tiers distal du troisième segment phalangien (l’élément terminal). Cette réponse régénérative est spécifique du niveau d’amputation : l’amputation du tiers distal du segment phalangien terminal peut se régénérer, alors qu’une amputation du segment phalangien moyen forme seulement un cal hypertrophique de l’os (Han et al., 2008).
Aspects Evo/Dévo
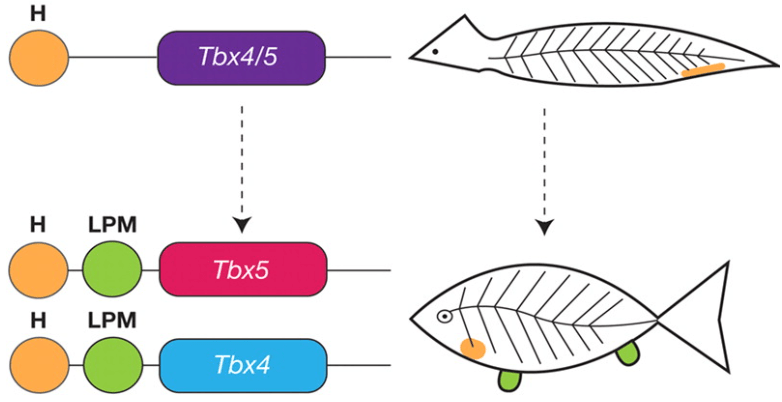
Le développement de nageoires latérales ou de membres chiridiens chez les Vertébrés utilise une cascade de régulation génétique dont certains éléments sont présents chez les Cordés non-Vertébrés qui ne forment pourtant pas de nageoires latérales ou de membres. Par exemple, le gène Tbx4/5 du Céphalocordé Amphioxus est capable de sauver le développement du bourgeon de membre antérieur d’une souris Tbx5-/- (Minguillon et al., 2009). Le gène Tbx4/5 ne s’exprime cependant pas dans le flanc de l’Amphioxus (mais dans le coeur). On pense que le gène Tbx4/5 ancestral des Cordés s’est dupliqué chez les Vertébrés en Tbx4 et Tbx5 et que l’expression de ces gènes a été modifiée au cours de l’évolution ce qui a permis leur expression régionalisée dans le flanc, permettant aux nageoires paires et aux membres chiridiens de se développer.
La transition nageoire-membre est une étude de cas classique de l’évolution morphologique. Cette évolution a eu lieu au Dévonien parmi un groupe de Sarcoptérygiens (qui ont des muscles dans leurs nageoires paires contrairement au Actinoptérygiens) à partir des nageoires paires (pectorales pour les membres antérieurs et pelviennes pour les membres postérieurs). Les membres de Tétrapodes ont d’abord évolué dans des organismes exclusivement aquatiques et ce n’est qu’après qu’ils ont permis la sortie de l’eau par exaptation.
Les gènes du développement des nageoires paires du dipneuste (des Sarcoptérygiens très proches des Tétrapodes) ont fait récemment l’objet d’une étude poussée. 330 enhancers ou éléments de régulations transcriptionnels ont été comparés dans les génomes d’Actinoptérygiens, du Dipneuste et de Tétrapodes. Il en découle que 113 de ces enhancers sont présents chez les Actinoptérygiens, 31 de plus sont présents chez les Sarcoptérygiens et 9 de plus sont présents chez les Tétrapodes.
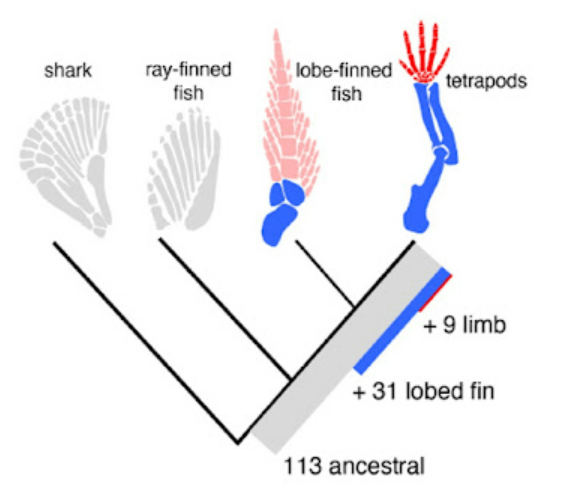
On en déduit que l’essentiel du réseau de régulation génique des membres chiridiens est déjà présent chez les Sarcoptérygiens et que la formation des membres chiridiens n’a tenu qu’à l’ajout de 9 enhancers (et à des modifications chez quelques autres enhancers). C’est une vision sans doute réductionniste mais cela confirme la profondeur évolutive du réseau génétique qui façonne les membres chiridiens des Tétrapodes.
Nous avons vu que les membres des Tétrapodes sont composés de trois modules : le stylopode, le zeugopode et l’autopode, qui sont ordonnés de manière proximale à distale. En revanche, les nageoires de poisson sont souvent subdivisées en différents modules anatomiques le long de l’axe antéro-postérieur : le propterygium, le mesopterygium et le métaptérygium. L’autopode (poignet et doigts) semble être la nouveauté morphologique la plus apparente au cours de la transition nageoire-membre (Clack, 2009), bien que cette différence ait été exagérée par le passé en se concentrant sur le poisson-zèbre, un organisme modèle qui a des nageoires assez modifiées par rapport à la situation ancestrale. Plusieurs études ont en effet révélé que la régulation spécifique de Hoxa13 et Hoxd10-13, qui contrôlent la formation des autopodes, est également conservée chez les vertébrés non tétrapodes (Tanaka et al., 2016; Freitas et al., 2007; Gehrke et al. 2014), sauf que les domaines d’expression de Hoxa13 et Hoxa11 s’excluent mutuellement dans les membres de souris et de poulet tout en se chevauchant dans les bourgeons de nageoires de poisson examinés.
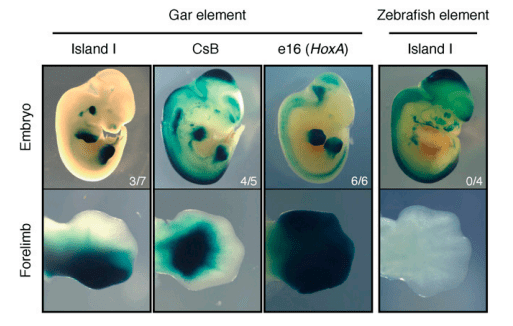
Bien que plusieurs différences de régulation des gènes aient été proposées pour expliquer la différence anatomique entre les nageoires et les membres, ces propositions ont été exclusivement axées sur les gènes Hox (Kherdjemil et al., 2016; Nakamura et al., 2016; Sheth et al., 2012) et il y a sans doute beaucoup de choses intéressantes à découvrir avec l’étude des autres gènes impliqués.
Signalons qu’une transition membre chiridien-nageoire (donc inverse de celle qui a eu lieu au Dévonien) a eu lieu lors de l’évolution des Cétacés pour le membre antérieur il y a enviro, 50 millions d’années. Cela s’est accompagné par un prolongement du fonctionnement de l’AER (et de la sécrétion des FGF) ce qui a permis de générer une structure plus longue, notamment de longues phalanges qui sont les principales structures portantes des nageoires antérieures des Cétacés. L’apoptose interdigitale a été bloquée en inhibant l’action des BMP par Gremlin (comme dans la patte postérieure de canard) (Cooper et al., 2004). Dans la patte postérieure des Cétacés qui a régressé et est devenu un organe vestigial, l’activité de la ZPA s’éteint très tôt ce qui provoque l’arrêt du fonctionnement de l’AER et l’arrêt prématuré du développement du membre (Thewissen et al., 2006).
POUR EN SAVOIR PLUS :
VOIR LES EXERCICES SUR LE DEVELOPPEMENT DES BOURGEONS DE MEMBRES
QUELQUES LABOS FRANCOPHONES TRAVAILLANT SUR LE SUJET :
Equipe « Génomique du développement » – Université de Genève
Equipe « Formation et réparation des muscles et des tendons » – Institut de Biologie Paris-Seine
- Adhérences cellule-cellule
- Arabidopsis thaliana
- Axe antéro-postérieur chez la drosophile
- Biomécanique du développement
- Caenorhabditis elegans
- Concepts principaux
- Contrôle de la traduction
- Contrôle de la transcription
- Contrôle génétique et épigénétique
- Croissance du tube pollinique et double fécondation chez les Angiospermes
- Croissance et guidage axonal
- Des modèles animaux moins classiques
- Développement de l’oeil des Vertébrés
- Développement et évolution
- Et l’Humain ?
- Exercices sur l’ovogenèse, la spermatogenèse et la fécondation
- Exercices sur le contrôle de l’expression des gènes
- Exercices sur le développement des bourgeons de membre
- Exercices sur le développement des muscles striés squelettiques
- Exercices sur le développement des végétaux et les hormones végétales
- Exercices sur les cycles et les divisions cellulaires
- Exercices sur les étapes du développement, les inductions embryonnaires et la mise en place des axes de polarité
- Exercices sur les matrices extracellulaires, le cytosquelette et les adhérences cellule-cellule
- Exercices sur les voies de signalisation
- Glossaire
- Glossaire des termes liés à la génétique
- Glossaire des termes liés au cytosquelette, la matrice extracellulaire, l’adhérence et la migration cellulaire
- Hématopoïèse et développement des cellules du système immunitaire
- Histoire de la biologie cellulaire et de la biologie du développement
- L’acide rétinoïque
- L’apoptose
- L’autophagie
- L’organogenèse
- L’ovogénèse prépare le développement embryonnaire
- La drosophile
- La fécondation
- La formation des somites
- La gastrulation
- La gastrulation (version allégée)
- La métamorphose chez les Hexapodes et les Amphibiens
- La neurogénèse chez les mammifères adultes
- La neurulation
- La poule
- La signalisation calcique
- La souris
- La superfamille TGFβ et ses voies de signalisation
- La voie de signalisation de l’auxine et ses rôles
- La voie de signalisation Hedgehog
- La voie de signalisation Hippo et ses composants YAP/TAZ
- La voie de signalisation Notch
- Le clivage
- Le cytosquelette
- Le destin des cellules et les réseaux de régulation génique
- Le développement des muscles striés squelettiques
- Le développement des organes génitaux et des cellules germinales
- Le développement du cortex
- Le méristème apical caulinaire en phase végétative et lors de la formation d’une fleur
- Le poisson zèbre
- Le xénope
- Les cellules des crêtes neurales
- Les cellules et les gènes en action dans le développement
- Les cellules souches
- Les cellules tumorales
- Les cycles et les divisions cellulaires
- Les étapes du développement
- Les étapes du développement embryonnaire d’Arabidopsis thaliana et leur contrôle
- Les inductions embryonnaires et les gradients de morphogène
- Les matrices extracellulaires animales
- Les organismes modèles
- Les outils pour étudier l’expression et la fonction des gènes
- Les parois des cellules végétales
- Les techniques et les outils pour la biologie cellulaire
- Les transitions épithélio-mésenchymateuses et les migrations cellulaires
- Les vésicules extracellulaires
- Les voies de signalisation
- Les voies de signalisation FGF
- Mise en place des axes chez les Vertébrés
- Structures et processus cellulaires
- Voies de signalisation WNT
