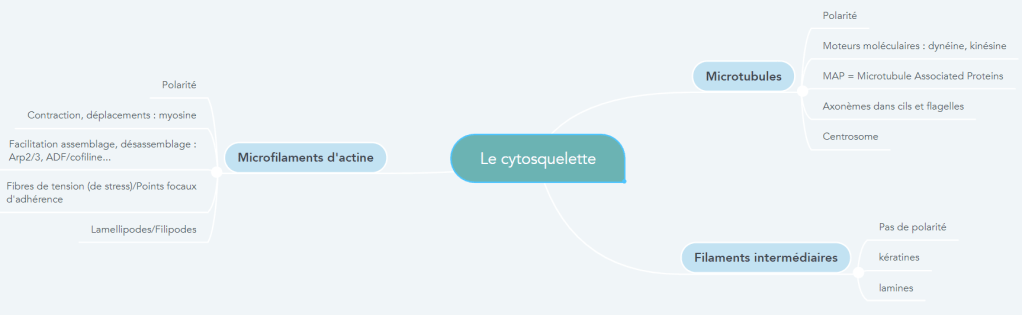
Les filaments intermédiaires
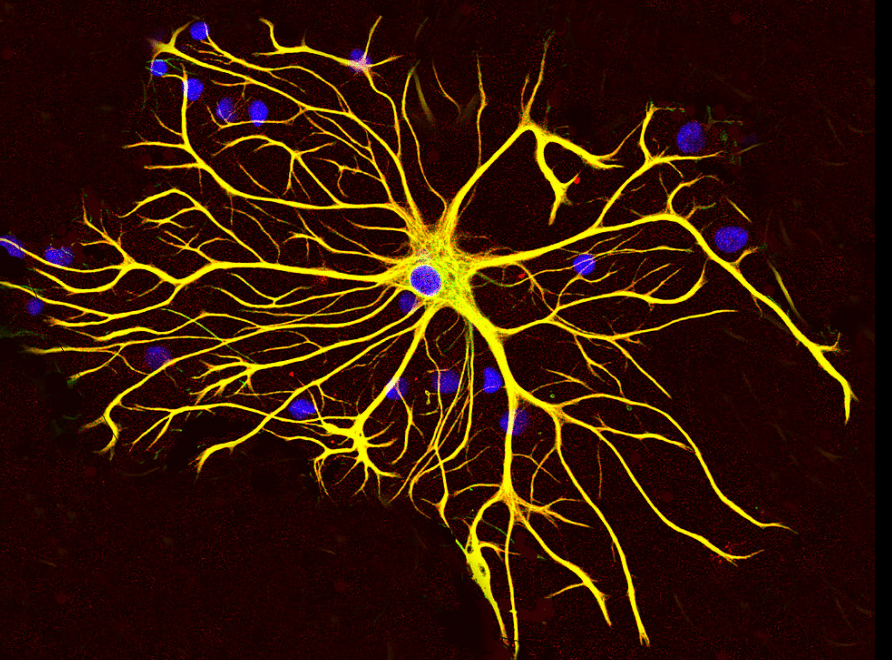
Contrairement aux microfilaments et aux microtubules, les filaments intermédiaires ne sont pas polarisés. Ils font 10 nm de diamètre, donc ils sont d’une taille intermédiaire par rapport aux microfilaments d’actine (qui sont plus petits) et aux microtubules (qui sont plus gros). Le rôle de ces filaments est essentiellement structural : maintien de la forme des cellules et contrôle de leur résistance aux contraintes mécaniques. Chez les plantes, ces rôles sont tenus par la paroi et il n’y a pas de filaments intermédiaires connus.
Chez les animaux, des rôles supplémentaires pour les filaments intermédiaires émergent comme par exemple pour la vimentine qui a un rôle dans la migration et la prolifération cellulaire. C’est un marqueur classique d’état mésenchymateux dans des études sur les transitions épithélio-mésenchymateuses.
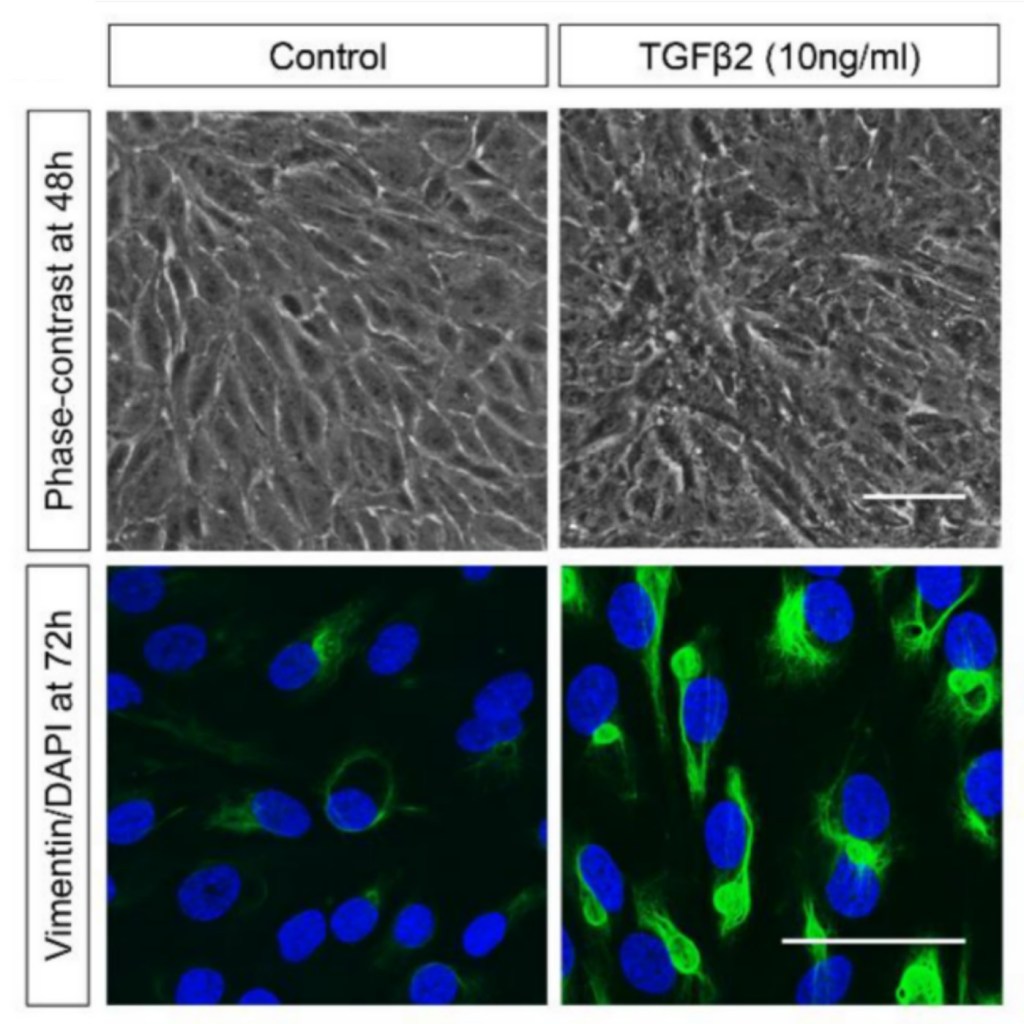
Des souris déficientes en vimentine présentent des défauts de cicatrisation de blessure dus à un manque de migration et de prolifération (Cheng et al., 2016). Les filaments de vimentine peuvent interagir avec les microtubules et sont nécessaires pour le maintien de la polarité lors de la migration (Gan et al., 2016), notamment dans les cellules tumorales (Xuan et al., 2020). Un rôle moins classique de la vimentine est de stabiliser des ARNm codant des sous-unités du collagène en s’associant à la région 5′ de ces ARNm dans un complexe avec la protéine LARP6 (Challa et Stefanovic, 2011).
De nombreux filaments intermédiaires sont attachés via un complexe aux desmosomes et aussi aux hémidesmosomes qui relient les cellules épithéliales à la lame basale (voir plus loin).
La kératine forme un filament intermédiaire en s’enroulant en hélice autour d’autres kératines. Sa séquence contient beaucoup d’acides aminés soufrés ce qui permet de former beaucoup de ponts disulfures et lui confère sa rigidité. Elle est produite en grande quantité dans les kératinocytes qui sont les cellules constituant l’épiderme de la peau et la cornée. Il existe une très grande variété de sous-types de kératine (codés par 54 gènes chez l’Homme) (Moll et al., 2008).
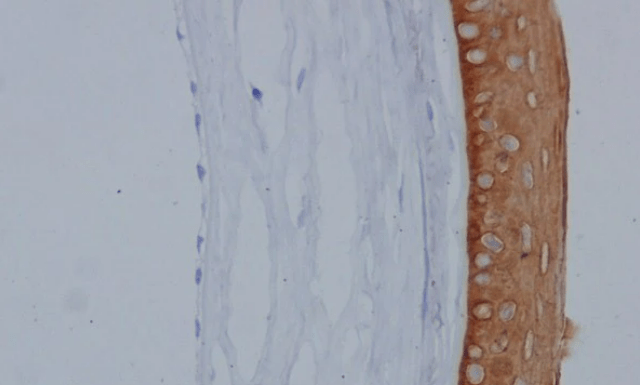
La kératine 15 est spécifiquement exprimée dans les cellules souches de l’épiderme (Lyle et al., 1998).
Certaines kératines sont attachées aux hémidesmosomes qui sont des structures à la base des cellules épithéliales qui les accrochent fermement à la lame basale.
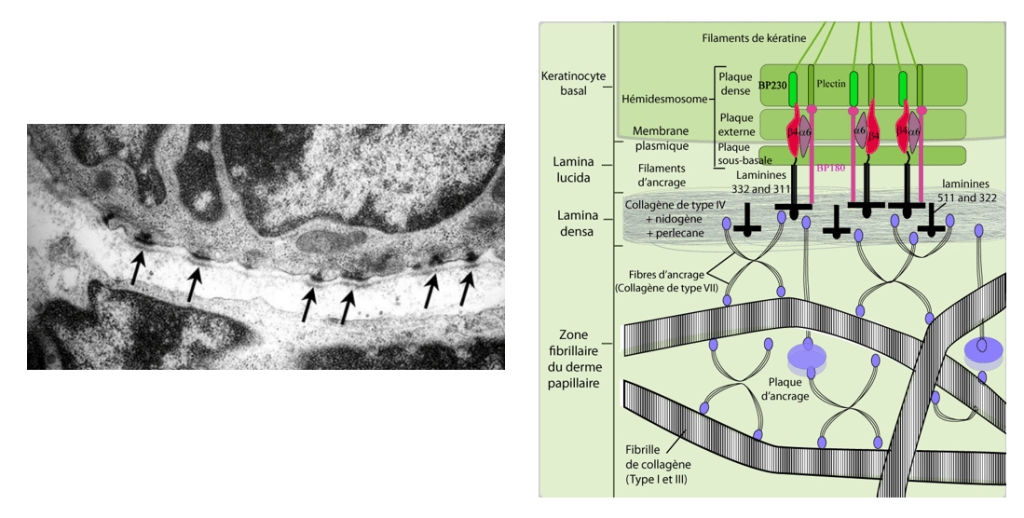
File:Ultrastructure_of_tracheal_hemidesmosomes_in_mice.JPEG et http://biologiedelapeau.fr/spip.php?page=forum&id_article=47
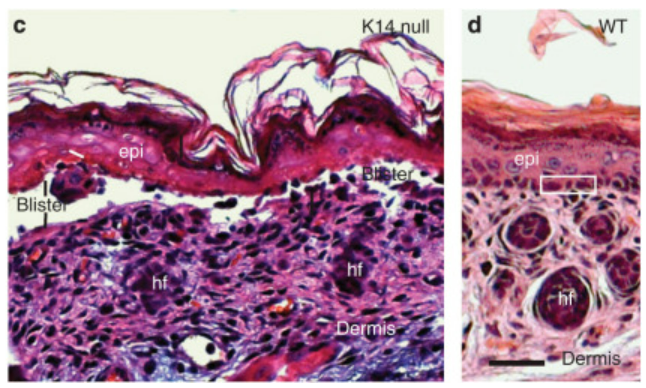
Des mutations perte-de-fonction dans certaines kératines comme la kératine-5 ou la kératine-14 peuvent provoquer des épidermolyses bulleuses, c’est-à-dire un détachement de l’épiderme de la lame basale et du derme sous-jacent causé par un dysfonctionnement des hémidesmosomes.
Certains filaments intermédiaires sont nucléaires telles les lamines qui maintiennent la structure du noyau en formant un réseau sous la membrane interne nucléaire. Elles participent aussi à la liaison chromatine/membrane nucléaire.
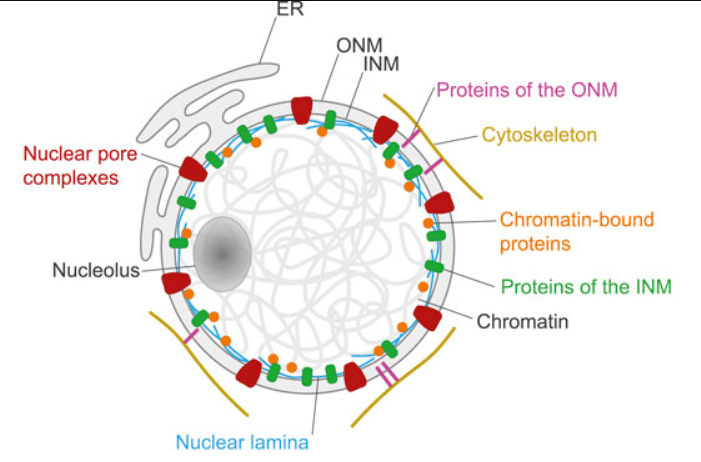

Les lamines sont phosphorylées sur des sérines et des thréonines par le complexe Cycline B/CDK1 (=MPF) lors de la prophase, ce qui aboutit au désassemblement de la membrane nucléaire nécessaire à la suite de la mitose. Les lamines restent accrochées à des fragments de l’ancienne enveloppe nucléaire qui forment des vésicules. Cela facilite la reformation du noyau à la télophase, lorsque le MPF est inactivé.
Le clivage des lamines par la caspase 6 participe à la désorganisation du noyau qui accompagne l’apoptose.
Les lamines A et C sont générées à partir du même gène LMNA par épissage alternatif. Des mutations perte-de-fonction dans ce gène peuvent aboutir à des laminopathies, un ensemble de pathologies contenant notamment la progéria ou syndrome d’Hutchinson-Gilford qui est caractérisé par un vieillissement prématuré et au niveau cellulaire, par des noyaux très déformés. Des défauts d’organisation des lamines nucléaires induisent une mauvaise localisation et un mauvais fonctionnement des protéines de réparation de l’ADN, telles que ATR et 53BP1, conduisant à une instabilité du génome (Gibbs-Seymour et al., 2015; Fan et al., 2023).
VOIR LE GLOSSAIRE DES TERMES SPECIFIQUES AU CYTOSQUELETTE
VOIR LE ROLE DU CYTOSQUELETTE DANS LA CROISSANCE AXONALE
LA CARTE MENTALE :
DES MOTS CROISES POUR REVISER :

QUIZZ SUR LE CYTOSQUELETTE : https://learningapps.org/watch?v=ptrci3iej23
D’AUTRES RESSOURCES SUR LE SUJET :
Cours en ligne sur le cytosquelette (Université Bordeaux 1)
QUELQUES EQUIPES FRANCOPHONES QUI TRAVAILLENT SUR LE SUJET :
Dynamique du cytosquelette et motilité – I2BC, Université Paris-Saclay
Régulation de la dynamique des microtubules – Institut Curie
LIEN VERS LE GLOSSAIRE GENERAL
- Adhérences cellule-cellule
- Arabidopsis thaliana
- Axe antéro-postérieur chez la drosophile
- Biomécanique du développement
- Caenorhabditis elegans
- Concepts principaux
- Contrôle de la traduction
- Contrôle de la transcription
- Contrôle génétique et épigénétique
- Croissance du tube pollinique et double fécondation chez les Angiospermes
- Croissance et guidage axonal
- Des modèles animaux moins classiques
- Développement de l’oeil des Vertébrés
- Développement et évolution
- Et l’Humain ?
- Exercices sur l’ovogenèse, la spermatogenèse et la fécondation
- Exercices sur le contrôle de l’expression des gènes
- Exercices sur le développement des bourgeons de membre
- Exercices sur le développement des muscles striés squelettiques
- Exercices sur le développement des végétaux et les hormones végétales
- Exercices sur les cycles et les divisions cellulaires
- Exercices sur les étapes du développement, les inductions embryonnaires et la mise en place des axes de polarité
- Exercices sur les matrices extracellulaires, le cytosquelette et les adhérences cellule-cellule
- Exercices sur les voies de signalisation
- Glossaire
- Glossaire des termes liés à la génétique
- Glossaire des termes liés au cytosquelette, la matrice extracellulaire, l’adhérence et la migration cellulaire
- Hématopoïèse et développement des cellules du système immunitaire
- Histoire de la biologie cellulaire et de la biologie du développement
- L’acide rétinoïque
- L’apoptose
- L’autophagie
- L’organogenèse
- L’ovogénèse prépare le développement embryonnaire
- La drosophile
- La fécondation
- La formation des somites
- La gastrulation
- La gastrulation (version allégée)
- La métamorphose chez les Hexapodes et les Amphibiens
- La neurogénèse chez les mammifères adultes
- La neurulation
- La poule
- La signalisation calcique
- La souris
- La superfamille TGFβ et ses voies de signalisation
- La voie de signalisation de l’auxine et ses rôles
- La voie de signalisation Hedgehog
- La voie de signalisation Hippo et ses composants YAP/TAZ
- La voie de signalisation Notch
- Le clivage
- Le destin des cellules et les réseaux de régulation génique
- Le développement des bourgeons de membre
- Le développement des muscles striés squelettiques
- Le développement des organes génitaux et des cellules germinales
- Le développement du cortex
- Le méristème apical caulinaire en phase végétative et lors de la formation d’une fleur
- Le poisson zèbre
- Le xénope
- Les cellules des crêtes neurales
- Les cellules et les gènes en action dans le développement
- Les cellules souches
- Les cellules tumorales
- Les cycles et les divisions cellulaires
- Les étapes du développement
- Les étapes du développement embryonnaire d’Arabidopsis thaliana et leur contrôle
- Les inductions embryonnaires et les gradients de morphogène
- Les matrices extracellulaires animales
- Les organismes modèles
- Les outils pour étudier l’expression et la fonction des gènes
- Les parois des cellules végétales
- Les techniques et les outils pour la biologie cellulaire
- Les transitions épithélio-mésenchymateuses et les migrations cellulaires
- Les vésicules extracellulaires
- Les voies de signalisation
- Les voies de signalisation FGF
- Mise en place des axes chez les Vertébrés
- Structures et processus cellulaires
- Voies de signalisation WNT
