L’acide rétinoïque (AR) est une petite molécule lipophile qui agit comme ligand des récepteurs nucléaires de l’AR (RAR). L’AR est synthétisé à partir du rétinol par la rétinaldéhyde déshydrogénase de type 2 (Raldh2) et dégradée en métabolites polaires par Cyp26. L’AR peut se présenter sous forme d’AR tout-trans ou sous la forme de son isomère l’acide 9-cis rétinoïque.
Le rétinol est transporté dans le sérum par la protéine de liaison au rétinol (RBP4) sécrétée par le foie. Le rétinol pénètre dans les cellules par le transporteur spécifique STRA6.
Dans un tissu sécréteur d’AR, le rétinol est oxydé en rétinaldéhyde par l’alcool déshydrogénase (ADH) ou la rétinol déshydrogénase (RDH), et le rétinaldéhyde est oxydé en AR par la rétinaldéhyde déshydrogénase (RALDH). La famille d’enzymes RALDH comprend 3 enzymes : RALDH1, RALDH2 et RALDH3. Leur expression est spécifique dans les différents tissu et leur activité constitue l’étape limitante de la synthèse d’AR. Chez la souris, RALDH2, le plus précoce à être exprimé, est détecté dans la ligne primitive et dans le mésoderme lors de la gastrulation, puis est ensuite localisé dans le mésoderme somitique et latéral, le tube cardiaque postérieur et le cerveau antérieur (Niederreither et al., 1997). Il est responsable de la disponibilité de l’AR jusqu’à E8,5 environ, après quoi RALDH1 et RALDH3 contribuent à la synthèse de l’AR dans les yeux et le système olfactif.
L’AR est ensuite libéré et absorbé par les cellules environnantes. Les cellules qui expriment CYP26 (une enzyme à cytochrome P450) déclenchent une oxydation de l’AR pour sa dégradation et ne sont pas des cellules cibles de l’AR. Les cellules cibles de l’AR expriment une protéine cellulaire de liaison à l’AR (CRABP) qui facilite son absorption et son transport vers le noyau où l’AR se lie à son récepteur (RAR). Le complexe composé de RAR lié au ligand avec RXR attaché à l’élément de réponse à l’acide rétinoïque (RARE) de l’ADN régule la transcription des gènes cibles en modifiant la liaison des corépresseurs et des coactivateurs.


En contraste avec les autres molécules classiques de signalisation en embryologie, l’acide rétinoïque est lipophile et traverse sans problème la membrane plasmique. Les récepteurs aux rétinoïdes appartiennent à la superfamille des récepteurs nucléaires. Ce sont des facteurs de transcription ligand-dépendants qui sont divisés en deux grandes familles. Les récepteurs nucléaires à l’acide rétinoïque (RARs) sont spécifiques à l’AR tout-trans alors que les récepteurs de rétinoïde X (RXRs) ont comme ligand naturel l’acide 9-cis-rétinoïque. Il existe 3 isotypes (α, β et γ) pour chaque famille. Chaque récepteur, comme tout autre récepteur nucléaire, possède des domaines communs à leur activité. Le domaine d’activation de la transcription est retrouvé dans les régions N-terminales, soit A et B. La région E, contient le domaine de liaison au ligand et la zone fonctionnelle de transactivation ligand-dépendant. Enfin, le domaine de liaison à l’ADN se trouve dans la région C et est composé de 2 hélices α ainsi que d’une extension COOH terminale. La liaison à l’ADN est possible seulement sous forme d’homodimère (RXR_RXR) ou d’hétérodimère (RAR_RXR) sur des séquences spécifiques dans les régions promotrices des gènes cible.
Les RAREs (rétinoic acid response elements) sont composés de plusieurs répétitions d’AGGTCA séparé par 2 à 5 nucléotides et constitue les séquences visées par les hétérodimère RAR_RXR. Les RXREs sont composés de la même répétition mais séparés par un seul nucléotide et sont ciblés par les homodimères RXR_RXR. La liaison du ligand, AR tout-trans ou acide 9-cis-rétinoique, aux RNR entraine le recrutement de co-activateurs ou co-répresseurs selon le cas. De plus, une enzyme de remodelage de la chromatine est simultanément mobilisée et travaille de concert avec le co-activateur ou le co-répresseur afin de respectivement décompacter ou condenser la chromatine. Selon les situations, il y aura donc soit activation ou répression de la transcription du gène cible. Les récepteurs à l’AR ont comme cibles plus de 500 gènes dont CYP26A1 codant l’enzyme de dégradation de l’AR (boucle de rétroaction négative) et les gènes Hox impliqués dans la régionalisation selon l’axe antéro-postérieur au cours du développement embryonnaire.
De nouveaux récepteurs orphelins liés aux rétinoïdes (RORs) ont récemment été identifiés. Leur liaison à l’ADN est possible grâce à l’intermédiaire de séquences spécifiques ROREs incluant la répétition de la séquence (A/G)GGTCA. Contrairement aux RAR et RXR, les RORs n’ont pas besoin de former des dimères et se lient aux ROREs directement sous forme de monomère. Les RORs sont impliqués notamment dans le développement de la rétine, du cervelet et du système lymphatique.
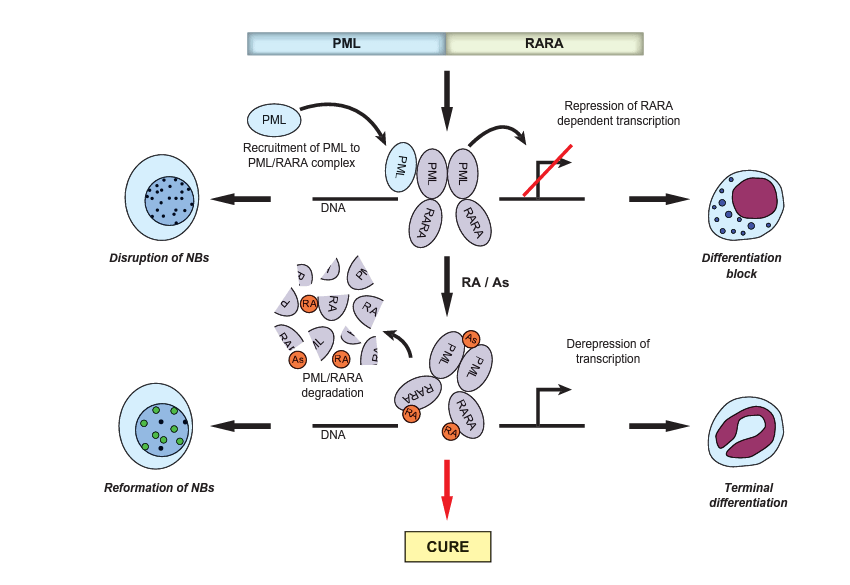
Dans la quasi-totalité des leucémies promyélocytaires aiguës (LPA), une translocation impliquant les chromosomes 15 et 17 provoque une fusion du gène codant le récepteur de l’acide rétinoïque RARα avec le gène codant PML (nommé d’après la leucémie promyélocytaire). Une fois synthétisée, la protéine-fusion bloque la différenciation des promyélocytes en différents types de granulocytes, qui dépend normalement de la liaison de l’AR à son récepteur, RARα. Un traitement par de l’AR s’est révélé efficace pour provoquer des rémissions de ce type de leucémie car il induit la dégradation des protéines-fusions dysfonctionnelles PML/RARα.
L’interaction entre l’AR et ses récepteurs peut avoir seulement un effet indirect sur la transcription de gènes cibles. Par exemple, lors de la différenciation des motoneurones dans la région ventrale du tube neural, la fixation de l’AR sur son récepteur permet le recrutement de l’histone acétyltransférase CBP qui va ouvrir la chromatine et permettre au facteur de transcription Neurogénine-2 d’activer la transcription de ses cibles (Lee et al., 2009). Dans ce cas, les récepteurs à l’AR sont associés en complexe avec Neurogénine-2 avant même l’arrivée de l’AR (pré-positionnés pour agir au bon endroit).

Au cours de l’embryogenèse précoce des vertébrés, les régions de synthèse et de dégradation de l’AR ont été cartographiées en détectant l’ARN messager codant les enzymes de ce métabolisme. Par exemple, au cours de l’organogenèse chez le poisson zèbre, raldh2 est exprimé dans le mésoderme au milieu du tronc, tandis que cyp26 est exprimé à la fois aux extrémités antérieure et postérieure de la plaque neurale. Ainsi, un gradient bilatéral d’AR se forme avec la concentration la plus élevée dans le milieu du tronc et la concentration la moins élevée à chaque extrémité.
Les rétinoïdes régulent l’expression des gènes Hox. In vitro, l’ajout d’AR induit l’expression des gènes Hox d’une manière dépendante du temps et de la dose (Papalopulu et al., 1991). De manière générale, des doses importantes d’AR provoquent une postériorisation des structures.

Une version commentée de cette figure est disponible en vidéo.
Source : https://nature.com/articles/340140a0
L’exposition in vivo à l’AR pendant des fenêtres gestationnelles spécifiques provoque des transformations homéotiques vertébrales qui coïncident avec l’antériorisation des domaines d’expression des Hox, c’est-à-dire que leur limite d’expression antérieure remonte encore plus antérieurement ce qui correspond à une postériorisation des structures (des structures antérieures se mettent à exprimer des gènes Hox qui habituellement sont exprimés plus postérieurement) (Kessel et Gruss, 1991). Dans le cerveau postérieur, l’antériorisation de l’expression de Hox induite par l’AR (Conlon et Rossant, 1992) entraîne une altération de l’identité des rhombomères (Marshall et al., 1992). Pour plusieurs gènes Hox, la réponse à l’AR est directement médiée par la présence d’un élément de réponse acide rétinoïque (RARE) trouvé 5′ et/ou 3′ aux régions codantes (Dupé et al., 1997, Gould et al., 1998, Huang et al., 2002).
Dans le cerveau postérieur, quatre RARE contrôlent chacun l’expression d’un gène Hox. La mutation du RARE de Hoxa1, du RARE de Hoxb1, du RARE de Hoxb4 ou du RARE de Hoxd4 (Nolte et al., 2003) aboutit à une réduction ou à la perte de l’expression d’un gène rapporteur dans le cerveau postérieur en développement, et abolit la réactivité du transgène au traitement par l’AR. Le remplacement du RARE de Hoxb4 par le RARE de Hoxb1 antériorise l’activité transgénique du rapporteur dans le cerveau postérieur (Gould et al., 1998). Par conséquent, la nature du RARE, ainsi que les récepteurs spécifiques qui le lient, peuvent être importants dans l’établissement des domaines d’expression des gènes Hox.
Un gradient d’AR a été mis en évidence dans le cerveau postérieur (Dupé et Lumsden, 2001; Maden et al., 1998). Ce gradient semble être établi par les actions opposées de deux enzymes. Le produit du gène Raldh2 qui convertit le rétinaldéhyde en AR est fortement exprimé dans le mésenchyme cervical entourant la moelle épinière (Niederreither et al., 1997). Cyp26A1, dont le produit inactive l’AR par oxydation, est exprimé dans les régions du cerveau antérieur et moyen de la plaque neurale et dans le rhombomère r2 (r2) (Fujii et al., 1997, MacLean et al., 2001). Cyp26B1, un homologue de Cyp26A1, est exprimé dans r3 et r5 à E8,0 (MacLean et al., 2001). À E9,5, Cyp26B1 est fortement actif dans r5 et r6, et faiblement actif dans la surface basale de r2, r3 et r4. L’expression de ces gènes établit un gradient d’AR entre le cerveau postérieur antérieur (élevé) et caudal (bas) (Dupé et Lumsden, 2001) et établit ainsi les domaines d’expression des gènes Hox sensibles à la RA. Les gènes Hox qui sont induits par l’AR à des concentrations plus faibles in vitro ont des bordures plus antérieures (Hunt et al., 1991) que ceux nécessitant des concentrations plus élevées. Par conséquent, la régulation spatiale des gènes responsables de la structuration du cerveau postérieur est régulée par l’accumulation locale d’AR.
Un apport excessif d’AR provoque des fentes palatines chez la souris. Les souris avec une délétion dans Cyp26b1, qui code une enzyme clé de la dégradation de l’AR, ont une fente palatine, une micrognathie, une troncature des membres antérieurs et postérieurs et des défauts d’ossification dans les os de la calvaria (Maclean et al., 2009). De plus, les souris présentant une mutation de la rétinol déshydrogénase 10, une enzyme de la synthèse de l’AR (souris Rdh10m366Asp), ont des taux d’AR réduits et présentent une fente médiane, une syndactylie et un cerveau antérieur mal formé (Ashique et al., 2012). Les souris présentant des mutations dominantes négatives du récepteur alpha de l’acide rétinoïque (Rara403*) et les souris présentant un déficit des récepteurs alpha et gamma de l’AR (Rara–/–;Rarg–/–) présentent une fente médiane (Lohnes et al ., 1994 ; Mark et al., 2009). Ainsi, une quantité appropriée d’AR est cruciale pour le développement embryonnaire normal, avec des niveaux de AR trop ou trop faibles provoquant une fente palatine chez la souris. Une diminution des taux sériques de vitamine A et de protéine de liaison à la PR 4 (RBP4), un translocateur de l’AR, a été signalée chez des patients (Steinhof et al., 2021). De plus, on sait qu’un apport excessif en vitamine A est associé à de multiples malformations congénitales (Martinez-Frias et Salvador, 1990). Cependant, la dose tératogène minimale semble être bien supérieure au niveau consommé par la plupart des femmes par le biais de suppléments de multivitamines et de vitamine A pendant la grossesse (Sommer et al., 2012).
EQUIPES FRANCOPHONES QUI TRAVAILLENT SUR LE SUJET :
Equipe « Développement et physiopathologie du cerveau » – IGBMC, Strasbourg
- Adhérences cellule-cellule
- Arabidopsis thaliana
- Axe antéro-postérieur chez la drosophile
- Biomécanique du développement
- Caenorhabditis elegans
- Concepts principaux
- Contrôle de la traduction
- Contrôle de la transcription
- Contrôle génétique et épigénétique
- Croissance du tube pollinique et double fécondation chez les Angiospermes
- Croissance et guidage axonal
- Des modèles animaux moins classiques
- Développement de l’oeil des Vertébrés
- Développement et évolution
- Et l’Humain ?
- Exercices sur l’ovogenèse, la spermatogenèse et la fécondation
- Exercices sur le contrôle de l’expression des gènes
- Exercices sur le développement des bourgeons de membre
- Exercices sur le développement des muscles striés squelettiques
- Exercices sur le développement des végétaux et les hormones végétales
- Exercices sur les cycles et les divisions cellulaires
- Exercices sur les étapes du développement, les inductions embryonnaires et la mise en place des axes de polarité
- Exercices sur les matrices extracellulaires, le cytosquelette et les adhérences cellule-cellule
- Exercices sur les voies de signalisation
- Glossaire
- Glossaire des termes liés à la génétique
- Glossaire des termes liés au cytosquelette, la matrice extracellulaire, l’adhérence et la migration cellulaire
- Hématopoïèse et développement des cellules du système immunitaire
- Histoire de la biologie cellulaire et de la biologie du développement
- L’apoptose
- L’autophagie
- L’organogenèse
- L’ovogénèse prépare le développement embryonnaire
- La drosophile
- La fécondation
- La formation des somites
- La gastrulation
- La gastrulation (version allégée)
- La métamorphose chez les Hexapodes et les Amphibiens
- La neurogénèse chez les mammifères adultes
- La neurulation
- La poule
- La signalisation calcique
- La souris
- La superfamille TGFβ et ses voies de signalisation
- La voie de signalisation de l’auxine et ses rôles
- La voie de signalisation Hedgehog
- La voie de signalisation Hippo et ses composants YAP/TAZ
- La voie de signalisation Notch
- Le clivage
- Le cytosquelette
- Le destin des cellules et les réseaux de régulation génique
- Le développement des bourgeons de membre
- Le développement des muscles striés squelettiques
- Le développement des organes génitaux et des cellules germinales
- Le développement du cortex
- Le méristème apical caulinaire en phase végétative et lors de la formation d’une fleur
- Le poisson zèbre
- Le xénope
- Les cellules des crêtes neurales
- Les cellules et les gènes en action dans le développement
- Les cellules souches
- Les cellules tumorales
- Les cycles et les divisions cellulaires
- Les étapes du développement
- Les étapes du développement embryonnaire d’Arabidopsis thaliana et leur contrôle
- Les inductions embryonnaires et les gradients de morphogène
- Les matrices extracellulaires animales
- Les organismes modèles
- Les outils pour étudier l’expression et la fonction des gènes
- Les parois des cellules végétales
- Les techniques et les outils pour la biologie cellulaire
- Les transitions épithélio-mésenchymateuses et les migrations cellulaires
- Les vésicules extracellulaires
- Les voies de signalisation
- Les voies de signalisation FGF
- Mise en place des axes chez les Vertébrés
- Structures et processus cellulaires
- Voies de signalisation WNT