par Patrick PLA, Université Paris-Saclay
Les ligands qui se lient et activent les récepteurs transmembranaires Notch sont aussi des protéines transmembranaires, et donc l’activation de la signalisation Notch dépend des interactions directes de cellule à cellule (communication juxtacrine). Cette communication permet de limiter la signalisation aux interactions cellulaires locales et permet aux cellules de communiquer directement avec leurs voisines.
Néanmoins, au cours de certains processus de développement, il a été découvert que des ligands activent Notch exprimé à la surface de cellules situées à distance. Une telle signalisation à longue portée emprunte des projections cellulaires structurées par l’actine apparentées à des filopodes appelées cytonèmes pour délivrer des signaux d’activation à Notch sur des sites distants (de Joussineau et al., 2003). Par exemple, la cellule de la pointe distale de C. elegans a de longs processus cellulaires qui contiennent le ligand Lag2 et s’étendent jusqu’aux cellules de la lignée germinale dont ils régulent la prolifération par l’activation de l’homologue Notch Glp1 (Fitzgerald et Greenwald, 1995).
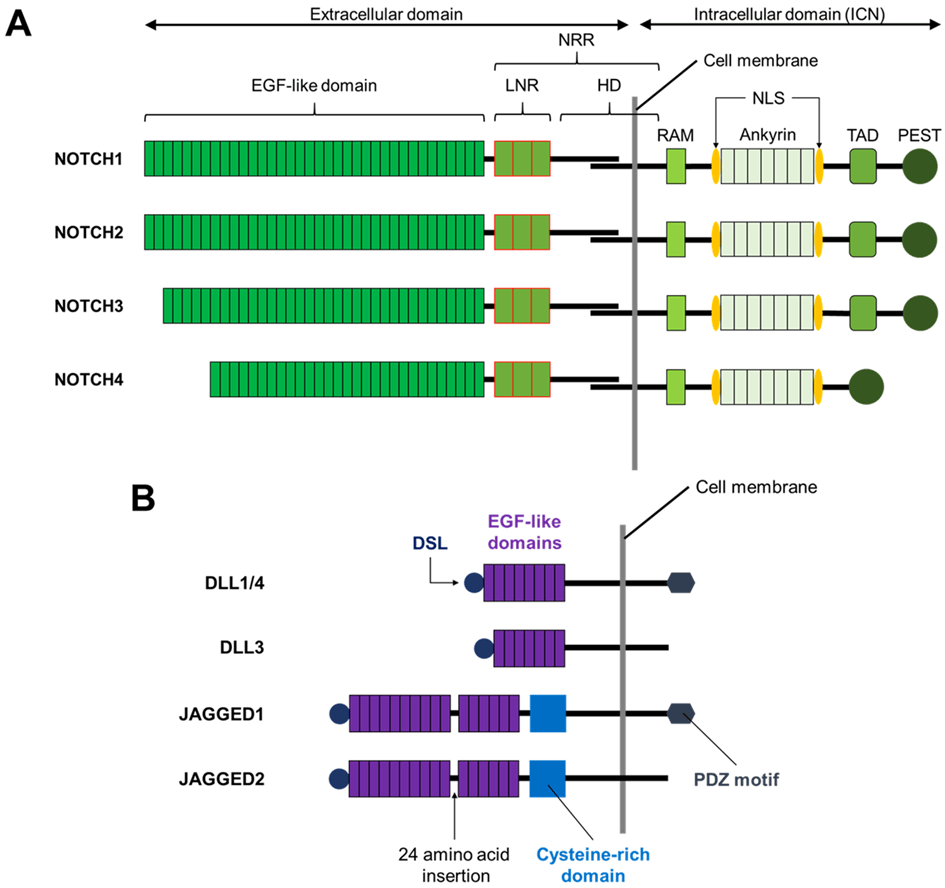
L’activation de la voie de signalisation Notch nécessite une interaction physique entre un récepteur Notch et son ligand, qui provoque des réponses dépendantes du contexte cellulaire.
Plusieurs études cristallographiques et fonctionnelles montrent que l’interaction entre le domaine Delta/Serrate/lag-2 (DSL) des ligands de Notch et les domaines de type facteur de croissance épidermique (EGF) 10 et 11 du récepteur Notch est nécessaire à l’activation de la voie Notch.
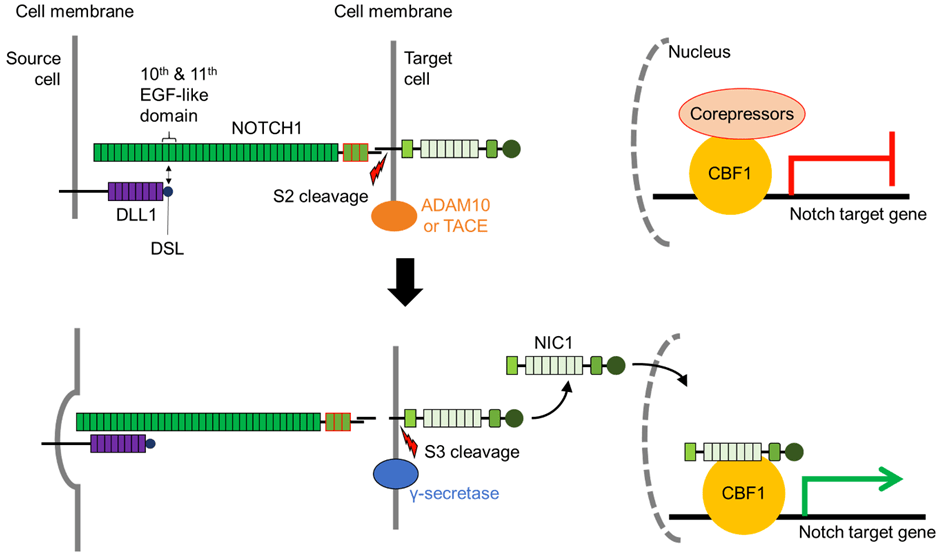
Une version commentée de cette figure est disponible en vidéo.
Source : https://doi.org/10.3390/biom11060849
Lors de l’interaction récepteur-ligand, le ligand « attire » le récepteur Notch exposant ainsi un site spécifique à la base du domaine extracellulaire de Notch pour le clivage S2. L’endocytose du ligand lié est cruciale pour cette étape de l’activation de la voie Notch (Parks et al., 2000; Nichols et al., 2007) et c’est la force physique exercée par cette endocytose qui fait changer la conformation de Notch et expose le site de clivage S2. L’étape du clivage S2 est l’étape limitante de la succession d’évènements qui va aboutir à la libération du domaine intracellulaire de Notch (NIC ou NICD). Deux métalloprotéases de la famille ADAM (A Disintegrin and Metalloprotéases) sont impliquées dans le clivage S2 : ADAM10 et ADAM17/TNF-α converting enzyme (TACE). Le knock-out d’ADAM10 ou de TACE est léthal à l’état embryonnaire, les embryons knock-out d’ADAM10 présentant des défauts similaires aux knock-outs du récepteur Notch (Hartmann et al., 2002).
Le clivage séquentiel sur le site S2 expose davantage le NICD restant pour le clivage S3. Le complexe γ-sécrétase composé de 4 protéines transmembranaires (Préséniline qui est le composant enzymatique avec une activité aspartyl-protéase, Nicastrine, APH1 et Pen2) libère le NICD.

Il existe une diversité au site de clivage S3, avec un clivage NICD observé à divers résidus d’acides aminés. Les fragments de NICD produits présentent des demi-vies et une activité Notch différentes, suggérant une spécificité du clivage S3 comme mécanisme de régulation de l’activation de Notch (Tagami et al., 2008).
Signalons qu’un clivage d’une autre protéine, APP, par la γ-sécrétase produit Aβ40 ou Aβ42 qui est un peptide formant des plaques amyloïdes extracellulaires qui sont impliqués dans la maladie d’Alzheimer.
Le domaine intracellulaire de Notch (NICD) fonctionne directement comme transducteur de signal (Kopan et Ilagan, 2009). Il n’y a pas d’amplification par une cascade de phosphorylation contrôlée par des enzymes comme on peut le voir dans d’autres voies de signalisation. Dans le noyau, le domaine intracellulaire de Notch forme un complexe avec la protéine de liaison à l’ADN CSL (soit CBF1/RBJκ chez les Mammifères, Su(H) chez la drosophile, LAG1 chez C. elegans) et des coactivateurs transcriptionnels (notamment Mastermind) qui activent l’expression des gènes cibles de Notch tels que hairy et les gènes de la famille HES. Avant l’arrivée du domaine intracellulaire de Notch, CBF1 fonctionne comme un répresseur de la transcription car il est lié à N-CoR et SMRT qui recrutent des histones désacétylases qui provoquent une condensation de la chromatine (Wang et al., 2000; Espinosa et al., 2003). Après l’arrivée du domaine intracellulaire de Notch, il y a au contraire recrutement par CBF1 d’activateurs tels que les protéines de la famille Mastermind. L’absence de Mastermind 1 chez la souris provoque des déficiences dans le développement dans les lymphocytes dont on sait qu’ils nécessitent une activation de la voie Notch (Oyama et al., 2007).
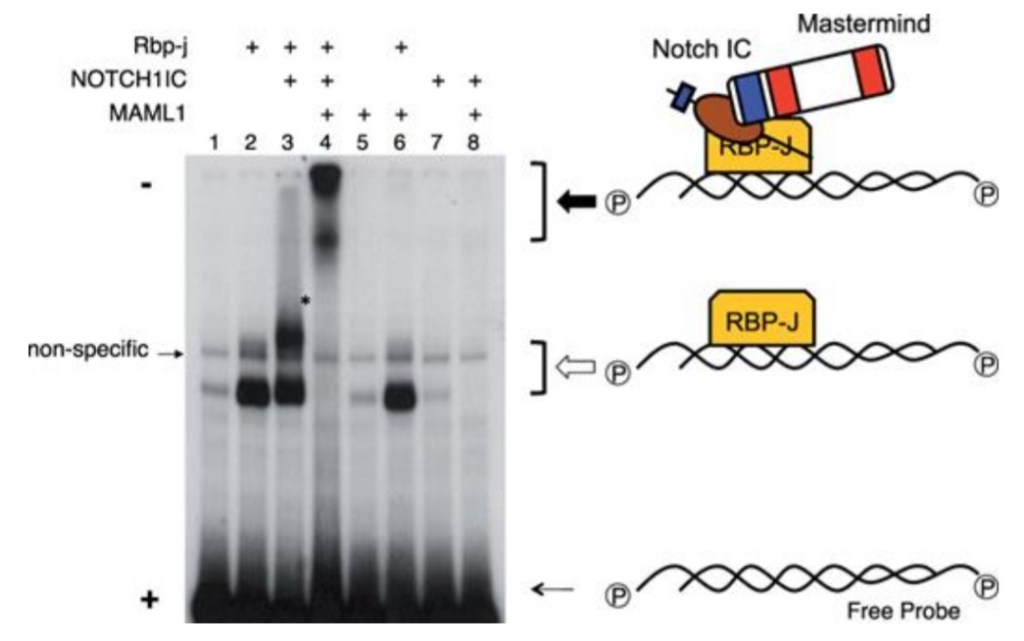
La famille Hes des répresseurs transcriptionnels à hélice-boucle-hélice basique (bHLH) (Hes1, Hes3 et Hes5) agit en aval de la signalisation Notch (Kageyama et Ohtsuka, 1999). Ces répresseurs inhibent fortement la différenciation neuronale et maintiennent les cellules souches neurales dans le cerveau des mammifères en développement en réprimant l’expression des facteurs proneuraux tels que Ascl1 et Neurog1/2 (Ohtsuka et al., 1999 ; Hatakeyama et al., 2004).

Source : https://journals.biologists.com/dev/article/131/22/5539/52460/Hes-genes-regulate-size-shape-and-histogenesis-of
Les souris mutantes Hes1-/- présentent des phénotypes sévères provoqués par une différenciation neuronale accélérée, tandis que les souris mutantes Hes3-/- ou Hes5-/- ne présentent que des phénotypes légers en raison de la compensation par Hes1 dont l’expression est augmentée (Cau et al., 2000).
L’expression de Hes1 est souvent oscillatoire (Hirata et al., 2002).
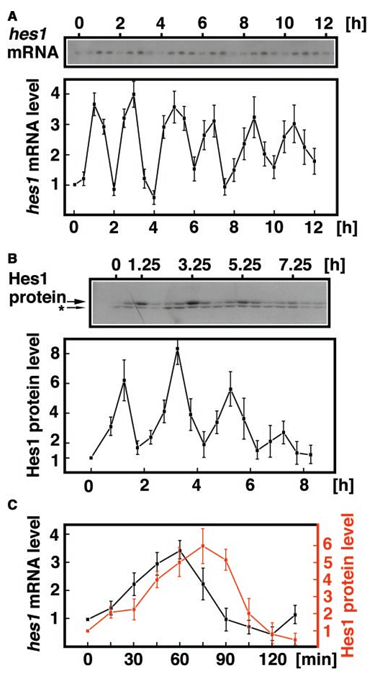
Les mécanismes commencent à être connus et sont en général liés à des rétrocontrôle négatifs selon divers mécanismes. Dans les progéniteurs corticaux, c’est une dégradation des ARNm de Hes1 médiée par un microARN, miR-9, qui a lieu (Bonev et al., 2012)
Parmi les facteurs Hes, Hes6 se distingue. Il peut se lier à Hes1 et empêcher son activité de répression transcriptionnelle, favorisant ainsi indirectement l’expression de gènes normalement réprimés par Hes1 (Bae et al., 2000). Il est donc favorable à la différenciation neuronale. Par exemple, la surexpression de Hes6 au cours du développement de la rétine favorise la différenciation des bâtonnets, en contraste marqué avec Hes1, qui inhibe cette différenciation cellulaire (Bae et al., 2000). Cependant, dans certains contextes cellulaires, Hes6 peut aussi jouer, comme Hes1, le rôle de répresseur transcriptionel (Gao et al., 2001).
Des voies Notch non canoniques : Des voies de signalisation à partir de Notch « non canoniques » ont été mises en évidence. Par exemple, lorsqu’il fixe Delta, Notch favorise la croissance et le guidage des axones pionniers dans l’embryon de Drosophile (les axones qui relient deux segments différents) en supprimant localement la signalisation Abl (Crowner et al., 2003; Kuzina et al., 2011). Pour ce faire, Notch se lie à deux composants en amont de la voie Abl (Le Gall et al., 2008) et les inhibent : la protéine adaptatrice Disabled (Dab), qui contrôle la localisation de la protéine Abl et stimule son activité kinase et le facteur d’échange de nucléotides à guanine (GEF) Trio, qui normalement active la signalisation Abl via la GTPase Rac. Autre voie non canonique : dans les cellules endothéliales bordant les vaisseaux sanguins, l’activation de Notch1 par les forces de cisaillement du sang ou par la fixation du ligand DLL4 stabilise les jonctions cellule-cellule et réduit la perméabilité des vaisseaux. Cet effet est médié par un nouveau mécanisme indépendant de la transcription dans lequel le clivage de Notch1 libère le petit domaine transmembranaire, qui favorise l’association de la VE-cadhérine avec la phosphatase transmembranaire LAR. Cette association recrute Trio qui stimule l’activité de la petite GTPase Rac1, qui stabilise les jonctions cellule-cellule et améliore la fonction barrière endothéliale (Polacheck et al., 2017).
Les récepteurs Notch possèdent plusieurs ligands. Par exemple, deux ligands (Delta et Serrate) existent chez la drosophile et cinq (DLL1, DLL3, DLL4, JAG1 et JAG2) se trouvent chez l’homme. L’existence de plusieurs ligands explique, en partie, la régulation spatio-temporelle de l’activité de Notch, et peut également contribuer à moduler les niveaux et la durée des signaux. Différents ligands peuvent également déclencher des réponses distinctes via le même récepteur Notch. Par exemple, les ligands Jagged et Delta conduisent à des destins différents lors de la détermination cellulaire au cours du développement de l’oreille interne, de l’angiogenèse et de l’hématopoïèse (Benedito et al., 2009 ; Petrovic et al., 2014). Par exemple, les cellules souches hématopoïétiques (CSH) se développent à partir de cellules à caractères endothéliales dans la paroi de l’aorte de l’embryon. Jagged1 active faiblement la voie Notch dans certaines cellules qui vont alors inhiber le programme de différenciation endothélial et activer le programme de transformation en CSH, tandis que les cellules qui interagissent avec DLL4 activent fortement la voie Notch et s’engagent définitivement dans la différenciation endothéliale (Gama-Norton et al., 2015).
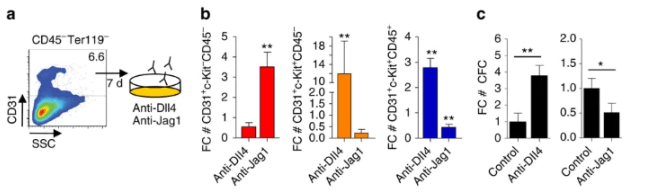
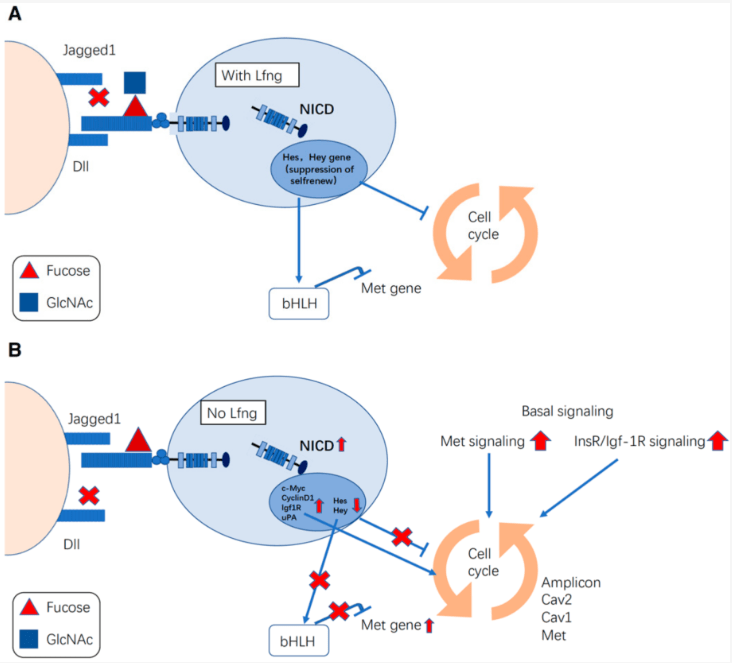
Egalement, la signalisation par un ligand fort peut être réduite lors de l’expression d’un deuxième ligand qui active un signal plus faible, car ce ligand est en compétition avec le premier pour se lier à Notch (Benedito et al., 2009 ; Petrovic et al., 2014). De plus, les glycotransférases Fringe augmentent l’affinité entre les récepteurs Notch et certains de ses ligands (Panin et al., 1997), fournissant une couche régulatrice supplémentaire. Les enzymes Fringe ajoute une N-acétylglucosamine sur un O-fucose préalablement ajouté sur Notch au cours de sa maturation. Dans ce cas, Notch a en général plus d’affinités pour les ligands Delta mais moins d’affinités pour les ligands Jagged et/ou Serrate. La balance entre ces deux ligands influence de nombreux processus développementaux mais aussi lors de la tumorigenèse.
L’expression des ligands de Notch est quelque fois sous le contrôle de la voie de signalisation Notch elle-même. Par exemple, durant le développement de l’oreille interne des vertébrés, la voie Notch active l’expression de Jag1 et de Dll4 mais inhibe l’expression de Jag2 et de Dll1 (Kiernan et al., 2001; Neves et al., 2011).
Les ligands de Notch peuvent être clivés par des protéines de la famille ADAM, créant de formes solubles de ligands, ce qui a pour effet de diminuer le signal activateur de Notch (Zolkiewska, 2008). Par exemple lors du développement de l’aile de drosophile, l’orthologue d’ADAM10, Kuzbanian-like (Kbl) est nécessaire pour cliver Delta et permettre un développement normal de la marge et des « veines » de l’aile (Sapir et al., 2005).
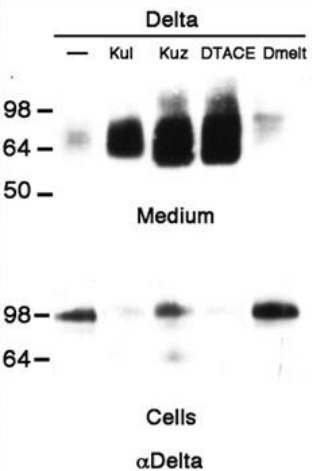
Rappelons que ADAM10 est impliqué dans le clivage activateur S2 du récepteur Notch (voir plus haut), ce qui montre le rôle très ambivalent de cette protéase.
Les récepteurs Notch et ses ligands sont largement exprimés au cours du développement et, dans de nombreux cas, les cellules en interaction expriment à la fois des ligands et des récepteurs. Les cellules prennent des destins différents car la signalisation Notch est constamment activée dans une seule des deux cellules en interaction, ce qui indique que la polarité de signalisation doit être hautement régulée. On pense que les niveaux relatifs de Notch et de ses ligands présents sur les cellules en interaction établissent la polarité de signalisation nécessaire pour garantir que les destins cellulaires corrects sont générés au bon moment du développement. Chez l’homme, l’haploinsuffisance de Jagged1 ou Notch2 est associée au syndrome d’Alagille, caractérisé par des défauts de développement du foie, du cœur, du squelette et des yeux (McDaniell et al., 2006), tandis que l’haploinsuffisance de Notch1 est impliquée dans un sous-type de maladie aortique héréditaire (Garg et al., 2005). Dans ces différents cas, l’un des allèles permet toujours de générer une protéine fonctionnelle mais en quantité moindre qu’avec deux allèles normaux donc on voit bien l’importance de la quantité de protéines produites.
Le niveau de l’activité Notch peut aussi réguler l’état d’une population de cellules souches. Par exemple, dans la zone ventriculaire télencéphalique du poisson zèbre adulte, les cellules souches neurales oscillent entre un état de quiescence et le recrutement et ce sont les niveaux de la lente oscillation de l’activité Notch qui dirige ce changement d’état (Chapoton et al., 2010).
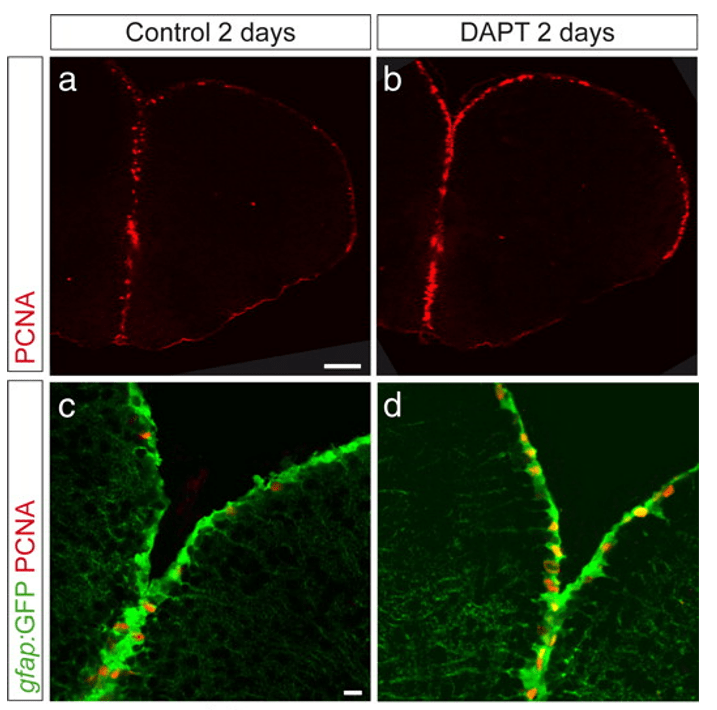
Une version commentée de cette figure est disponible en vidéo.
Source : https://www.jneurosci.org/content/30/23/7961
En plus, ce sont les progéniteurs en division (c’est-à-dire les cellules recrutées qui ont perdu leur caractère de cellules souches et qui, après prolifération, vont se différencier en neurones) qui sont la source de ligands pour Notch, imposant une quiescence transitoire aux cellules souches voisines. C’est un mécanisme d’auto-régulation : quand il y a trop de progéniteurs, ils activent un signal dans les cellules souches pour les remettre dans un état de quiescence et pour produire moins de progéniteurs. Cela permet de maintenir un équilibre entre population de cellules quiescentes et population de cellules prolifératives.
La voie de signalisation Notch est aussi impliquée dans le contrôle du nombre de cellules satellites (les cellules souches qui permettent de régénérer le tissu musculaire squelettique strié).
Des études chez la drosophile et C. elegans ont identifié des mécanismes de rétroaction transcriptionnelle positifs et négatifs qui amplifient de petites différences dans l’expression de Notch et de ses ligands qui introduisent un biais pour déterminer laquelle des cellules en interaction va envoyer ou recevoir le signal Notch (Seugnet et al ., 1997). Des boucles de rétroaction peuvent également faire osciller la signalisation Notch dans les cellules (Lahmann et al., 2019 ; Seymour et al. ., 2020).
Numb est un antagoniste de la signalisation Notch. Il agit en empêchant la localisation de Sanpodo sur la membrane cellulaire. Or Sanpodo est nécessaire à la bonne activation de Notch (O’Connor-Giles et Skeath, 2003). Numb recrute également des ligases E3 comme Itch qui ubiquitinylent le domaine intracellulaire de Notch (NICD) et l’orientent ainsi vers la dégradation (McGill et Glade, 2003)
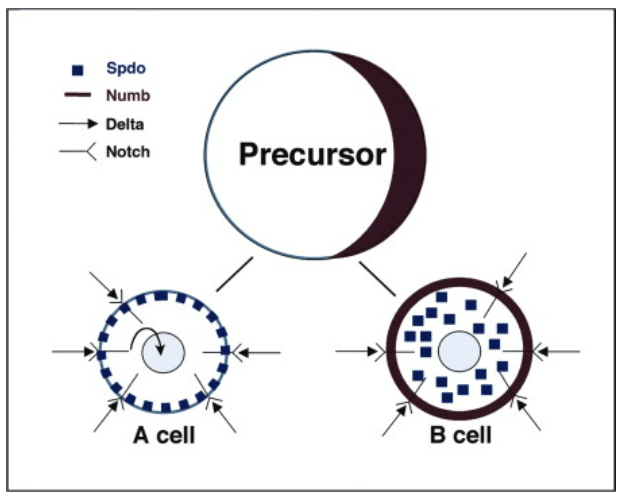
L’un des principaux modèles où Numb (et Notch) a été étudié est la neurogenèse chez la drosophile. Le développement du système nerveux central de la drosophile commence dans l’ectoderme ventrolatéral, dans la région dite neurogénique où théoriquement toutes les cellules groupées en cluster exprimant le gène achaete-scute (orthologue de Ascl1) peuvent participer au système nerveux. Les interactions cellulaires médiées par Notch régulent la sélection de cellules souches neurales individuelles ou neuroblastes (NB) au sein du cluster.

se développe à partir de chaque cluster, un phénomène appelé inhibition latérale. Une version commentée de cette figure est disponible en vidéo.
Source : https://journals.biologists.com/dev/article/116/4/855/37723/Molecular-markers-for-identified-neuroblasts-and
Ce processus s’appelle l’inhibition latérale et les cellules qui ont la voie Notch la moins activée deviennent les NB et inhibent l‘expression des gènes proneuraux dans les cellules voisines où la voie Notch est plus activée.

Cette fonction d’inhibition latérale de la voie Notch est sans doute très ancienne puisque chez le Cnidaire Nematostella vectensis, l’inhibition de la voie Notch aboutit à la surexpression des gènes proneuraux et à la production d’un nombre plus élevé de neurones à partir de l’ectoderme (Marlow et al., 2012).
Mais revenons à la drosophile. Chaque NB subit ensuite une série de divisions asymétriques pour se régénérer (caractère de cellule souche) et produire une cellule précurseur secondaire plus petite, connue sous le nom de cellule mère ganglionnaire (GMC). Les NB régénérés continuent de se diviser, chaque cycle de division produisant un NB et un GMC spécifié de manière unique. Enfin, chaque GMC se divise de manière asymétrique pour produire des neurones frères qui acquièrent des destins distincts A et B. La capacité des GMC à se diviser de manière asymétrique dépend de la présence d’une signalisation Notch active dans la cellule A et de l’absence de signalisation Notch dans la cellule B. L’activation différentielle de la signalisation Notch dans les neurones A et B nécessite la localisation asymétrique du déterminant Numb dans les GMC, sa ségrégation ultérieure à une seule cellule fille (la cellule B) et la capacité de Numb à bloquer le signal Notch (Buescher et al. 1998, Schuldt et Brand 1999). On voit ainsi que Numb agit souvent comme un déterminant du destin cellulaire (Knoblich, 2010). La machinerie cellulaire qui permet de la localiser dans une seule des cellules filles lors des divisions asymétriques commencent à être bien connus.

Des cas de cis-inhibitions ont été rapportés : les ligands et les récepteurs Notch co-exprimés dans la même cellule s’inhibent mutuellement, supprimant la signalisation intercellulaire (Sprinzak et al., 2010 ; del Álamo et al., 2011 ; Fiuza et al., 2010).
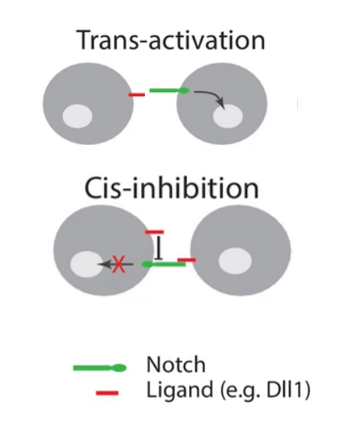

Une telle « inhibition cis » est importante dans divers processus de développement, notamment la neurogenèse, la formation des ailes chez la drosophile et le maintien des cellules souches épidermiques humaines postnatales (Jacobsen et al., 1998; Franklin et al., 1999; Lowell et al., 2000, Negri et al., 2019).
Cependant, quelques interactions cis activatrices ont été observées. Tout dépend du contexte cellulaire (Nandagopal et al., 2019).
En résumé, la voie de signalisation Notch est le principal régulateur des décisions binaires concernant le destin des cellules au cours du développement embryonnaire (Henrique et Schweisguth, 2019).
Il a été découvert récemment que le microbiote pouvait « manipuler » la signalisation Notch de son hôte pour influencer la différenciation cellulaire dans l’intestin. Chez le poisson-zèbre, les bactéries intestinales activent la voie de signalisation du récepteur TLR qui aboutit à activer Myd88, un inhibiteur de la voie Notch. Cette inhibition favorise la différenciation des cellules épithéliales intestinale sécrétrices par rapport aux autres types cellulaires de cet épithélium (Troll et al., 2018).
Voir le chapitre sur la formation des somites où la voie Notch joue un rôle important.
DES EQUIPES FRANCOPHONES TRAVAILLANT SUR LE SUJET
Equipe « Voie de signalisation Notch dans les cellules souches et les tumeurs » – Institut Curie, Paris
- Adhérences cellule-cellule
- Arabidopsis thaliana
- Axe antéro-postérieur chez la drosophile
- Biomécanique du développement
- Caenorhabditis elegans
- Concepts principaux
- Contrôle de la traduction
- Contrôle de la transcription
- Contrôle génétique et épigénétique
- Croissance du tube pollinique et double fécondation chez les Angiospermes
- Croissance et guidage axonal
- Des modèles animaux moins classiques
- Développement de l’oeil des Vertébrés
- Développement et évolution
- Et l’Humain ?
- Exercices sur l’ovogenèse, la spermatogenèse et la fécondation
- Exercices sur le contrôle de l’expression des gènes
- Exercices sur le développement des bourgeons de membre
- Exercices sur le développement des muscles striés squelettiques
- Exercices sur le développement des végétaux et les hormones végétales
- Exercices sur les cycles et les divisions cellulaires
- Exercices sur les étapes du développement, les inductions embryonnaires et la mise en place des axes de polarité
- Exercices sur les matrices extracellulaires, le cytosquelette et les adhérences cellule-cellule
- Exercices sur les voies de signalisation
- Glossaire
- Glossaire des termes liés à la génétique
- Glossaire des termes liés au cytosquelette, la matrice extracellulaire, l’adhérence et la migration cellulaire
- Hématopoïèse et développement des cellules du système immunitaire
- Histoire de la biologie cellulaire et de la biologie du développement
- L’acide rétinoïque
- L’apoptose
- L’autophagie
- L’organogenèse
- L’ovogénèse prépare le développement embryonnaire
- La drosophile
- La fécondation
- La formation des somites
- La gastrulation
- La gastrulation (version allégée)
- La métamorphose chez les Hexapodes et les Amphibiens
- La neurogénèse chez les mammifères adultes
- La neurulation
- La poule
- La signalisation calcique
- La souris
- La superfamille TGFβ et ses voies de signalisation
- La voie de signalisation de l’auxine et ses rôles
- La voie de signalisation Hedgehog
- La voie de signalisation Hippo et ses composants YAP/TAZ
- Le clivage
- Le cytosquelette
- Le destin des cellules et les réseaux de régulation génique
- Le développement des bourgeons de membre
- Le développement des muscles striés squelettiques
- Le développement des organes génitaux et des cellules germinales
- Le développement du cortex
- Le méristème apical caulinaire en phase végétative et lors de la formation d’une fleur
- Le poisson zèbre
- Le xénope
- Les cellules des crêtes neurales
- Les cellules et les gènes en action dans le développement
- Les cellules souches
- Les cellules tumorales
- Les cycles et les divisions cellulaires
- Les étapes du développement
- Les étapes du développement embryonnaire d’Arabidopsis thaliana et leur contrôle
- Les inductions embryonnaires et les gradients de morphogène
- Les matrices extracellulaires animales
- Les organismes modèles
- Les outils pour étudier l’expression et la fonction des gènes
- Les parois des cellules végétales
- Les techniques et les outils pour la biologie cellulaire
- Les transitions épithélio-mésenchymateuses et les migrations cellulaires
- Les vésicules extracellulaires
- Les voies de signalisation
- Les voies de signalisation FGF
- Mise en place des axes chez les Vertébrés
- Structures et processus cellulaires
- Voies de signalisation WNT
