Par Patrick PLA, Université Paris-Saclay
La voie de signalisation Hippo est originale car elle n’a pas de ligand, ni de récepteur clairement identifié. Pourtant, il s’agit d’une voie fonctionnellement conservée au cours de l’évolution et impliquée dans la prolifération cellulaire, la survie, les décisions relatives au destin cellulaire et dans la régénération (Camargo et al., 2007). La voie Hippo a été initialement identifiée par des criblages génétiques en mosaïque pour les suppresseurs de la prolifération chez la drosophile (Udan et al., 2003; pour un historique complet voir Kim et Jho, 2018). La cascade de signalisation Hippo contrôle la taille des organes et l’homéostasie tissulaire par le biais de la régulation de la prolifération, de l’apoptose et de la régénération (Zheng et Pan, 2019).
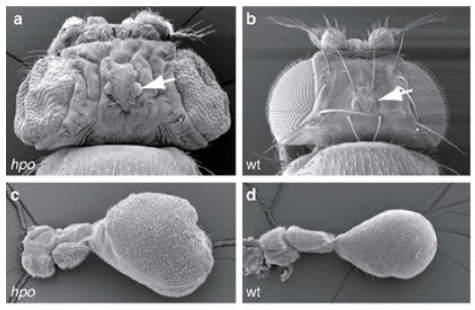
Sa dérégulation donne naissance à diverses maladies (Zhao et al., 2007 ; Zheng et al. al., 2020). Par exemple, des études familiales ont révélé que les patients présentant des mutations hétérozygotes non-sens dans YAP1, un des composants majeurs de la voie, présentent divers défauts, notamment une déficience intellectuelle, une fente orofaciale ou un colobome, une anomalie du développement de l’œil (Williamson et al., 2014). Certaines anencéphalies sont liées à des mutations causant la perte d’activité de NUAK2 (une sérine/thréonine kinase) qui a pour conséquence une rétention cytoplasmique de YAP (Bonnard et al., 2020). YAP ne peut donc plus activer la transcription de composants associés au cytosquelette importants pour la neurulation. Signalons que NUAK2 est aussi important par une voie indépendante de YAP pour la mise en place du cytosquelette et des molécules associées pour assurer la constriction apicale qui fait partie des déformations nécessaires pour l’accomplissement de la neurulation et de la fermeture du tube neural.
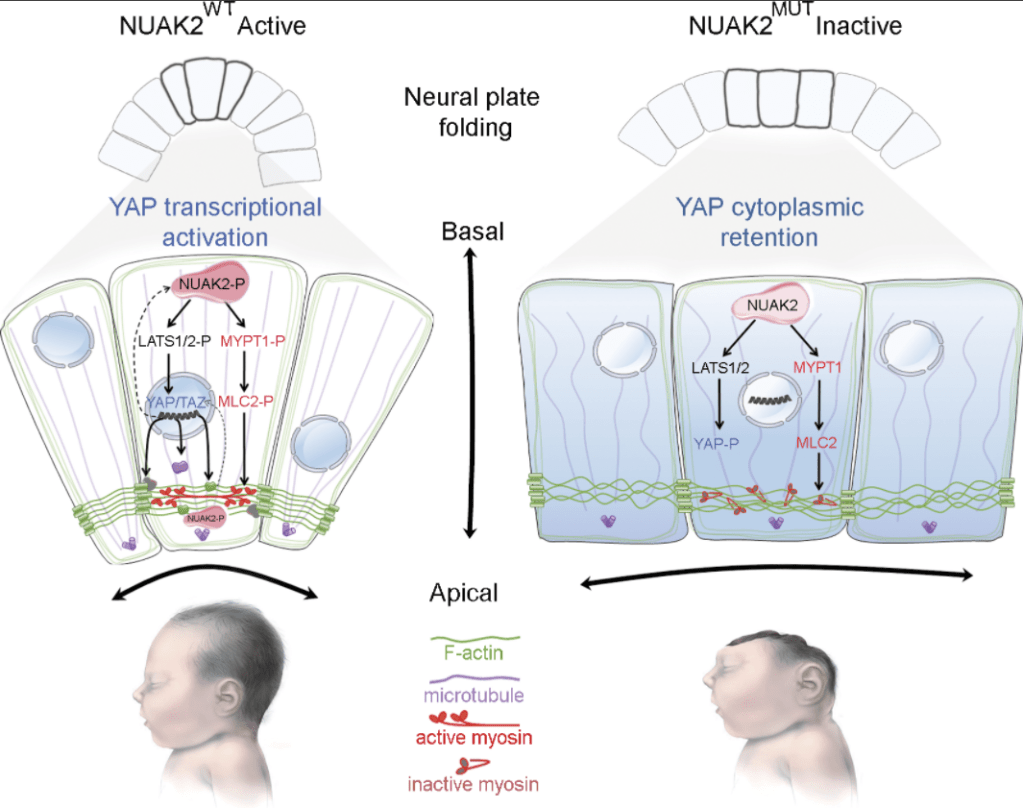
De plus, le Cancer Genome Atlas a identifié la voie de signalisation Hippo comme l’une des 10 voies de signalisation canoniques fréquemment altérées dans les cancers humains (Sanchez-Vega et al., 2018).
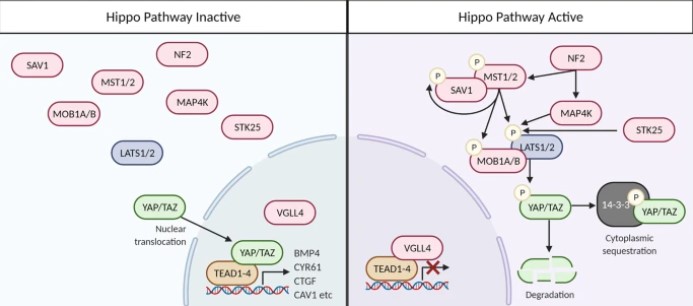
Lorsque la signalisation Hippo est activée, les composants en amont de la voie de signalisation, Mst1/2 et Sav1 sont phosphorylés, puis activent les kinases Lats1/2 qui phosphorylent YAP et TAZ (Misra et Irvine, 2018). Ces phosphorylations aboutissent à la dégradation de ces protéines. Elle est réalisée par le protéasome après ubiquitinylation par la E3-ubiquitine ligase SCFβTRCP (également connu sous le nom de BTRC) (Zhao et al., 2010). Lorsque la signalisation Hippo est désactivée, YAP et TAZ fonctionnent comme des co-activateurs transcriptionnels et forment un complexe dans le noyau avec des facteurs de transcription, notamment ceux de la famille TEAD, et activent l’expression de multiples gènes cibles (Hong et Guan , 2012, Wang et al., 2018).
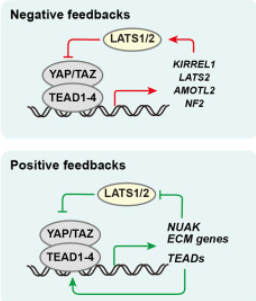
Il peut exister des retrocontrôles négatifs ou positifs de la voie Hippo.
YAP et TAZ comme mécanotransducteurs
Les cellules doivent interpréter des signaux mécaniques au cours de la morphogenèse et cela se traduit par des comportements cellulaires spécifiques. YAP/TAZ jouent souvent un rôle important dans ces processus.
YAP/TAZ apparaissent en effet comme des capteurs de forces mécaniques (Dupont et al., 2011; Panciera et al., 2017). La mécanotransduction YAP/TAZ peut être déclenchée par la densité cellulaire (soit par l’adhérence cellule-cellule, soit par la surface cellulaire réduite (Zhao et al., 2007 ; Aragona et al., 2013 ; Benham-Pyle et al., 2015), par la rigidité de la matrice extracellulaire (MEC) (Dupont et al., 2011; Aragona et al., 2013 ; Elosegui-Artola et al., 2016), et par la contrainte de cisaillement (Nakajima et al., 2017). Cette régulation peut être dépendante ou indépendante de la voie Hippo.

et TAZ (coactivateur transcriptionnel avec motif de liaison PDZ) sont localisés
dans le noyau et actifs dans des conditions mécaniques expérimentales qui
favorisent le développement de forces de résistance intracellulaires élevées, telles qu’une forme de cellule étalée, une matrice extracellulaire (MEC) rigide ou un étirement entre des micropiliers rigides (à gauche).
L’îlot de fibronectine micro-imprimé carré (panneau du droite) est représenté. Les cellules ont été colorées pour l’actine filamenteuse (F-actine) avec de la phalloïdine (vert) et pour YAP et TAZ (rouge). Dans ces conditions, YAP et TAZ sont activées et nucléaires.
Dans des conditions mécaniques dans lesquelles les cellules développent de faibles forces contractiles (par exemple, lorsqu’elles sont cultivées sur
de petites zones adhésives favorisant une petite taille de cellule, sur une matrice extracellulaire molle ou sur des micropiliers pliables), YAP et TAZ sont inactivés et se relocalisent dans le cytoplasme.
Un îlot de fibronectine micro-imprimé carré est représenté. L’activité réduite de YAP et TAZ oriente les réponses cellulaires vers l’apoptose ou l’arrêt de la croissance ou détourne la différenciation vers des destins cellulaires qui seraient spécifiés sur une matrice molle, par exemple, les adipocytes. La régulation expérimentale des niveaux de YAP et de TAZ permet d’obtenir un contrôle similaire du comportement cellulaire, quel que soit leur environnement mécanique (non représenté). Source.
En cas de confluence dans des culture de cellules telles que les cellules embryonnaires souches (cellules ES), les effets mécaniques sur le réseau de microfilament d’actine peut contribuer à créer de la compétition cellulaire via le contrôle de la localisation de YAP (Price et al., 2021).
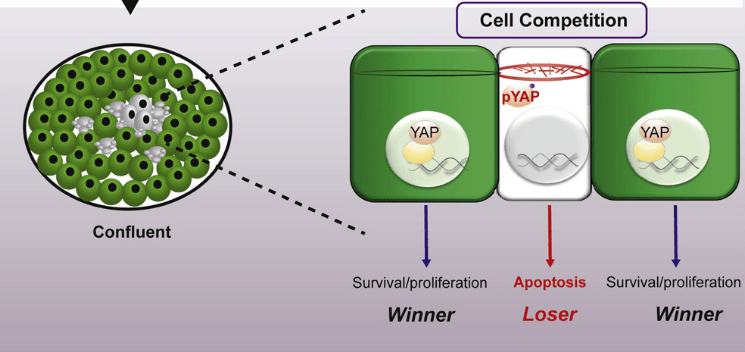
Dans le contexte de la densité cellulaire, les protéines de jonction cellulaire régulent l’activité YAP/TAZ. Par exemple, la protéine de la neurofibromatose de type 2 (NF2 ou Merlin) qui se trouve en aval de la signalisation contrôlée par les cadhérines et des intégrines, fonctionne comme un échafaudage des composants de la cascade Hippo dans les jonctions cellule-cellule. NF2 recrute LATS1/2 à la membrane plasmique, permettant l’activation de LATS1/2 par MTS1/2, ce qui conduit à l’inhibition de l’activité YAP/TAZ (Mendosa et al., 2018).
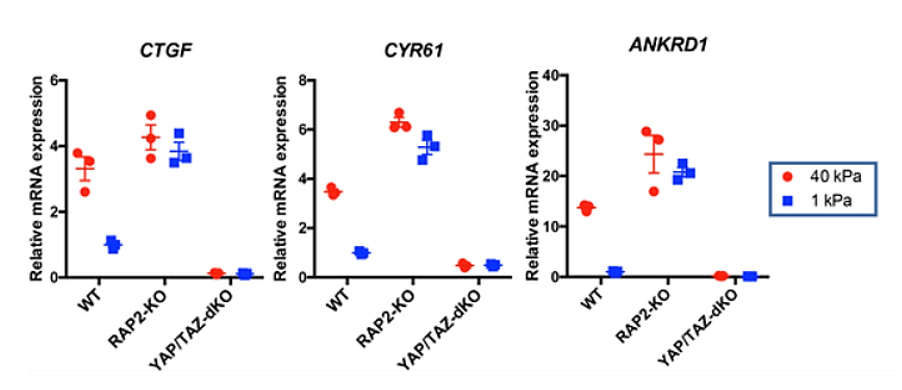
Les composants des points d’adhérences focaux, qui relient cytosquelette et MEC, régulent également l’activité YAP/TAZ en modulant la localisation subcellulaire de YAP (Kim et Gumbiner, 2015; Elosegui-Artola et al., 2016). La rigidité de la MEC et la géométrie cellulaire contrôlent l’activité YAP/TAZ grâce à de petites RhoGTPases déclenchant la tension du cytosquelette d’actomyosine (Dupont et al., 2011). Les forces exercées par l’ECM peuvent entraîner l’activité YAP/TAZ par le biais de différents mécanismes. La GTPase RAP2 liée à Ras transduit la rigidité de la MEC en réponses cellulaires YAP/TAZ via l’activation de la voie Hippo (Meng et al., 2018).
Le complexe nucléaire SWI/SNF inhibe YAP/TAZ en réponse à une signalisation mécanique, de telle sorte que pour déclencher l’activité YAP/TAZ, l’accumulation nucléaire de YAP/TAZ et l’inhibition de SWI/SNF sont nécessaires (Chang et al., 2018) . Les forces de la MEC peuvent réguler le transport à travers les pores nucléaires entraînent l’importation nucléaire de YAP d’une manière indépendante d’Hippo (Elosegui-Artola et al., 2017). De plus, Piezo1, un canal ionique mécanosensible, peut médier les effets de la rigidité du substrat sur la localisation nucléaire du YAP (Pathak et al., 2014).
YAP/TAZ ne sont pas seulement modulés par des forces mécaniques, mais peuvent aussi contribuer en retour à des modifications dans les forces mécaniques dépendantes de l’actomyosine en régulant l’expression des gènes du cytosquelette et de la MEC (Porazinski et al., 2015; Lin et al., 2017; Nardone et al., 2017). De plus, les signaux extracellulaires peuvent activer ou inhiber l’activité YAP/TAZ via les récepteurs couplés aux protéines G (GCPR). Les GTPases Rho médient l’activation de YAP/TAZ par les GPCR, modulant la tension du cytosquelette d’actomyosine (Yu et al., 2012). YAP/TAZ peut aussi indirectement augmenter la rigidité de la MEC ce qui provoque une boucle de rétroaction positive (la rigidité de la MEC activant YAP/TAZ) (Calvo et al., 2013).
En conclusion, YAP/TAZ agissent en tant qu’intégrateurs principaux de stimuli chimiques et mécaniques dans différents contextes biologiques. Ils sont donc impliqués dans de nombreux processus migratoires qui doivent intégrer les signaux biochimiques et biomécaniques. Par exemple, YAP est nécessaire aux mouvements de convergence extension chez le poisson-zèbre, nécessaire à l’allongement de l’embryon selon l’axe antéro-postérieur (Sousa-Ortega et al., 2023).
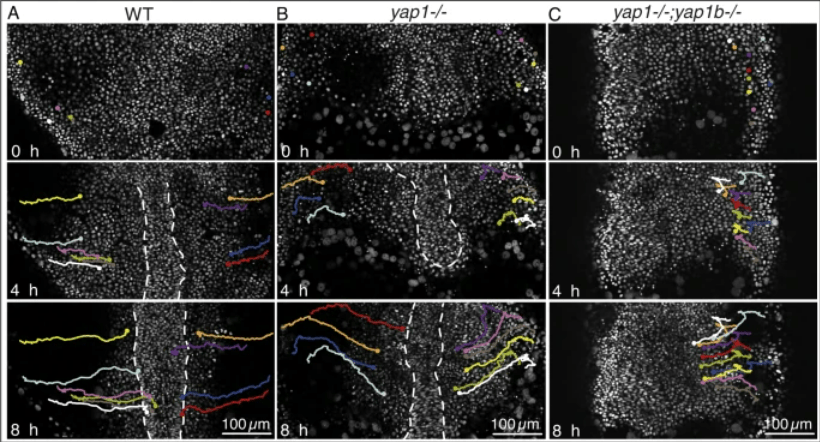
YAP/TAZ dans le contrôle de la prolifération cellulaire pendant le développement
Des études de culture cellulaire montrent que la voie Hippo est activée lorsque la densité cellulaire est importante et que l’inhibition de contact est activée, amenant à arrêter la prolifération. Cette activation de la voie Hippo provoque la destruction de YAP (Kim et al., 2007). La surexpression de YAP permet aux cellules d’ignorer l’inhibition de contact.
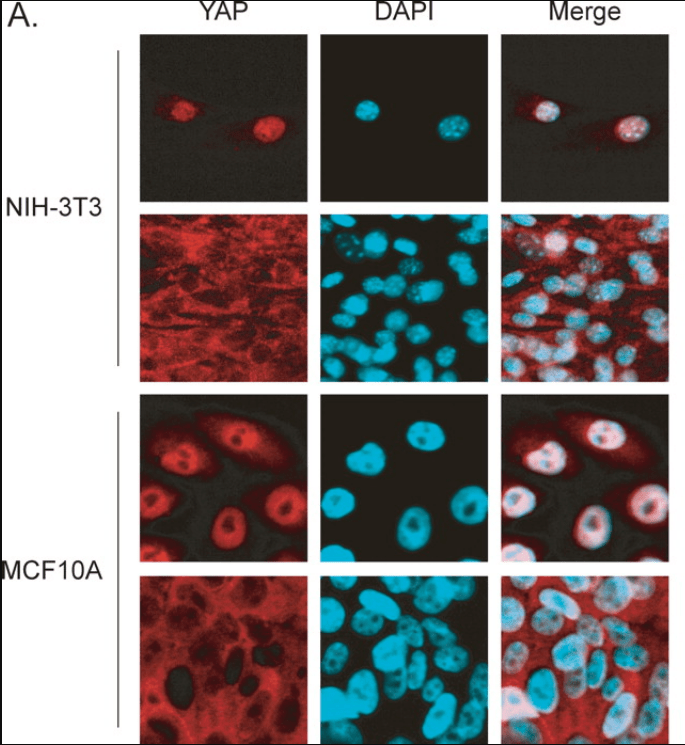
YAP est donc actif dans le noyau en phase proliférative des cellules. Au cours du développement embryonnaire, YAP et également TAZ sont des régulateurs de la prolifération cellulaire et de la croissance tissulaire (Camargo et al., 2007 ; Lei et al., 2008 ; Ota et Sasaki, 2008). YAP/TAZ déclenchent la prolifération des progéniteurs mésenchymateux gastro-intestinaux (Cotton et al., 2017) et des cellules de la crête neurale crânienne (Wang et al., 2016). YAP à lui seul contrôle également la prolifération des cardiomyocytes avec l’aide de TEAD (Ota et Sasaki, 2008; Heallen et al., 2011) et des cellules épithéliales pulmonaires (Lin et al., 2017).
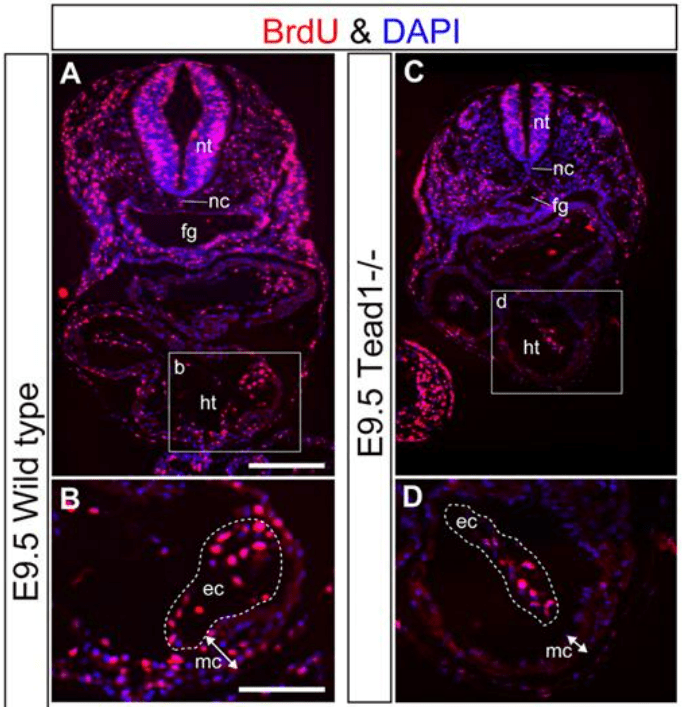
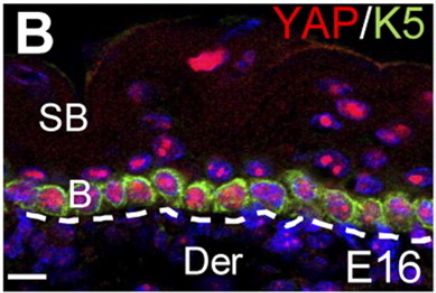
Dans l’épiderme, la localisation nucléaire de YAP/TAZ est limitée à la couche basale, et la vitesse du cycle cellulaire des cellules souches épidermiques est corrélée à sa localisation nucléaire. Les souris avec une perte-de-fonction de YAP spécifique à l’épiderme présentent une hypoplasie épidermique sévère due à une prolifération insuffisante des cellules souches, tandis que l’expression d’un mutant YAP constitutivement actif (YAP-Ser127Ala) induit un épaississement de l’épiderme résultant d’une prolifération accrue et d’une différenciation terminale réduite (Rognoni et al., 2019; Zhang et al., 2011).
De plus, YAP-TEAD maintient les progéniteurs de l’oreille interne grâce à l’activation des gènes du cycle cellulaire (Gnedeva et al., 2020). Dans le même ordre d’idée, YAP/TAZ régulent la prolifération cellulaire dans les progéniteurs neuraux de la moelle épinière de poulet en maintenant leurs propriétés de cellules souches par l’activation du régulateur du cycle cellulaire cyclinD1 et l’inhibition du marqueur de différenciation neurale NeuroM (Cao et al., 2008). La signalisation YAP/TAZ-TEAD régule également la prolifération des progéniteurs neuraux dans le cerveau embryonnaire des mammifères (Han et al., 2015). YAP/TAZ stimulent l’expansion des progéniteurs neuraux dans l’hippocampe en aval de NF2 (Lavado et al., 2013) et maintiennent les progéniteurs neuraux dans le cortex en développement en activant la transcription des gènes de prolifération et en empêchant la différenciation neurale (Lavado et al., 2018). Parallèlement, YAP maintient également les propriétés prolifératives des progéniteurs basaux dans le cortex humain (Kostic et al., 2019). Enfin, YAP/TAZ-TEAD entraîne la prolifération de progéniteurs neuraux dans le cerveau postérieur du poisson zèbre en aval de la tension de l’actomyosine (Voltes et al., 2019). Bien que YAP/TAZ jouent un rôle essentiel dans la croissance des tissus au cours du développement embryonnaire, ils ne sont pas nécessaires à la physiologie normale dans la plupart des tissus adultes. Ainsi, alors que la surexpression de YAP/TAZ a un effet important sur l’hyperprolifération tissulaire et la promotion de la réparation tissulaire après une blessure, la suppression de YAP/TAZ dans de nombreux contextes adultes n’a pas d’effet sur la prolifération tissulaire. En conclusion, YAP/TAZ jouent un rôle crucial dans l’auto-renouvellement des cellules progénitrices au cours du développement embryonnaire.
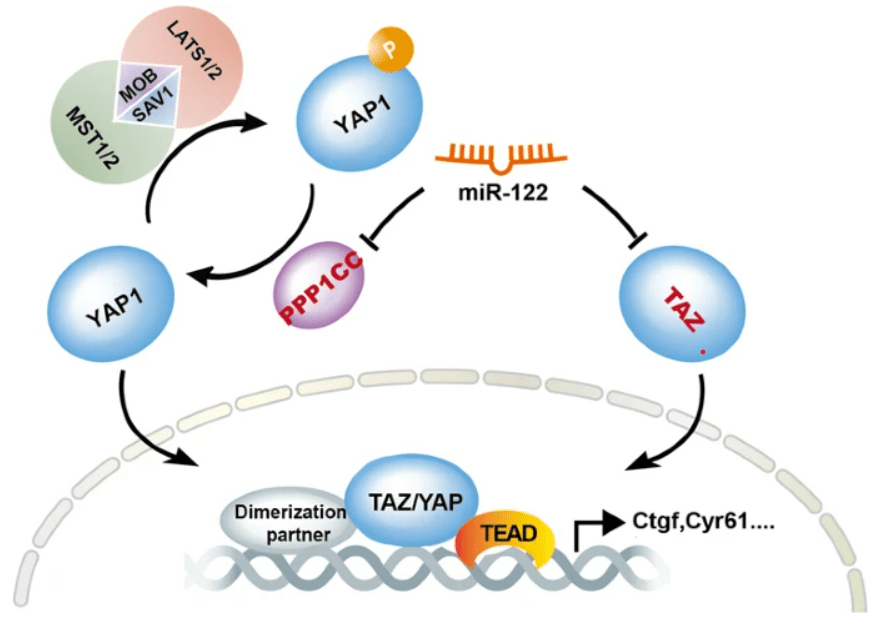
Une inhibition de YAP/TAZ aboutit donc à la fin de la prolifération et permet la différenciation. Cela a été bien démontré au cours du développement des hépatocytes où un miARN, miR-122, inhibe la traduction de deux composants de la voie : TAZ et la phosphatase PPP1CC (qui déphosphoryle YAP1 et lui permet d’échapper à la dégradation). miR-122 s’oppose ainsi à YAP/TAZ qui sont nécessaires pour la prolifération des précurseurs des hépatocytes (Zhang et al., 2021).
Rôle de YAP et TAZ dans la détermination cellulaire
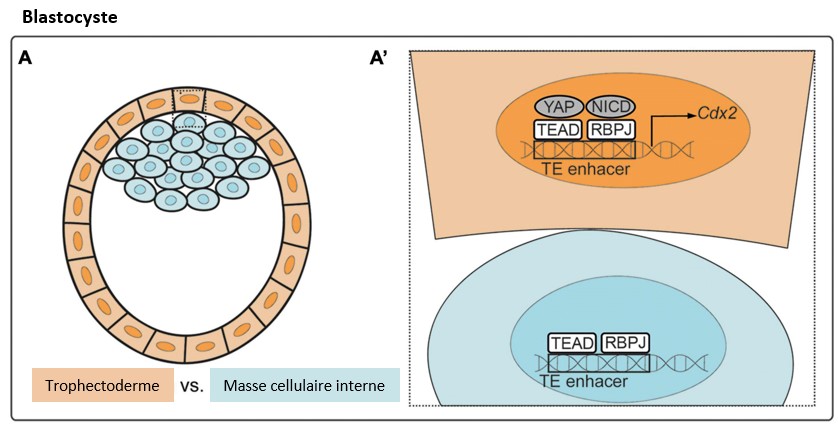
La voie Hippo a un rôle fondamental dans la première détermination cellulaire au cours du développement des Mammifères : les cellules du blastocyste au stade 64 cellules deviennent soit des cellules du trophectoderme, soit des cellules de la masse cellulaire interne.
Il semble que ce soit la forme des cellules liées à leur position qui est à l’origine de cette dichotomie et donc c’est une conséquence d’une mécanotransduction (ce qui nous rapproche d’une partie évoquée plus haut). Les cellules apolaires, à l’intérieur du blastocyste activent la kinase STK3/MST qui phosphoryle le facteur de transcription YAP1 ce qui le retient dans le cytoplasme. Dans les cellules polarisées du bord du blastocyste, STK3/MST est moins activé et donc YAP1 peut entrer dans le noyau et, avec TEAD4, il active l’expression du facteur de transcription Cdx2. Cdx2 supprime l’expression des gènes codant les facteurs de pluripotence Oct4 et Nanog, et active l’expression de diverses protéines nécessaires à la différenciation du trophectoderme.
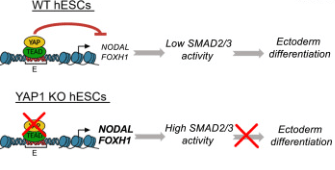
Dans des gastruloïdes en 2D générés à partir de cellules souches humaines, YAP1 est nécessaire à la mise en place de l’ectoderme. En absence de YAP, du mésoderme et de l’endoderme se forme à son détriment. YAP est nécessaire pour limiter l’activation de la voie de signalisation Nodal et ainsi permettre à de l’ectoderme d’être déterminé (Stronati et al., 2022).
- Adhérences cellule-cellule
- Arabidopsis thaliana
- Axe antéro-postérieur chez la drosophile
- Biomécanique du développement
- Caenorhabditis elegans
- Concepts principaux
- Contrôle de la traduction
- Contrôle de la transcription
- Contrôle génétique et épigénétique
- Croissance du tube pollinique et double fécondation chez les Angiospermes
- Croissance et guidage axonal
- Des modèles animaux moins classiques
- Développement de l’oeil des Vertébrés
- Développement et évolution
- Et l’Humain ?
- Exercices sur l’ovogenèse, la spermatogenèse et la fécondation
- Exercices sur le contrôle de l’expression des gènes
- Exercices sur le développement des bourgeons de membre
- Exercices sur le développement des muscles striés squelettiques
- Exercices sur le développement des végétaux et les hormones végétales
- Exercices sur les cycles et les divisions cellulaires
- Exercices sur les étapes du développement, les inductions embryonnaires et la mise en place des axes de polarité
- Exercices sur les matrices extracellulaires, le cytosquelette et les adhérences cellule-cellule
- Exercices sur les voies de signalisation
- Glossaire
- Glossaire des termes liés à la génétique
- Glossaire des termes liés au cytosquelette, la matrice extracellulaire, l’adhérence et la migration cellulaire
- Hématopoïèse et développement des cellules du système immunitaire
- Histoire de la biologie cellulaire et de la biologie du développement
- L’acide rétinoïque
- L’apoptose
- L’autophagie
- L’organogenèse
- L’ovogénèse prépare le développement embryonnaire
- La drosophile
- La fécondation
- La formation des somites
- La gastrulation
- La gastrulation (version allégée)
- La métamorphose chez les Hexapodes et les Amphibiens
- La neurogénèse chez les mammifères adultes
- La neurulation
- La poule
- La signalisation calcique
- La souris
- La superfamille TGFβ et ses voies de signalisation
- La voie de signalisation de l’auxine et ses rôles
- La voie de signalisation Hedgehog
- La voie de signalisation Notch
- Le clivage
- Le cytosquelette
- Le destin des cellules et les réseaux de régulation génique
- Le développement des bourgeons de membre
- Le développement des muscles striés squelettiques
- Le développement des organes génitaux et des cellules germinales
- Le développement du cortex
- Le méristème apical caulinaire en phase végétative et lors de la formation d’une fleur
- Le poisson zèbre
- Le xénope
- Les cellules des crêtes neurales
- Les cellules et les gènes en action dans le développement
- Les cellules souches
- Les cellules tumorales
- Les cycles et les divisions cellulaires
- Les étapes du développement
- Les étapes du développement embryonnaire d’Arabidopsis thaliana et leur contrôle
- Les inductions embryonnaires et les gradients de morphogène
- Les matrices extracellulaires animales
- Les organismes modèles
- Les outils pour étudier l’expression et la fonction des gènes
- Les parois des cellules végétales
- Les techniques et les outils pour la biologie cellulaire
- Les transitions épithélio-mésenchymateuses et les migrations cellulaires
- Les vésicules extracellulaires
- Les voies de signalisation
- Les voies de signalisation FGF
- Mise en place des axes chez les Vertébrés
- Structures et processus cellulaires
- Voies de signalisation WNT
