Par Patrick Pla, Université Paris-Saclay
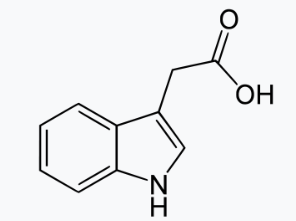
Le petit composé acide indole-3-acétique (IAA ou auxine et qui a un pKa = 4,7) est une molécule connue depuis les années 1930. Il joue un rôle essentiel dans la régulation de la croissance et du développement des plantes. Un système élaboré de transporteurs d’entrée et de sortie cellulaire régule la distribution de l’auxine dans les tissus végétaux. Les changements induits par l’auxine dans l’expression des gènes médient de très nombreuses réponses en aval qui dépendent du contexte cellulaire.
- Synthèse et transport de l’auxine
- Réception de l’auxine et voies de transduction du signal
- L’auxine et le phototropisme et le gravitropisme
- L’auxine et les racines secondaires
- L’auxine et l’expansion de la paroi
- L’auxine et la dominance apicale
- L’auxine et le développement des fruits
Synthèse et transport de l’auxine
La principale auxine naturelle, l’acide indole-3-acétique (IAA) est en grande majorité synthétisée par la voie de l’acide indole-3-pyruvique (IPA) dépendant du tryptophane (Korasick et al., 2013). TRYPTOPHAN AMIDOTRANSFERASE OF ARABIDOPSIS1 (TAA1) et les protéines apparentées (TAR) convertissent le tryptophane en IPA (Stepanova et al., 2008). Une voie partant du tryptophane mais indépendante de la première permet de produire IAOx (indole-3-acetaldoxime) via les cytochromes P450 monooxygénases CYP79B2 et CYP79B3. L’importance physiologique de la biosynthèse de l’IAA dépendante de l’IAOx a été démontrée par l’analyse des doubles mutants cyp79b2; cyp79b3, qui ont des hypocotyles plus courts et des niveaux d’IAA réduits lorsqu’ils sont cultivés à des températures élevées (Zhao et al., 2002).

YUCCA est une famille de gènes codant des flavine-monooxygénases qui catalysent la N-hydroxylation de la tryptamine, une étape qui mène aussi à la production de IAOx. Le mutant gain-de-fonction yucca présente un phénotype indiquant une surproduction d’IAA : ces mutants, quand ils sont cultivés à la lumière, ont des hypocotyles allongés et des cotylédons courbés vers le bas (épinastie). Ce mutant s’est avéré avoir des niveaux endogènes élevés d’IAA libre résultant d’une transcription accrue du gène YUCCA (Cheng et al., 2006). Le contrôle de l’expression des protéines YUCCA est impliqué dans la croissance des feuilles via leurs effets sur la synthèse d’IAA et le facteur de transcription PLETHORA est un des acteurs majeurs de ce contrôle (Pinon et al., 2012). Les facteurs de transcription de type hélice-boucle-hélice basique, PIF4 et PIF5, par la régulation de TAA1 et YUCCA8, intègrent la température dans la voie de signalisation de l’auxine pour contrôler la croissance de l’hypocotyle d’Arabidopsis.
L’IAA peut être modifié/inactivé de plusieurs manières, notamment par oxydation ou par conjugaison d’acides aminés et de glucides.
Une fois les auxines synthétisées, elles doivent être distribuées de manière différentielle dans les différents tissus de la plante. Le transport polarisé de l’auxine a été mis en évidence en 1932 par Van der Weijl grâce à des expériences où des blocs de gélose avec ou sans auxine sont apposés sur des apex de germination. Le dosage de l’auxine dans la gélose une heure après leur apposition a montré que l’auxine est toujours transportée de la région apicale vers la région basale (mais jamais dans le sens inverse) et ce, indépendamment de la gravité.
Les auxines peuvent se déplacer à longue distance dans le phloème ou de proche en proche via un système de transport de cellule à cellule (Habets et Offringa, 2014). La vitesse moyenne de déplacement de l’auxine est de 1 cm/h. Ce transport est requis pour l’accumulation locale d’auxine et la génération de gradients pendant les stades de croissance et de développement (Geisler et al. 2014; Soriano et al. 2014).

L’IAA peut se déplacer à travers la membrane plasmique par diffusion passive sous sa forme non chargée (IAAH), alors que sous sa forme anionique (IAA-), il nécessite des transporteurs spécifiques d’efflux et d’influx d’auxine (Petra´sˇek et Friml 2009).
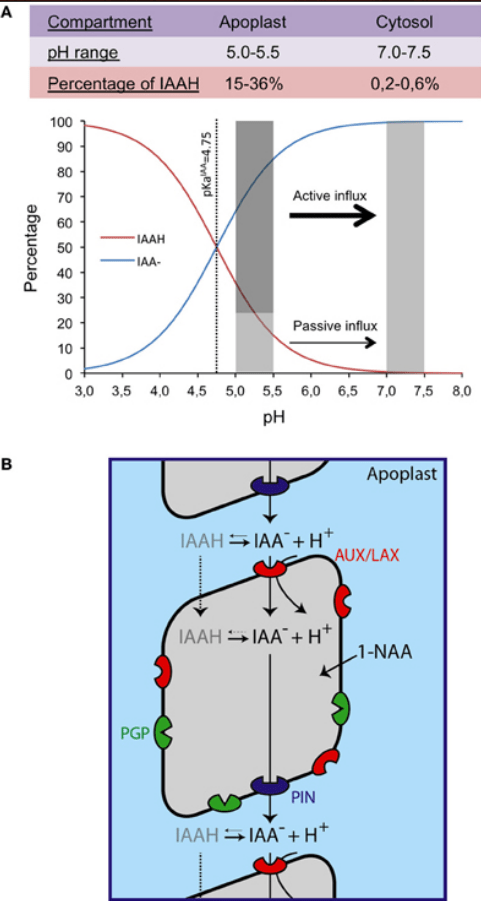
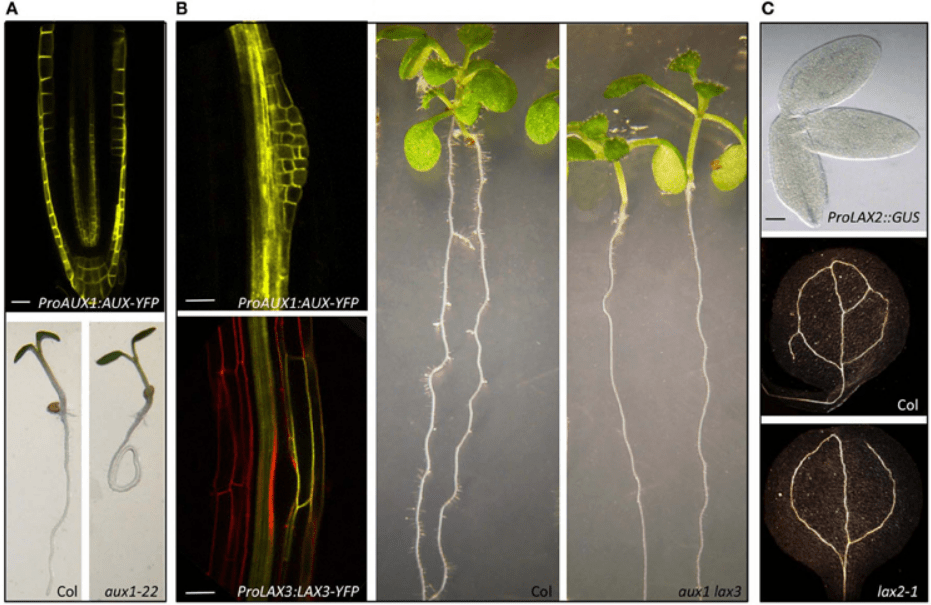
Les transporteurs d’influx sont constitués par AUX1 et ses protéines apparentées LIKE AUX1 (AUX/LAX).
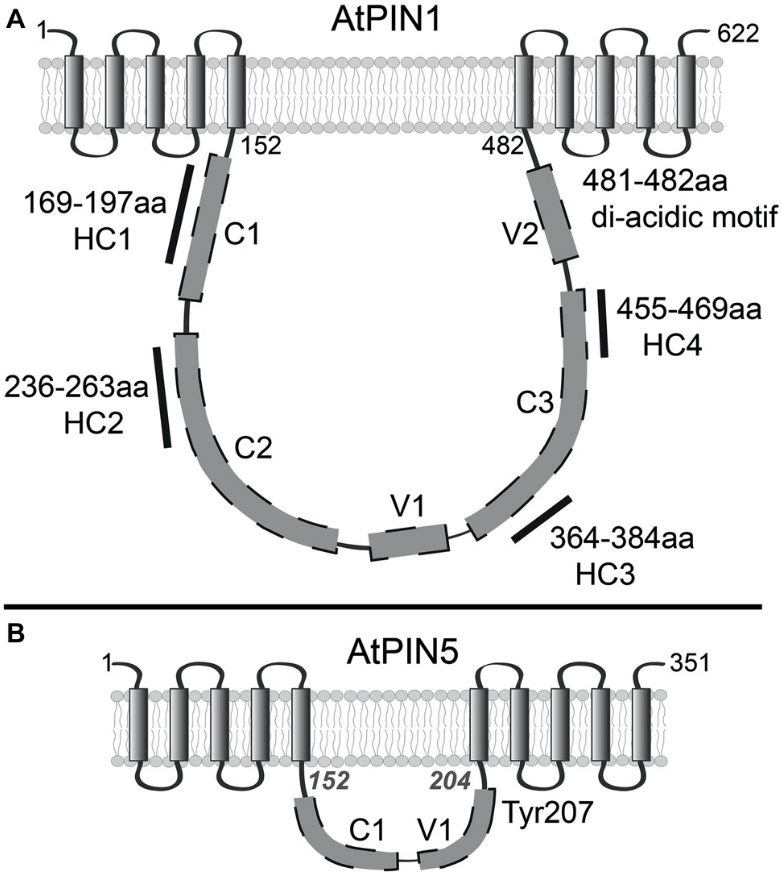
L’exportation de l’auxine hors des cellules dépend des transporteurs PIN (Adamowski et Friml, 2015). Leur importance physiologique est soulignée par des phénotypes mutants perte-de-fonction pin souvent sévères, qui peuvent être imités par l’application d’acide naphtylphtalamique (NPA), souvent utilisé en expérimentation, qui est un inhibiteur compétitif des PIN. La famille des protéines PIN est exclusive au règne végétal. Elles ont dix hélices transmembranaires comprenant deux domaines à cinq hélices transmembranes séparées par une boucle cytosolique. Les PIN canoniques (PIN1–4 et PIN7 chez A. thaliana) sont caractérisés par une longue boucle (323–355 résidus) et sont principalement situés dans la membrane plasmique, tandis que les PIN non canoniques (PIN5, PIN6 et PIN8) possèdent une boucle beaucoup plus courte et peuvent être trouvés dans les membranes du réticulum endoplasmique. Ils pourraient jouer un rôle de régulation du stockage de l’auxine.
Chaque transporteur PIN a un profil d’expression différent et un fonctionnement spécifique. Par exemple dans les racines, les protéines PIN1, PIN3 et PIN7 des tissus vasculaires et PIN2 du cortex dirigent l’auxine vers l’apex radiculaire, tandis que la protéine PIN2 des cellules épidermiques redirige l’auxine vers les tissus internes. La protéine PIN2 présente un taux de transport plus lent que les protéines PIN1 et PIN3. Cette différence de taux de transport de l’auxine pourrait être cruciale pour réguler la distribution de l’auxine à travers l’apex de la racine, notamment pour le gravitropisme racinaire, probablement car il permet à la persistance de l’auxine dans les cellules épidermiques de diriger la courbure racinaire (Janacek et al., 2024).
Les longues boucles des PIN canoniques ont des sites de phosphorylation qui régulent l’activité ; les boucles sont auto-inhibitrices, nécessitant une activité kinase pour initier le transport.
PID (PINOID) est une sérine/thréonine kinase qui phosphoryle PIN1 (Christensen et al., 2000).

Les mutants perte-de-fonction pinoid (pid) présentent des défauts d’organogenèse apicale similaires à ceux du mutant perte-de-fonction pin1 (Bennett et al. 1995). Des études complémentaires ont montré que la phosphorylation de PIN1 par PINOID aboutit à une localisation cellulaire différente de la protéine de transport (localisation apicale plutôt que basale), ce qui limite le transport habituel de l’auxine (Friml et al., 2004, Michniewicz et al., 2007).
De nombreuses hormones modulent la signalisation de l’auxine en agissant sur les transporteurs PIN.
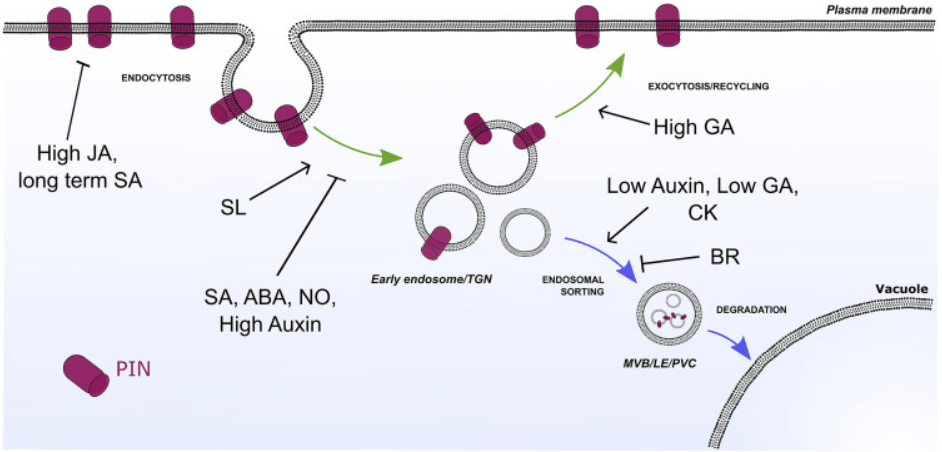
Les transporteurs d’auxine polaire (par exemple les PIN) subissent un recyclage constant entre la membrane plasmique et les compartiments endosomaux (flèches vertes). En réponse à des signaux développementaux ou environnementaux, les niveaux de PIN peuvent être diminués par leur redirection vers la dégradation lytique dans les vacuoles (flèches bleues). Les hormones végétales interfèrent avec différentes étapes de la voie du trafic PIN, contribuant ainsi à affiner le transport de l’auxine et la régulation de la croissance et du développement des plantes. ABA, acide abscissique; BR, brassinostéroïdes ; CK, cytokinines ; GA, acide gibbérellique; JA, acide jasmonique; NO, oxyde nitrique ; SA, acide salicylique ; SL, strigolactones ; LE, endosome tardif ; MVB, corps multivésiculaire ; PVC, compartiment prévacuolaire ; TGN, réseau transgolgien.
Les cytokinines qui agissent autour du méristème racinaire restreignent la signalisation auxine en agissant sur les transporteurs PIN. Les cytokinines sont perçues par le récepteur AHK3 et le signal est transduit par régulateurs ARR1 et ARR12, ce qui active directement la transcription du répresseur IAA3/SHORT HYPOCOTYL 2 (SHY2), qui entraîne l’atténuation des réponses à l’auxine et diminue l’expression des transporteurs PIN (à la fois au niveau de la transcription de leurs gènes et par stimulation de leur endocytose et de leur dégradation), restreignant le transport de l’auxine (Dello Ioio et al., 2008; Ruzicka et al, 2009).
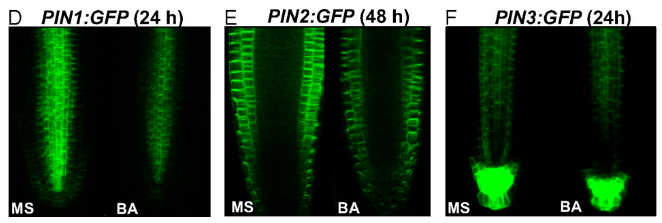
Ainsi, la balance auxine/cytokinines régule la mise en place du méristème apical racinaire et régule le nombre de cellules souches avec l’auxine en faveur du méristème et les cytokinines en opposition par restriction du transport et de l’action de l’auxine.
L’acide abscissique renforce l’action des cytokinines car ses voies de signalisation aboutissent à augmenter l’activité du facteur de transcription ABI4 qui inhibe également l’expression de PIN1 (Shkolnik-Inbar et al., 2011).
Réception de l’auxine et voies de transduction du signal
La présence de l’auxine est transduite dans le noyau par une régulation de la transcription. Dans leur état de repos, les répresseurs AUX/IAA se lient aux facteurs de réponse à l’auxine (ARF) et répriment leur activité en recrutant les co-répresseurs TOPLESS (TPL/TPR). On pense que TPL/TPR agit en recrutant des histones désacétylases, conduisant ainsi la chromatine vers un état répressif (Long et al., 2006 ; Szemenyei et al., 2008). En présence d’auxine, les récepteurs TIR1/AFB se lient aux AUX/IAA et ces derniers sont alors rapidement ubiquitinés et dégradés, libérant ensuite les ARF qui peuvent activer les gènes cibles de l’auxine (Mockaitis et Estelle, 2008).

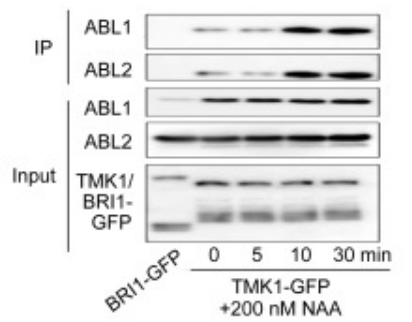
Cependant, certaines actions de l’auxine comme l’entrée de Ca2+ dans le cytoplasme, une hyperpolarisation membranaire, le contrôle de l’endocytose ou l’activation des GTPases ROP sont trop rapides pour ne dépendre que du contrôle de la transcription (Dubey et al., 2021). Il existe donc des récepteurs transmembranaires sensibles à l’auxine extracellulaire et activant des voies de transduction rapides dans la cellule. En présence d’auxine extracellulaire (apoplastique), les protéines extracellulaires ABL1 et ABL2 forment un complexe avec la protéine transmembranaire TMK ce qui active l’activité kinase à son extrémité intracellulaire de TMK (Yu et al., 2023).
L’auxine et le phototropisme et le gravitropisme
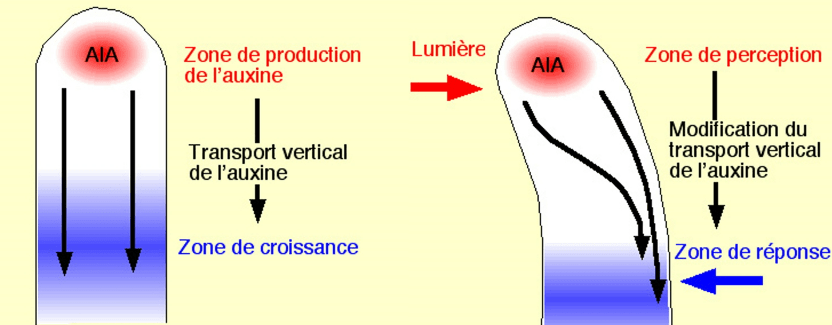
Le phototropisme et le gravitropisme permettent aux tiges et aux racines d’orienter leur croissance en réponse respectivement à la lumière et à la gravité. Ces ajustements adaptatifs de la croissance permettent de mieux recevoir la lumière dans le cas des tiges, et de mieux acquérir de l’eau ou des sels minéraux dans le cas des racines. Les tiges présentent un gravitropisme négatif et poussent vers le haut et un phototropisme positif et orientent préférentiellement leur croissance vers la lumière, tandis que les racines présentent un gravitropisme positif qui se manifeste par leur croissance vers le bas. Les modèles acceptés pour les tropismes sont basés sur la théorie classique de Cholodny-Went, dans laquelle la distribution différentielle de l’auxine cause la croissance inégale des deux côtés d’un organe courbé.
Une asymétrie dans la distribution de l’auxine et de la réponse à l’auxine a été effectivement détectée dans les tiges et les racines de diverses espèces végétales.
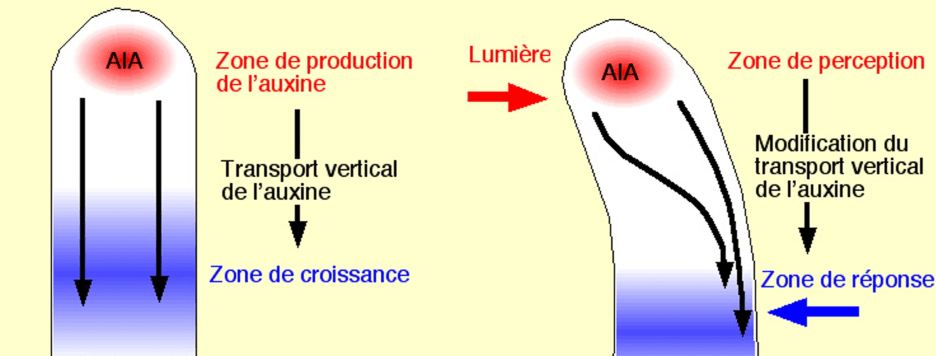
Cette distribution asymétrique de l’auxine est déclenchée par un transport d’auxine intercellulaire directionnel (Briggs, 1963 ; Young et al., 1990 ; Epel et al., 1992 ; Luschnig et al., 1998 ; Rashotte et al., 2000 ; Friml et al., 2002) qui est médié par des transporteurs des familles AUX/LAX (Bennett et al., 1996 ; Yang et al., 2006), PGP (Geisler et Murphy, 2006) et PIN (Petrášek et al., 2006; Yang et Murphy, 2009). La directionnalité du transport d’auxine polaire est déterminée par une localisation subcellulaire polarisée des transporteurs d’efflux d’auxine PIN (Wiśniewska et al., 2006).
Pour le phototropisme, la lumière est perçue par les phototropines qui sont sensibles aux longueurs d’onde correspondant au bleu. Il en existe deux chez les plantes : phot1 et phot2. Sous une lumière bleue de faible intensité , phot1 est le récepteur principal contrôlant le phototropisme, tandis que dans des conditions de lumière bleue modérées à élevées, phot1 et phot2 agissent de manière redondante (Liscum et Briggs, 1995; Sakai et al., 2000, 2001).
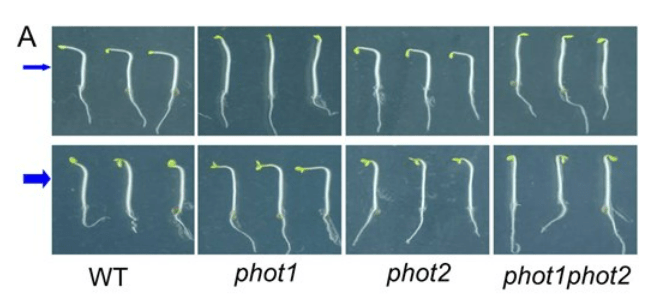
Toutes les phototropines partagent une organisation en domaine similaire : la moitié N-terminale de la protéine contient la région photosensorielle (avec notamment deux domaines, LOV1 et LOV2 auquelles s’ssocient le chromophore FMN (Flavin Mononucleotide), tandis que la moitié C-terminale contient un domaine sérine/thréonine kinase qui permet d’activer les voies de signalisation en aval. Phot1 et phot2 se relocalisent depuis la membrane plasmique vers des emplacements intracellulaires en réponse au la lumière bleu (Sakamoto et Briggs, 2002 ; Kong et al., 2006, 2007 ; Aihara et al., 2008 ; Kong et Nagatani, 2008 ; Wan et al., 2008).
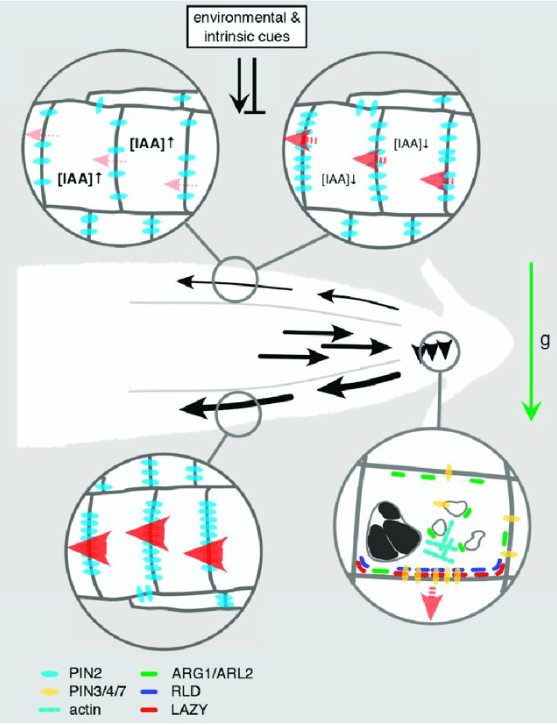
De son côté, la gravité est perçue par la sédimentation d’organites spécialisés contenant de l’amidon (statolithes) dans les cellules de la coiffe racinaire et de l’endoderme de la tige (Morita et Tasaka, 2004 ; Morita, 2010). Dans les cellules de la coiffe racinaire sensibles à la gravité, PIN3 est d’abord localisé symétriquement, mais après la sédimentation des statolithes induite par la gravité, il s’accumule principalement du côté inférieur des cellules (Friml et al., 2002; Harrison et Masson, 2008). Cette localisation asymétrique de PIN3 provoque la redirection du flux d’auxine vers le côté inférieur de la racine, où l’auxine est connue pour s’accumuler en réponse à la gravistimulation (Perrin et al., 2005).
L’auxine et les racines secondaires
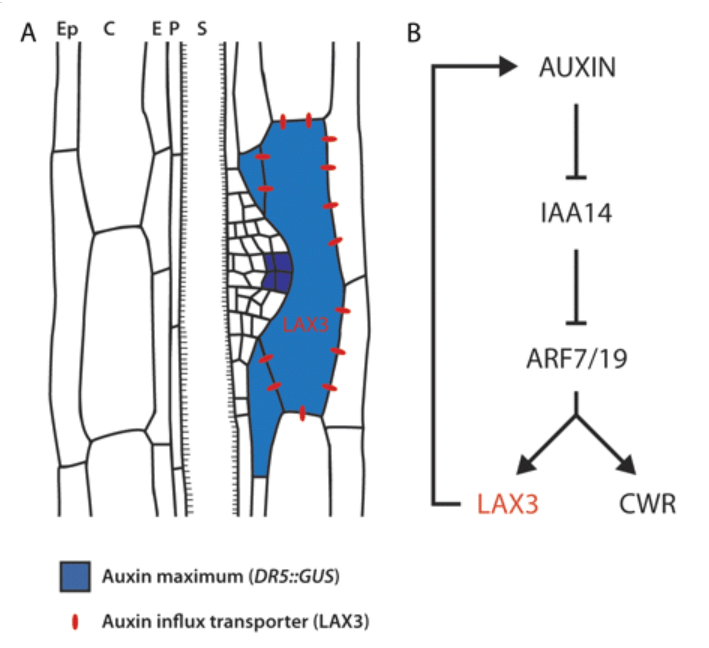
La phase d’initiation des racines secondaires commence lorsque deux cellules adjacentes du péricycle commencent à se diviser de manière asymétrique et créent un primordium (Péret et al., 2009). Ce processus est associé à l’accumulation d’un maximum d’auxine dans les cellules fondatrices du péricycle (Benková et al., 2003; De Smet et al., 2007).
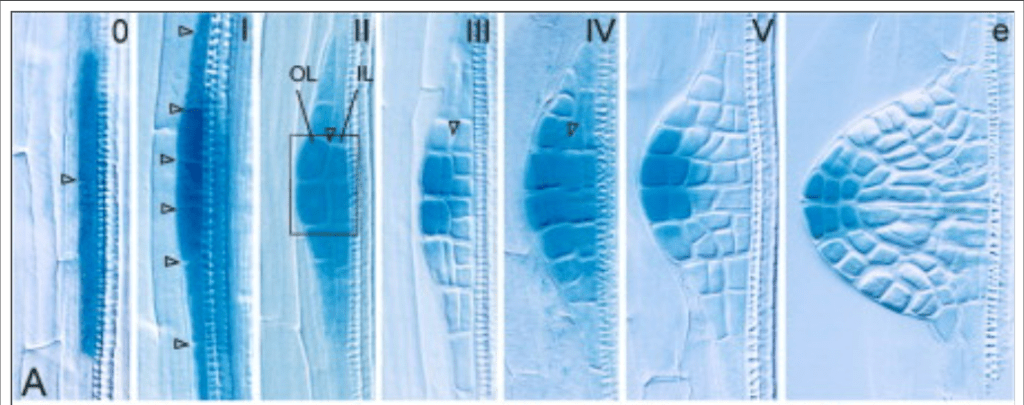
Expression de DR5 :: GUS qui dépend de l’activité de la voie de signalisation de l’auxine au cours du développement de l’ébauche des racines secondaires : le gradient d’activité de l’auxine avec le maximum à la pointe de l’ébauche est progressivement établi. OL et IL, couches externes et internes. Source : https://www.cell.com/cell/fulltext/S0092-8674(03)00924-3
Les transporteurs d’entrée (ou d’influx) de l’auxine dans la cellule sont impliqués dans la régulation du développement des racines secondaires. Par exemple, AUX1 est exprimé dans les cellules du péricycle avant la première division asymétrique initiale. Le mutant aux1 présente une réduction de 50% du nombre de racines secondaires (Hobbie et Estelle, 1995; Marchant et al., 2002).

L’auxine joue également un rôle dans les cellules endodermiques recouvrant
les ébauches des racines secondaires pour les adapter au passage de ces racines grâce à une perte de volume contrôlée (Vermeer et al., 2014). La destruction des adhérences cellulaires dans les tissus recouvrant
l’endoderme est également médié par l’auxine, permettant ainsi à la racine secondaire en croissance de traverser le cortex et l’épiderme (Swarup et al., 2008).
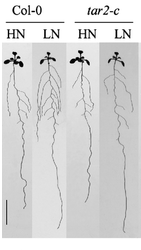
Lorsqu’il existe un déficit modéré en nitrate dans le sol, Arabidopsis forme des racines avec une quantité plus importante de racines secondaires. Cela est du à une plus importante concentration d’auxine dans la racine par une stimulation du transport de l’auxine des parties aériennes vers les parties racinaires. A l’inverse, un excès de nitrate inhibe ce transport (Tian et al., 2008). En cas de déficit de nitrates, il y a aussi une production racinaire plus importante d’auxine par l’augmentation de l’expression de TAR2, une enzyme intervenant dans sa biosynthèse, dans le péricycle et les éléments vasculaires (Ma et al., 2014).
L’auxine et l’expansion de la paroi
L’élongation cellulaire est un des paramètres importants de la croissance des végétaux. Le moteur de cette élongation est la pression osmotique générée par l’accumulation d’eau (à la suite de l’accumulation d’ions) dans la vacuole (pression de 0,2 à 1 MPa) qui induit une turgescence. La pression générée est accompagnée de modifications de la paroi cellulaire.
L’auxine à de fortes concentrations a surtout un rôle positif sur l’élongation cellulaire dans la tige et un rôle inhibiteur dans la racine.

Dans la tige, l’auxine induit une expansion cellulaire rapide et cela peut être mimé par exemple en incubant des segments d’hypocotyle dans un milieu acide (pH 4,5). Cependant, l’action des protons n’est pas directe sur les composants de la paroi car l’expansion en milieu acide n’a pas lieu si les hypocotyles ont été traités au préalable avec des protéases. On en déduit le modèle suivant : l’auxine agit en acidifiant l’apoplasme où se trouve la paroi cellulaire, ce qui entraîne l’activation de protéines localisées dans la paroi qui lui permettent de se relâcher avec la pression de turgescence. Il s’agit d’un mécanisme de croissance connu sous le nom de « théorie de la croissance acide » qui date des années 1970.

Dans la tige, l’auxine déclenche l’efflux de protons, en activant la H+-ATPase de type P localisée dans la membrane plasmique. Chez Arabidopsis, les H+-ATPases sont codées par une famille de gènes qui comprend 11 membres appelés AHA. A la suite de la présence d’auxine, la phosphorylation de l’avant-dernier résidu Thr conservé (Thr948 dans AHA1, Thr947 dans AHA2) invalide l’autoinhibition de l’activité de la pompe ATPase par la région C-terminale cytoplasmique. L’auxine induit l’expression dépendante de TIR1/AFB des protéines SAUR qui agissent comme des inhibiteurs des phosphatases PP2C.D, qui sont responsables de la déphosphorylation de l’avant-dernier résidu des pompes. La signalisation auxine active donc des inhibiteurs des inhibiteurs des H+-ATPases. En parallèle, la signalisation activée par l’auxine stimule l’activité des kinases TMK qui phosphorylent l’avant-dernière Thr des pompes à protons (Lin et al., 2021).

En parallèle, l’auxine stimule également l’exocytose de vésicules qui contiennent des pompes à H+ enrichissant ainsi la membrane plasmique et permettant une acidification de la paroi encore plus importante. L’auxine diminue également l’endocytose des pompes à H+ en inhibant l’expression de la protéine de type SNARE SYP132 qui est impliquée dans ce processus (Xia et al., 2019).

Les protéines activées par la baisse de pH dans la paroi en réponse à l’auxine sont principalement les expansines.
Outre les expansines, l’acidité pariétale active aussi les xyloglucanes endotransglycosylases (XET) qui hydrolysent le squelette des xyloglucanes. Elles permettent l’insertion de nouvelles molécules de xyloglucanes permettant la croissance.
A plus long terme, l’auxine agit en faveur de la croissance cellulaire en stimulant la transcription des gènes codant les expansines ou les enzymes de synthèse des glucides pariétaux.
Le rôle de l’auxine dans l’expansion de la paroi intervient lors du phototropisme. Par exemple, un coléoptile de Graminée est attiré par la lumière. Si cette lumière est latérale par rapport à l’axe vertical, il y aura plus de croissance du côté opposé à la source de lumière ce qui va favoriser la courbure en direction de la source lumineuse. Cette croissance différentielle est due au transport latéral de l’auxine de la zone éclairée vers la zone moins éclairée.
L’auxine et la dominance apicale
La présence du bourgeon terminal ou apical provoque la dormance des bourgeons axillaires en dessous. Si on supprime la partie apicale (contenant le bourgeon terminal) alors les bourgeons axillaires se réveillent et commencent leur croissance. C’est ce que l’on appelle la dominance apicale.
Historiquement, R. Snow en 1925 a montré que le maintien de la dominance apicale nécessite un signal qui se déplace vers le bas à partir du bourgeon apical. Thimann et Skoog (1933) ont identifié l’auxine comme le signal inhibiteur descendant. L’élimination de la source d’auxine apicale par décapitation abolit la dominance apicale, tandis que l’application d’auxine à l’apex de ces plantes décapitées peut restaurer cette dominance. Cependant, l’effet inhibiteur de l’auxine n’est pas direct. Il a été démontré que l’application externe d’auxine sur les bourgeons axillaires n’empêche pas leur croissance et des expériences avec de l’auxine radiomarquée ont révélé que l’auxine dérivée de l’apex ne pénètre pas dans le bourgeon dormant. De plus, le transport de l’auxine semble être trop lent pour provoquer un effet direct (Booker et al., 2003). À la suite de ces études, un second messager longue distance a été recherché.
Les cytokinines sont produites dans les racines et la tige et transportée vers le haut (de manière acropète) dans le xylème (Nordstrom et al., 2004). Les manipulations de la teneur en cytokinines végétales montrent des effets clairs sur le contrôle de la croissance des bourgeons, par exemple, l’application de cytokinine sur les bourgeons axillaires libère la dormance même chez les plantes qui ont un apex intact (Sachs et Thimann, 1964). Les cytokinines agissent donc de manière antagoniste à l’auxine. L’auxine inhibe la biosynthèse des cytokinines en diminuant l’expression du gène codant une enzyme de biosynthèse de la cytokinine ISOPENTENYLTRANSFERASE (IPT) dans la tige (Tanaka et al., 2006) et ce qui est cause en grande partie la dominance apicale. De plus, il a été montré pour les tiges de pois que l’auxine induit le gène de la cytokinine oxydase PsCKX2 (Shimizu-Sato et al., 2009). Les cytokinines oxydases inactivent les cytokinines et, par conséquent, réduisent le pool de cytokinine active.
Même si le bourgeon apical est présent, les bourgeons axillaires à une plus grande distance de lui peuvent également se réveiller, stimulés par les cytokinines provenant des racines. En fait, tout dépend du rapport auxine/cytokinines avec un rapport bas pour que les bourgeons axillaires puissent se développer.
L’auxine et le développement des fruits
De par ses propriétés activatrices de l’expansion et de la maturation de la paroi, l’auxine est également impliquée dans la croissance des fruits.
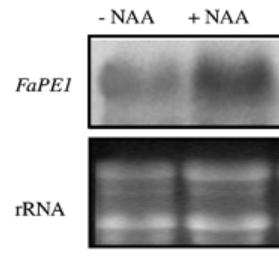
Lors du développement des fruits, des nouveaux éléments de la paroi doivent être ajoutés, notamment des pectines qui doivent être estérifiées pour jouer leur rôle. L’expression de la pectine estérase FaPE1 est activée par l’auxine (Castillejo et al., 2004).
Lors du murissement avancé du fruit, les pectines sont solubilisées et dépolymérisées. A ce moment, l’auxine n’agit plus et c’est l’éthylène qui participe à ce processus qui peut aboutir au ramollissement et au pourrissement du fruit.
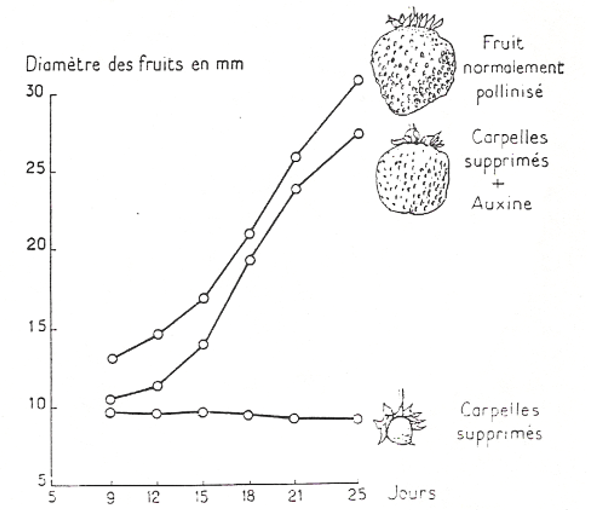
Avant la pollinisation, la croissance des fruits est réprimée par le ou les complexes protéiques Aux/IAA–ARF, qui inhibent l’expression des gènes sensibles à l’auxine. La pollinisation et la fécondation augmentent les niveaux d’auxine dans l’ovaire et induisent la polyubiquitination et la dégradation ultérieure des protéines Aux/IAA.

Les applications d’auxines synthétiques peuvent induire le développement parthénocarpique des fruits chez l’aubergine et la tomate. Le développement parthénocarpique des fruits peut également être induit par l’augmentation des niveaux d’auxine dans les ovaires par l’expression ectopique du gène codant une enzyme de biosynthèse de l’auxine chez l’aubergine et la tomate (Ficcadenti et al., 1999).
- Adhérences cellule-cellule
- Arabidopsis thaliana
- Axe antéro-postérieur chez la drosophile
- Biomécanique du développement
- Caenorhabditis elegans
- Concepts principaux
- Contrôle de la traduction
- Contrôle de la transcription
- Contrôle génétique et épigénétique
- Croissance du tube pollinique et double fécondation chez les Angiospermes
- Croissance et guidage axonal
- Des modèles animaux moins classiques
- Développement de l’oeil des Vertébrés
- Développement et évolution
- Et l’Humain ?
- Exercices sur l’ovogenèse, la spermatogenèse et la fécondation
- Exercices sur le contrôle de l’expression des gènes
- Exercices sur le développement des bourgeons de membre
- Exercices sur le développement des muscles striés squelettiques
- Exercices sur le développement des végétaux et les hormones végétales
- Exercices sur les cycles et les divisions cellulaires
- Exercices sur les étapes du développement, les inductions embryonnaires et la mise en place des axes de polarité
- Exercices sur les matrices extracellulaires, le cytosquelette et les adhérences cellule-cellule
- Exercices sur les voies de signalisation
- Glossaire
- Glossaire des termes liés à la génétique
- Glossaire des termes liés au cytosquelette, la matrice extracellulaire, l’adhérence et la migration cellulaire
- Hématopoïèse et développement des cellules du système immunitaire
- Histoire de la biologie cellulaire et de la biologie du développement
- L’acide rétinoïque
- L’apoptose
- L’autophagie
- L’organogenèse
- L’ovogénèse prépare le développement embryonnaire
- La drosophile
- La fécondation
- La formation des somites
- La gastrulation
- La gastrulation (version allégée)
- La métamorphose chez les Hexapodes et les Amphibiens
- La neurogénèse chez les mammifères adultes
- La neurulation
- La poule
- La signalisation calcique
- La souris
- La superfamille TGFβ et ses voies de signalisation
- La voie de signalisation Hedgehog
- La voie de signalisation Hippo et ses composants YAP/TAZ
- La voie de signalisation Notch
- Le clivage
- Le cytosquelette
- Le destin des cellules et les réseaux de régulation génique
- Le développement des bourgeons de membre
- Le développement des muscles striés squelettiques
- Le développement des organes génitaux et des cellules germinales
- Le développement du cortex
- Le méristème apical caulinaire en phase végétative et lors de la formation d’une fleur
- Le poisson zèbre
- Le xénope
- Les cellules des crêtes neurales
- Les cellules et les gènes en action dans le développement
- Les cellules souches
- Les cellules tumorales
- Les cycles et les divisions cellulaires
- Les étapes du développement
- Les étapes du développement embryonnaire d’Arabidopsis thaliana et leur contrôle
- Les inductions embryonnaires et les gradients de morphogène
- Les matrices extracellulaires animales
- Les organismes modèles
- Les outils pour étudier l’expression et la fonction des gènes
- Les parois des cellules végétales
- Les techniques et les outils pour la biologie cellulaire
- Les transitions épithélio-mésenchymateuses et les migrations cellulaires
- Les vésicules extracellulaires
- Les voies de signalisation
- Les voies de signalisation FGF
- Mise en place des axes chez les Vertébrés
- Structures et processus cellulaires
- Voies de signalisation WNT
