Par Patrick Pla, Université Paris-Saclay

La poule est un modèle accessible et ancien de la biologie du développement. Aristote (384-322 avant JC) avait brièvement décrit son développement. Marcello Malpighi (1628-1694) a publié le premier compte rendu microscopique de son développement en 1672.

C’est dans un embryon de poule que l’embryologiste russe Pander a décrit pour la première fois les trois feuillets (ectoderme, mésoderme et endoderme) au début du XIXème siècle.
La maturité sexuelle de la poule est atteinte 17 semaines après l’éclosion. Bien que les voies génitales et les ovaires se forment des deux côtés au cours du développement embryonnaire, ceux de droite dégénèrent ne laissant qu’un appareil reproducteur complet à gauche.
La poule domestique réalise une ponte par jour presque tout au long de l’année, un processus issu de la sélection artificielle par l’Homme au cours de sa domestication. Les oiseaux sauvages ne pourraient se payer le luxe de perdre ainsi chaque jour des réserves précieuses alors qu’il n’y aura pas de fécondation dans la majorité des cas !
Les premières phases du développement de la poule sont relativement inaccessibles car elles ont lieu avant la ponte durant le trajet de l’embryon dans les voies génitales femelles alors que les enveloppes de l’œuf se déposent autour de lui (blanc d’œuf, membranes coquillères et coquille calcaire). Lorsque l’œuf est pondu, 24 heures après la fécondation, l’embryon commence sa gastrulation.
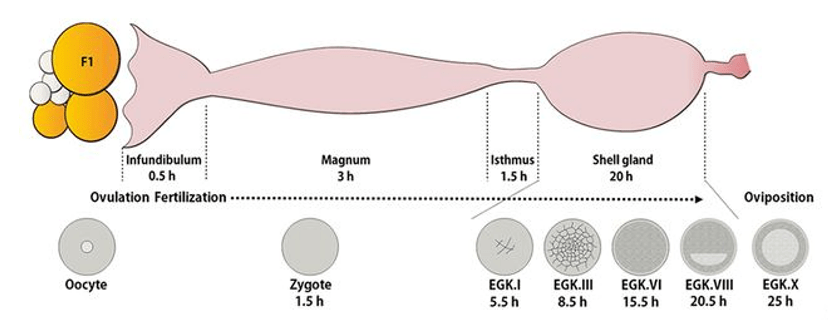
Ouverture d’un oeuf avec un embryon à 2 jours d’incubation (soit 3 jours depuis la fécondation) :


Pour faire des suivis de lignages chez l’embryon de poulet, on peut utiliser la technique de greffe caille-poulet mise au point par Nicole Le Douarin en 1968.

Source : https://embryo.asu.edu/pages/nicole-marthe-le-douarin-1930
Les deux espèces, très proches, ont des développements similaires. On greffe généralement des tissus de caille (donneur) sur un embryon de poulet (receveur), ce qui engendre des chimères parfaitement viables. On peut ensuite suivre le devenir des cellules greffées grâce à un immunomarquage avec un anticorps anti-QCPN (Quail but not Chicken PeriNuclear) qui reconnaît un épitope spécifique de caille.

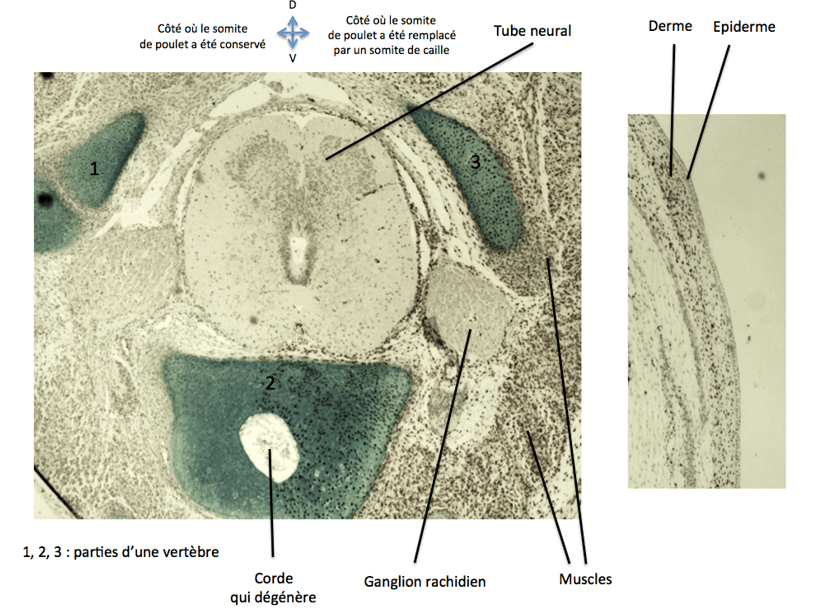
L’embryon de poulet est un mauvais modèle génétique mais on peut réaliser des électroporations in ovo de vecteurs d’expression ou de siARN injectés au préalable dans la lumière du tube neural. Les cellules de la moitié (par exemple la moitié droite) du tube neural sont transfectées et les cellules de l’autre côté servent de témoin.

Dans l’oeuf, l’embryon produit des prolongements, appelés annexes embryonnaires qui lui permettent d’assurer ses fonctions vitales (alimentation, respiration, excrétion…) et d’éviter la dessiccation.

Les annexes embryonnaires du poulet peuvent également servir, par exemple dans le test de la membrane chorioallantoïdienne utilisé en cancérologie pour tester le caractère métastatique de cellules tumorales.
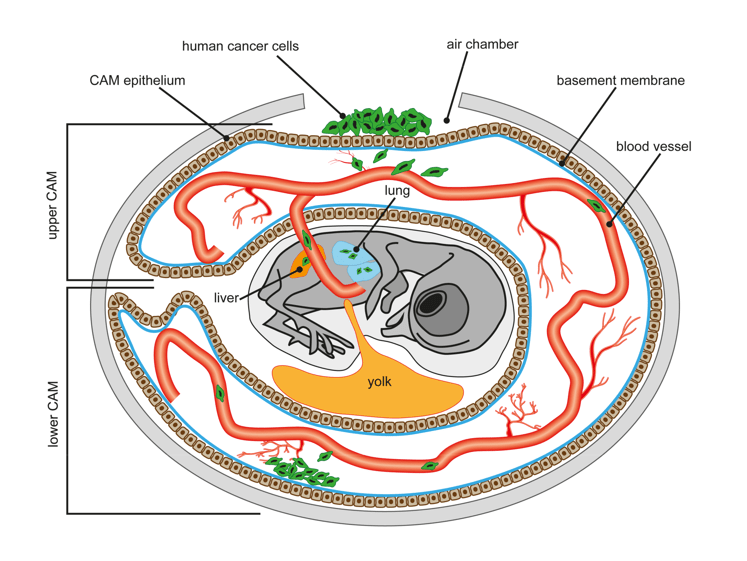
Article pour en savoir plus sur les greffes sur la membrane chorio-alantoïdienne.
RESSOURCES :
Atlas de profils de patrons d’expression de gènes chez l’embryon de poule
EN DIRECT DES LABOS :
QUELQUES EQUIPES DE RECHERCHE FRANCOPHONES QUI TRAVAILLENT SUR CE MODELE :
Equipe « Formation et réparation du système musculo-squelettique » – Institut de Biologie Paris-Seine
Equipe « Hétérogénéité et plasticité au cours de la morphogenèse des Vertébrés » – CBI Toulouse
- Adhérences cellule-cellule
- Arabidopsis thaliana
- Axe antéro-postérieur chez la drosophile
- Biomécanique du développement
- Caenorhabditis elegans
- Concepts principaux
- Contrôle de la traduction
- Contrôle de la transcription
- Contrôle génétique et épigénétique
- Croissance du tube pollinique et double fécondation chez les Angiospermes
- Croissance et guidage axonal
- Des modèles animaux moins classiques
- Développement de l’oeil des Vertébrés
- Développement et évolution
- Et l’Humain ?
- Exercices sur l’ovogenèse, la spermatogenèse et la fécondation
- Exercices sur le contrôle de l’expression des gènes
- Exercices sur le développement des bourgeons de membre
- Exercices sur le développement des muscles striés squelettiques
- Exercices sur le développement des végétaux et les hormones végétales
- Exercices sur les cycles et les divisions cellulaires
- Exercices sur les étapes du développement, les inductions embryonnaires et la mise en place des axes de polarité
- Exercices sur les matrices extracellulaires, le cytosquelette et les adhérences cellule-cellule
- Exercices sur les voies de signalisation
- Glossaire
- Glossaire des termes liés à la génétique
- Glossaire des termes liés au cytosquelette, la matrice extracellulaire, l’adhérence et la migration cellulaire
- Hématopoïèse et développement des cellules du système immunitaire
- Histoire de la biologie cellulaire et de la biologie du développement
- L’acide rétinoïque
- L’apoptose
- L’autophagie
- L’organogenèse
- L’ovogénèse prépare le développement embryonnaire
- La drosophile
- La fécondation
- La formation des somites
- La gastrulation
- La gastrulation (version allégée)
- La métamorphose chez les Hexapodes et les Amphibiens
- La neurogénèse chez les mammifères adultes
- La neurulation
- La signalisation calcique
- La souris
- La superfamille TGFβ et ses voies de signalisation
- La voie de signalisation de l’auxine et ses rôles
- La voie de signalisation Hedgehog
- La voie de signalisation Hippo et ses composants YAP/TAZ
- La voie de signalisation Notch
- Le clivage
- Le cytosquelette
- Le destin des cellules et les réseaux de régulation génique
- Le développement des bourgeons de membre
- Le développement des muscles striés squelettiques
- Le développement des organes génitaux et des cellules germinales
- Le développement du cortex
- Le méristème apical caulinaire en phase végétative et lors de la formation d’une fleur
- Le poisson zèbre
- Le xénope
- Les cellules des crêtes neurales
- Les cellules et les gènes en action dans le développement
- Les cellules souches
- Les cellules tumorales
- Les cycles et les divisions cellulaires
- Les étapes du développement
- Les étapes du développement embryonnaire d’Arabidopsis thaliana et leur contrôle
- Les inductions embryonnaires et les gradients de morphogène
- Les matrices extracellulaires animales
- Les organismes modèles
- Les outils pour étudier l’expression et la fonction des gènes
- Les parois des cellules végétales
- Les techniques et les outils pour la biologie cellulaire
- Les transitions épithélio-mésenchymateuses et les migrations cellulaires
- Les vésicules extracellulaires
- Les voies de signalisation
- Les voies de signalisation FGF
- Mise en place des axes chez les Vertébrés
- Structures et processus cellulaires
- Voies de signalisation WNT
