par Patrick PLA, Université Paris-Saclay

La gastrulation est une étape critique dans le développement de tous les animaux, car c’est l’étape où les trois feuillets (ectoderme, mésoderme et endoderme) prennent leur position définitive dans l’embryon. Les cellules se déforment et migrent abondamment pendant cette étape. Il y a aussi des migrations cellulaires à des étapes plus tardives du développement, mais ici, il s’agit de mouvements généralisés à l’échelle de l’embryon alors que plus tard, ce ne seront que des mouvements localisés.
La gastrulation, un terme introduit par Ernst Haeckel en 1872, veut dire littéralement “mise en place du gaster”, c’est-à-dire mise en place de l’intestin primitif. C’est une des principales résultantes de cette phase de développement, mais c’est une vision trop restreinte, car non seulement l’endoderme qui forme l’intestin est concerné mais aussi les deux autres feuillets.
La gastrulation chez les Amphibiens
La gastrulation a été très étudiée chez les Amphibiens, car ce sont les organismes où elle est particulièrement accessible et bien visible. Les mouvements de la gastrulation ont pu être mis en évidence par Vogt par la technique des marques colorées en 1929 avec utilisation de colorants vitaux (rouge neutre, bleu de Nil) pour marquer un groupe de cellules et suivre leur migration.

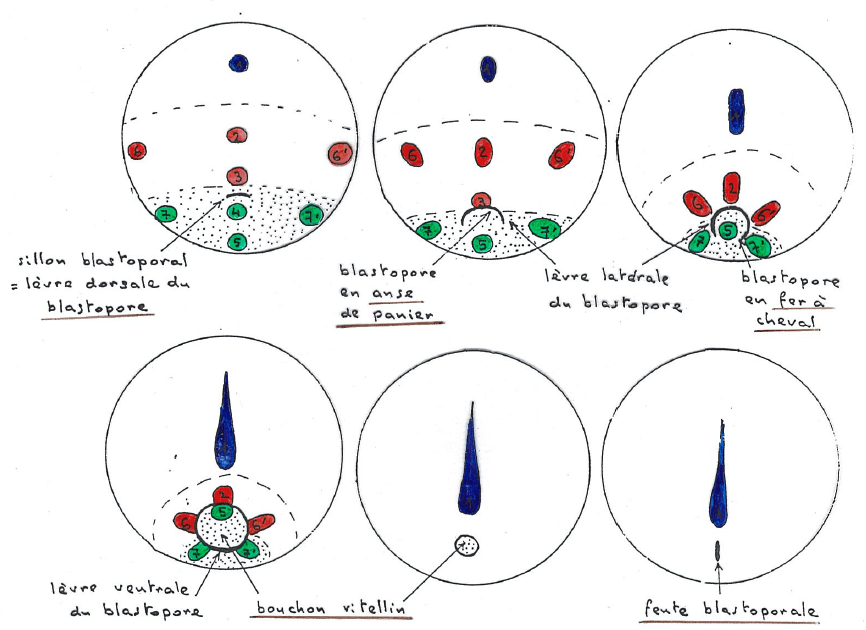
Durant la gastrulation, la cavité qui s’est formée au stade blastula et appelée blastocœle est envahie par des cellules. On observe le creusement d’une invagination, le blastopore, qui finit par former une cavité, l’archentéron, qui constituera la lumière du tube digestif. L’archentéron se développe au détriment du blastocœle qui est écrasé. Le mésoderme entre par la lèvre dorsale du blastopore et entraîne l’endoderme à l’intérieur. Une partie de l’endoderme forme le bouchon vitellin dans le blastopore. L’ectoderme qui recouvrait juste une partie de la surface de l’embryon, recouvre tout l’ensemble après la gastrulation.

Pour observer une vidéo de la gastrulation vue du pôle végétatif, suivre ce lien (et regarder uniquement la vidéo de gauche où l’embryon est normal).
Autre vidéo, également vue du pôle végétatif. On y voit aussi la neurulation qui suit la gastrulation :
Quelques détails à l’échelle cellulaire :
● Le blastopore se forme par l’invagination de cellules en bouteille. Ces cellules ont un « cou » apical mince et le reste du cytoplasme forme un bulbe basal. Ce sont des cellules de l’endoderme pharyngien qui se déforment ainsi grâce à l’action de leur cytosquelette : la constriction apicale est due aux microfilaments d’actine associés à la myosine et l’élongation est due aux microtubules.

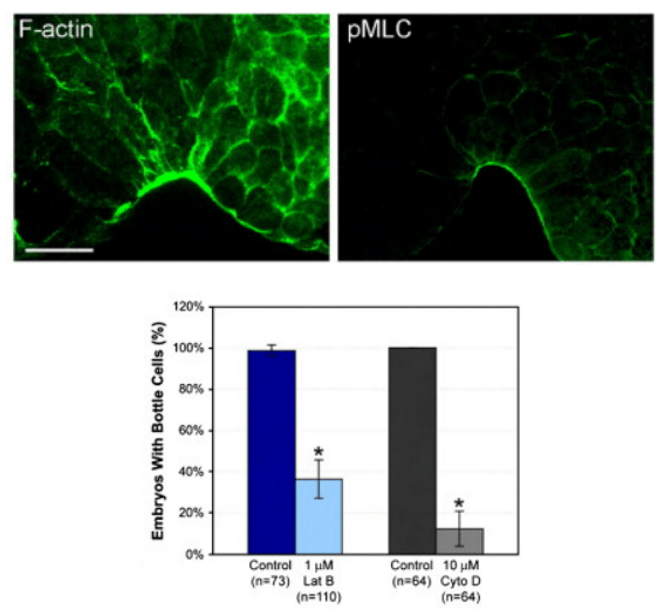
Avec un délai de 2h, les cellules en bouteille apparaissent aussi latéralement et ventralement, complétant une zone de constriction apicale circulaire : le blastopore prend la forme d’un anneau après avoir eu une forme de anse de panier puis de fer à cheval.
● L’involution est le mouvement du mésoderme qui passe par la lèvre dorsale du blastopore et qui fait une rotation de presque 180° pour remonter par l’intérieur le long des couches superficielles de l’hémisphère animal.

● Les cellules en tête de la lame de cellules mésodermiques qui pénètrent dans l’embryon migrent activement le long de la matrice extra-cellulaire riche en fibronectine qui recouvre l’intérieur du toit du blastocœle.

Si on retourne le toit du blastocœle (de telle manière à ce qu’il n’y ait plus de fibronectine du bon côté), ou si on empêche les interactions fibronectine-intégrine par des peptides RGD qui servent de « leurres » aux intégrines, les mouvements de migration sont inhibés.
Vers la fin de la gastrulation, le blastopore, en train de se refermer, est rempli par un bouchon vitellin formé par des macromères végétatifs riches en vitellus. Il est repoussé vers l’arrière et donne l’anus (nous sommes chez un Deutérostomien).

Voir également ce site sur la gastrulation des amphibiens.
La gastrulation chez les Amniotes
L’embryon de poulet est un organisme modèle pratique pour l’étude de la gastrulation chez les Amniotes, car il est plat, transparent et se développe à l’extérieur de la mère (contrairement à l’embryon de souris qui est incurvé « en hamac » et implanté dans l’utérus maternel donc difficile d’accès). Les mouvements cellulaires pendant la gastrulation sont cependant similaires chez les oiseaux et les mammifères.
Au moment de la ponte, c’est-à-dire à la fin du clivage, l’embryon de poulet est constitué d’environ 20 000 à 30 000 cellules. Un sous-ensemble de ces cellules forme un disque épithélial épais d’une seule couche, l’épiblaste, d’un diamètre de 3 mm. À la périphérie de l’embryon, l’épiblaste repose sur une couche rigide de plusieurs cellules épaisses de grandes cellules mésenchymateuses, qui entrent directement en contact avec le vitellus sous-jacent. Cette portion externe est connue sous le nom d’Area Opaca (AO) et ne donnera que des tissus extra-embryonnaires. La partie centrale est l’Area Pellucida (AP) et l’ensemble de l’embryon stricto sensu provient de cette partie. La couronne de tissu séparant l’AO et l’AP s’appelle la zone marginale (MZ).
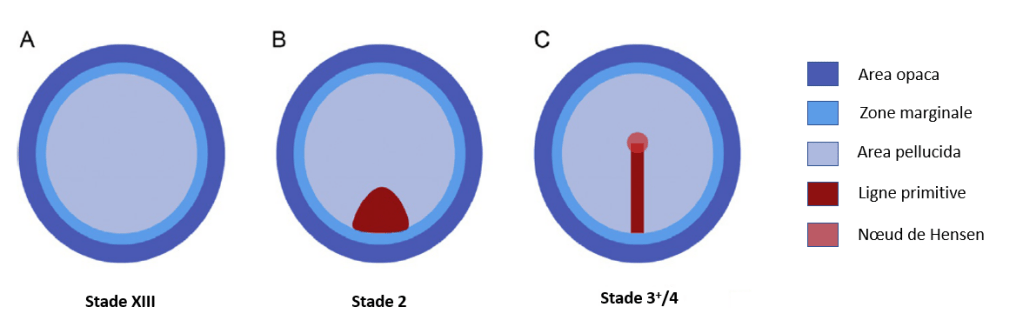
La gastrulation commence par la formation de la ligne primitive qui est l’homologue du blastopore que nous avons vu chez les Amphibiens. Le début de l’allongement selon l’axe antéro-postérieur de l’embryon se passe très tôt chez les Amniotes et ainsi la ligne primitive est allongée le long de cet axe tandis que le blastopore des Amphibiens reste circulaire car l’allongement selon l’axe antéro-postérieur est plus tardif.
Pour voir une vidéo de la formation et de l’allongement de la ligne primitive, suivre ce lien.
L’extrémité antérieure de la ligne primitive s’épaissit et forme le nœud de Hensen, l’homologue de la lèvre dorsale du blastopore.
Une fois que la ligne primitive s’est étendue à travers l’épiblaste, des cellules de l’épiblaste pénètrent dans la ligne primitive après avoir subi une transition épithélio-mésenchymateuse. Ce sont les cellules de l’endoderme et du mésoderme.
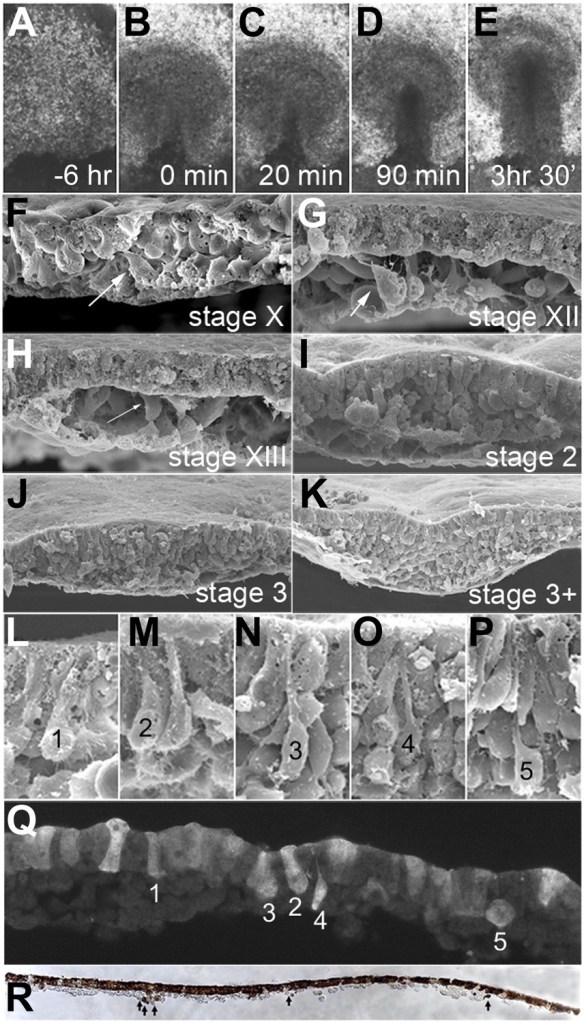
(A–E) Images montrant l’épiblaste uniforme 6 heures (A, stade XII) et juste avant la formation de la ligne primitive (B, stade XIV), puis la première apparition de la ligne primitive (C, stade HH2), l’accumulation de mésoderme sous la ligne primitive (D, stade HH3), l’apparition d’un sillon dans la ligne primitive et la migration du mésoderme (E, stade HH3+). (F-K) Microscopie électronique à balayage de coupes transversales d’embryon avant (F-H) et après (I-K) formation de la ligne primitive. Les flèches blanches indiquent une transition épithélio-mésenchymateuse (TEM) (L–P) Microscopie électronique à balayage de coupe transversale dans la ligne primitive, montrant des cellules en TEM avec divers degrés de constriction apicale et d’expansion basolatérale (classées comme « stades d’entrée 1 à 5 »). (Q) Cet embryon a été cultivé pendant 1 heure après introduction d’un marqueur fluorescent dans tout l’épiblaste au stade XI, puis sectionné sagittalement. Les cellules marquées dans l’épiblaste présentent des morphologies similaires à celles des images de microscopie électronique (panneaux L-P, « stades d’entrée 1 à 5 »). (R) Cet embryon a été cultivé pendant 4 heures après introduction d’un marqueur fluorescent témoin dans tout l’épiblaste au stade XI, puis fixé (au stade XII), sectionné sagittalement et coloré avec un anticorps anti-fluorescéine (marron). La coupe montre plusieurs cellules qui ont quitté l’épiblaste et se trouvent maintenant dans l’espace sous-jacent dans toute l’étendue antéro-postérieure de l’embryon (flèches noires). Source : https://elifesciences.org/articles/01817

Sur la vidéo suivante, on voit bien les mouvements des cellules de l’épiblaste. La ligne primitive se situe en bas à gauche :
La ligne primitive régresse au cours de la dernière phase de la gastrulation lorsque le nœud de Hensen se déplace vers l’arrière. La ligne primitive se raccourcit jusqu’à ce qu’elle disparaisse finalement dans les stades où a lieu la formation des premiers somites. Plus en avant, la neurulation et la formation du tube neural a déjà commencé. Il y a une désynchronisation des phases de développement chez les Amniotes avec l’avant qui est plus mature que l’arrière. Ce n’est pas le cas chez les Amphibiens.
La gastrulation chez la souris a été moins étudiée que chez la poule car elle est moins accessible et la topologie est compliquée par la forme « en hamac » que prend l’embryon et par la présence de structures extra-embryonnaires plus étendues à ce stade chez la souris que chez la poule. Mais les mécanismes fondamentaux restent les mêmes. Notons que l’embryon humain n’a pas cette forme en hamac et sa forme ressemble plus à celle de l’embryon de poule. La gastrulation chez l’Homme commence 14 jours après la fécondation.
La transition épithélio-mésenchymateuse dans la ligne primitive est sous la dépendance du facteur de transcription Snail (ce qui sera aussi le cas un peu plus tard au cours du développement, pour la transition épithélio-mésenchymateuse des cellules de crêtes neurales). Snail réprime notamment directement l’expression de la E-cadhérine épiblastique et active l’expression de marqueurs mésenchymateux tels que la vimentine.
Brachyury ou T est un gène très important pour le développement du mésoderme lors de la gastrulation et ce, quelque soit le vertébré. Brachyury est le membre fondateur d’une famille de facteurs de transcription caractérisés par un domaine de liaison à l’ADN conservé, la boîte T ou T-box. À partir d’un orthologue brachyury dans l’ancêtre commun des métazoaires et des champignons, plusieurs gènes T-box ont été générés par duplication, et ils se sont encore diversifiés au sein des métazoaires (Sebé-Pedrós et al., 2013 ; Papaioannou, 2014 ; Gentsch et al., 2017). Le nom du gène Brachyury fait référence au phénotype le plus évident du mutant T hétérozygote de souris, une queue tronquée, qui a été décrit par Dobrovolskaia-Zavadskaia dès 1927. Les mutations homozygotes T−/− sont léthaux pour l’embryon et présentent une accumulation de cellules du mésoderme au niveau de la ligne primitive de la gastrula et une perte du mésoderme postérieur. Tout comme Snail, il intervient dans la transition épithélio-mésenchymateuse.

Après la gastrulation, vient l’étape de la neurulation.
EN DIRECT DES LABOS : La formation de gastruloïdes
LA CARTE MENTALE :

- Adhérences cellule-cellule
- Arabidopsis thaliana
- Axe antéro-postérieur chez la drosophile
- Biomécanique du développement
- Caenorhabditis elegans
- Concepts principaux
- Contrôle de la traduction
- Contrôle de la transcription
- Contrôle génétique et épigénétique
- Croissance du tube pollinique et double fécondation chez les Angiospermes
- Croissance et guidage axonal
- Des modèles animaux moins classiques
- Développement de l’oeil des Vertébrés
- Développement et évolution
- Et l’Humain ?
- Exercices sur l’ovogenèse, la spermatogenèse et la fécondation
- Exercices sur le contrôle de l’expression des gènes
- Exercices sur le développement des bourgeons de membre
- Exercices sur le développement des muscles striés squelettiques
- Exercices sur le développement des végétaux et les hormones végétales
- Exercices sur les cycles et les divisions cellulaires
- Exercices sur les étapes du développement, les inductions embryonnaires et la mise en place des axes de polarité
- Exercices sur les matrices extracellulaires, le cytosquelette et les adhérences cellule-cellule
- Exercices sur les voies de signalisation
- Glossaire
- Glossaire des termes liés à la génétique
- Glossaire des termes liés au cytosquelette, la matrice extracellulaire, l’adhérence et la migration cellulaire
- Hématopoïèse et développement des cellules du système immunitaire
- Histoire de la biologie cellulaire et de la biologie du développement
- L’acide rétinoïque
- L’apoptose
- L’autophagie
- L’organogenèse
- L’ovogénèse prépare le développement embryonnaire
- La drosophile
- La fécondation
- La formation des somites
- La gastrulation
- La métamorphose chez les Hexapodes et les Amphibiens
- La neurogénèse chez les mammifères adultes
- La neurulation
- La poule
- La signalisation calcique
- La souris
- La superfamille TGFβ et ses voies de signalisation
- La voie de signalisation de l’auxine et ses rôles
- La voie de signalisation Hedgehog
- La voie de signalisation Hippo et ses composants YAP/TAZ
- La voie de signalisation Notch
- Le clivage
- Le cytosquelette
- Le destin des cellules et les réseaux de régulation génique
- Le développement des bourgeons de membre
- Le développement des muscles striés squelettiques
- Le développement des organes génitaux et des cellules germinales
- Le développement du cortex
- Le méristème apical caulinaire en phase végétative et lors de la formation d’une fleur
- Le poisson zèbre
- Le xénope
- Les cellules des crêtes neurales
- Les cellules et les gènes en action dans le développement
- Les cellules souches
- Les cellules tumorales
- Les cycles et les divisions cellulaires
- Les étapes du développement
- Les étapes du développement embryonnaire d’Arabidopsis thaliana et leur contrôle
- Les inductions embryonnaires et les gradients de morphogène
- Les matrices extracellulaires animales
- Les organismes modèles
- Les outils pour étudier l’expression et la fonction des gènes
- Les parois des cellules végétales
- Les techniques et les outils pour la biologie cellulaire
- Les transitions épithélio-mésenchymateuses et les migrations cellulaires
- Les vésicules extracellulaires
- Les voies de signalisation
- Les voies de signalisation FGF
- Mise en place des axes chez les Vertébrés
- Structures et processus cellulaires
- Voies de signalisation WNT
