Par Patrick Pla, Université Paris-Saclay
La famille des ligands de type TGFβ et les voies de signalisation associées jouent un rôle fondamental dans de multiples processus cellulaires au cours du développement embryonnaire. Le rôle d’un seul membre de cette famille est souvent multiple (effets pleïotropiques) selon le principe général que les voies de signalisation sont souvent réutilisées de multiples fois au cours du développement dans des localisations différentes. Il faut les considérer comme des modules dont les entrées et les sorties dépendent largement du contexte.
TGFβ
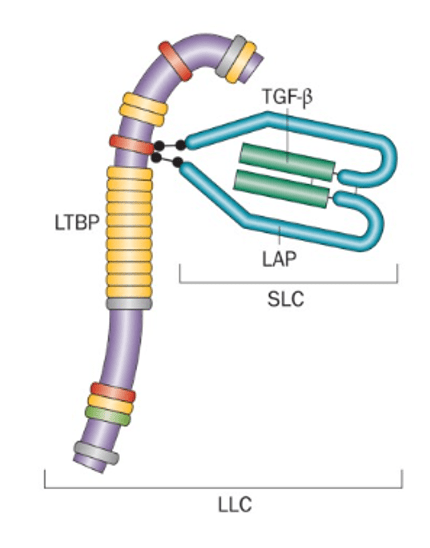
Après sécrétion par les cellules productrices, les ligands TGF-β (qui sont associés en homodimères) sont en majorité présents sous une forme latente car associés à la protéine LAP. Une interaction avec des intégrines (αvβ8 ou αvβ6 par exemple) permet à TGF-β de prendre sa conformation active, de quitter LAP et de s’associer à ses récepteurs (Brown et Marshall, 2019).
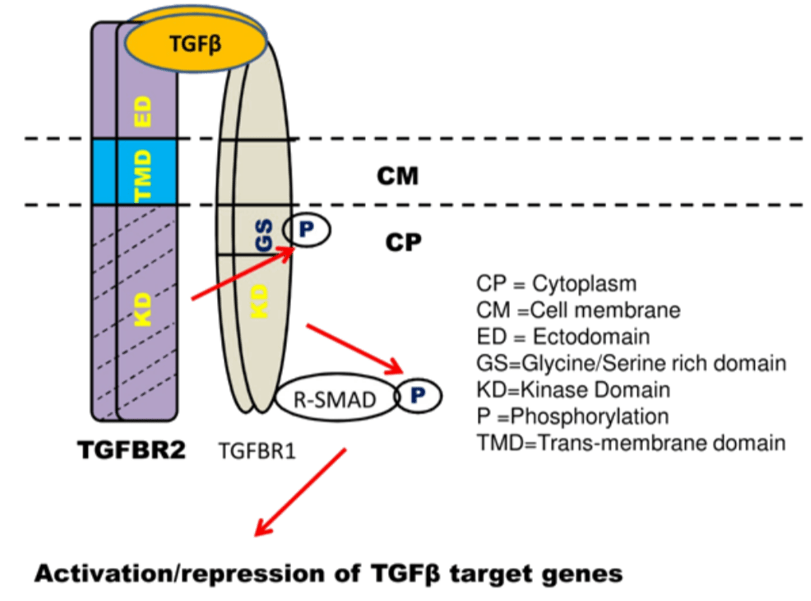
La signalisation TGF-β passe par deux types de récepteurs transmembranaires à activité sérine-thréonine kinase. La liaison du ligand au récepteur au TGF-β de type II (TβRII) stabilise la formation d’un complexe avec le récepteur au TGF-β de type I (TβRI) et induit l’activation du récepteur TβRI par la kinase du récepteur TβRII.
Les SMADs agissent ensuite comme effecteurs de signalisation. La phosphorylation C-terminale de SMAD2 ou SMAD3 par TβRI entraîne un changement de conformation qui favorise l’hétéromérisation avec SMAD4 et stimule la translocation nucléaire des complexes SMAD. Dans le noyau, les protéines SMAD régulent la transcription en se liant à l’ADN et en interagissant avec d’autres facteurs de transcription.
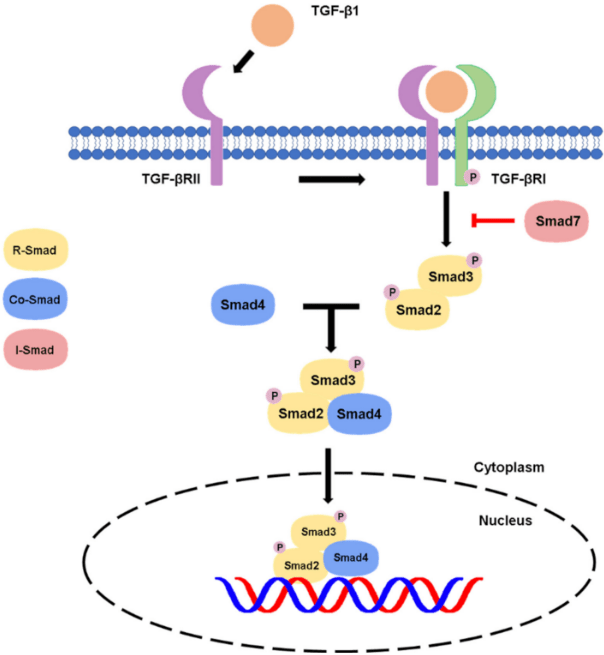
Cette interaction avec d’autres facteurs est nécessaire car les complexes SMAD ont une affinité faible ou nulle pour l’ADN. Phospho-SMAD3 associé à SMAD4 se lie directement à l’ADN avec une faible affinité au niveau d’éléments spécifiques de liaison à SMAD. Les complexes phospho-SMAD2-SMAD4, en revanche, ne se lient pas directement à l’ADN mais doivent s’associer à des facteurs de transcription, le premier caractérisé étant le facteur de transcription forkhead, FOXH1 (anciennement appelé Fast1) (Chen et al., 1996).
SMAD4 est essentiel dans la majorité des cas, mais n’est pas obligatoire dans certains contextes et une partie des gène-cibles de la voie de signalisation TGF-β est activée indépendamment de SMAD4. En effet, SMAD2/3 sont capables d’entrer dans le noyau sans SMAD4 (Fink et al., 2003). Par exemple, au cours du développement du pancréas, SMAD2/3, mais pas SMAD4, jouent un rôle clé (Bardeesy et al., 2006).
L’entrée des SMAD dans le noyau est contrôlée (entre autres) par l’Importine-8. Le gène qui code cette protéine, IPO8, a été retrouvé muté dans des patients atteints de symptômes proches du syndrome de Marfan (anomalies vasculaires et squelettiques). L’introduction de mutations équivalentes chez le poisson-zèbre a permis de reproduire des dysfonctionnements similaires à ceux des patients qui ont pu être reliés à un dysfonctionnement de la voie de signalisation TGF-β (et BMP également) (Ziegler et al., 2021).
La voie de signalisation TGF-β régule la différenciation mésenchymateuse, inhibant la différenciation des ostéoblastes, des myoblastes et des adipocytes.
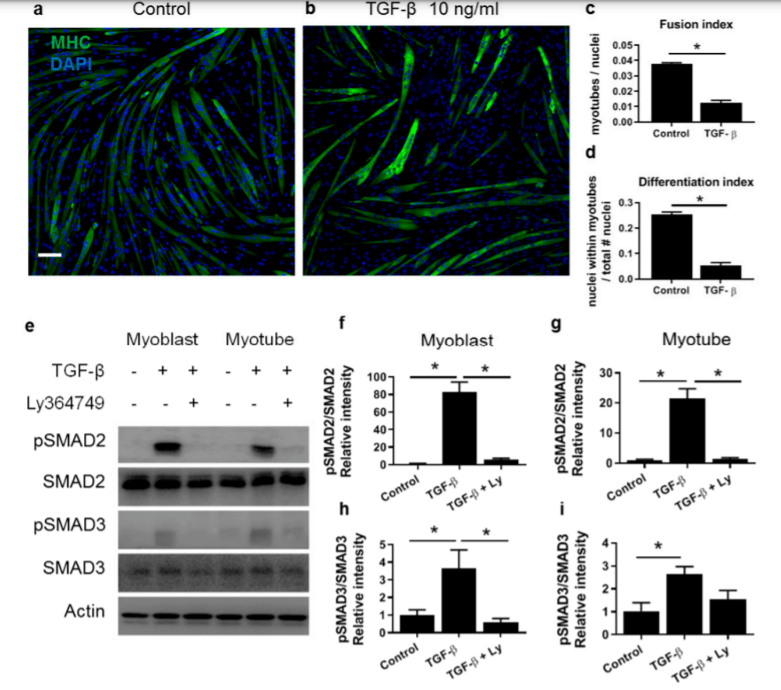
C’est SMAD3, et non SMAD2, qui médie cette inhibition par le TGF-β de la différenciation des ostéoblastes et des myoblastes. Dans ce dernier cas, Smad3 interagit physiquement avec MyoD et perturbe sa liaison à l’ADN, réduisant ainsi l’expression génique spécifique au muscle. Dans l’inhibition de la différenciation ostéoblastique médiée par le TGF-β, SMAD3 réprime la fonction de CBFA1 sans perturber sa liaison à l’ADN.
C’est encore SMAD3 qui inhibe la différenciation adipocytaire en aval de TGF-β. L’adipogenèse, activée par C/EBPβ ou C/EBPδ, est inhibée par TGF-β sans diminution des niveaux de protéine C/EBP. Les C/EBP interagissent physiquement à la fois avec SMAD3 et SMAD4, et cette interaction est corrélée à la répression de la transcription médiée par C/EBP au niveau des promoteurs des gènes codant des protéines essentielles pour la différenciation adipocytaire, avec des sites de liaison C/EBP multimérisés. Mais l’action de SMAD3 et SMAD4 n’affectent pas la liaison de C/EBP à ces séquences cibles. Ces données représentent le premier exemple d’inhibition directe de la fonction de transactivation d’un facteur de transcription par SMADs (Choy et Derinck, 2003).
D’une manière générale, la signalisation TGF-β a une fonction pro-matrice extracellulaire (MEC). Elle favorise le dépôt net de la matrice en augmentant l’expression de composants spécifiques de la MEC tels que la fibronectine et le collagène, en activant l’expression des inhibiteurs des protéases de la MEC tels que l’inhibiteur de l’activateur du plasminogène-1 (PAI-1) et les inhibiteurs tissulaires des métalloprotéinases matricielles (TIMPs), tout en diminuant l’expression des protéases qui dégradent les composants de la matrice, comme la collagénase interstitielle.
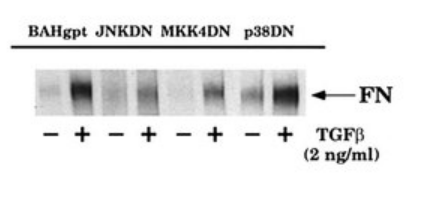
Comme nous le voyons sur la figure ci-dessus, l’activation de l’expression de la fibronectine passe par une voie de signalisation particulière, la voie de signalisation JNK. Une autre voie de signalisation, la voie p38 aboutissant à l’activation de ATF-2 et CREB ne semble pas impliquée (Hocevar et al., 1999).
Cette stimulation de la production de la MEC par TGF-β en fait un des acteurs majeurs de la fibrose où du tissu abîmé est remplacé généralement par des fibroblastes et de la MEC qui n’est pas fonctionnelle (Fragogiannis, 2020).
Dans certains contextes cependant, notamment cancéreux, la signalisation TGF-β peut au contraire stimuler la dégradation de la MEC via l’activation de l’expression des métalloprotéinases, notamment MMP-9. TGF-β agit à ce moment-là non pas par les SMAD mais par l’intermédiaire de TAK1 (pour TGF-β activated kinase) qui agit à son tour sur JNK et p38 comme cela a été démontré dans des cellules tumorales de cancer du sein (Safina et al., 2007). TGF-β peut favoriser la progression tumorale en favorisant les transitions épithélio-mésenchymateuses (EMT).
Source : https://www.mdpi.com/2072-6643/9/9/980/htm
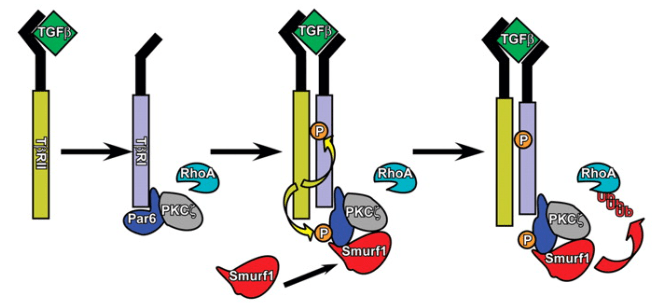
Outre l’activation de l’expression des coordinateurs majeurs de l’EMT, les facteurs de transcription de la famille Snail/Twist, les récepteurs TGF-β peuvent avoir un rôle plus direct : Par6, un régulateur de la polarité des cellules épithéliales et de l’assemblage des jonctions serrées, interagit avec les récepteurs TGF-β et est phosphorylée par le récepteur de type II, TGF-βRII. La phosphorylation de Par6 est nécessaire pour l’EMT dépendant du TGF-β dans les cellules épithéliales de la glande mammaire et contrôle l’interaction de Par6 avec l’ubiquitine ligase E3 Smurf1. Smurf1, à son tour, cible la petite GTPase RhoA pour la dégradation, entraînant ainsi une perte de jonctions serrées (Ozdamar et al., 2005).
Dans d’autres contextes, TGF-β peut avoir une action anti-tumorale. Dans un type particulier de cancer du colon, on peut ainsi trouver des mutations du récepteur de TGF-β qui le rendent inactif et la signalisation TGF-β ne peut plus exercer son action modératrice sur la prolifération des cellules de carcinome du colon.
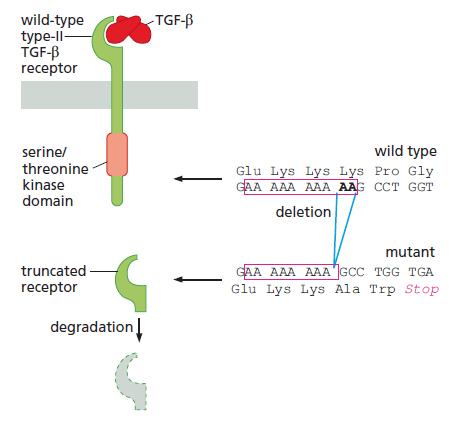
cadre de lecture lors de la traduction s’en trouve décalé. Il s’agit d’une mutation non-sens qui cause une fin prématurée de la traduction à cause de la présence d’un codon STOP dans le nouveau cadre de lecture. Le récepteur tronqué perd son domaine de signalisation intracellulaire C-terminal qui est crucial pour sa fonction. Cette perte permet aux cellules du carcinome du côlon de devenir résistantes aux effets inhibiteurs de croissance du TGF-β. Source : https://pubmed.ncbi.nlm.nih.gov/9872311/
BMP
Les membres de la famille BMP (pour Bone Morphogenetic Protein) se distinguent des autres membres de la superfamille TGF-β en ayant sept (plutôt que neuf) cystéines conservées dans la protéine mature. Ils ont été d’abord caractérisés par leur capacité à faire différencier les ostéoblastes en ostéocytes mais leurs fonctions sont très variées. Signalons que malgré son nom, BMP1 est à part dans la famille, et est une protéase.
En général, les BMP agissent en tant qu’homodimères mais des hétérodimères ont aussi été caractérisés (Hazama et al., 1995; Bi et al., 2013). Les BMP de classe I, notamment BMP2 et BMP4, sont capables de s’hétérodimériser avec les BMP de classe II telles que BMP5, BMP6, BMP7 et BMP8 (Guo et Wu, 2012). Les hétérodimères formés entre les BMP de classe I et de classe II présentent une activité plus élevée que les homodimères de l’une ou l’autre des classes, probablement en raison de l’assemblage de complexes récepteurs différents.
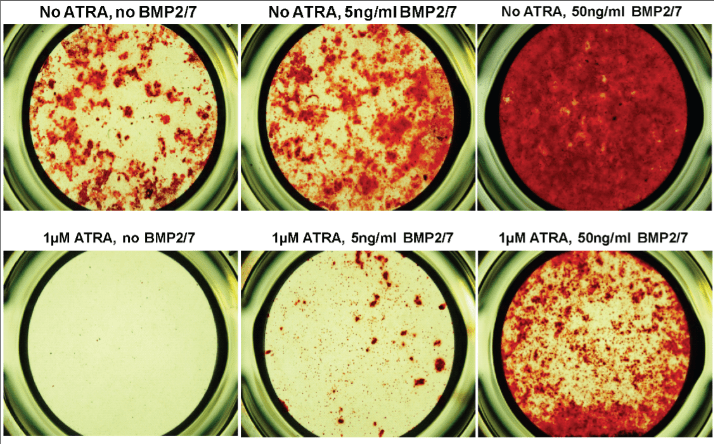
Des pré-ostéoblastes sont soumis pendant 28 jours aux différents traitements indiqués puis une coloration rouge alizarine qui met en évidence la matrice extracellulaire osseuse (marqueur d’une différenciation des pré-ostéoblastes en ostéoblastes) est effectuée. ATRA = Acide rétinoïque tout-trans, une molécule impliquée dans la résorption osseuse et l’ostéoporose. Source : https://journals.plos.org/plosone/article?id=10.1371/journal.pone.0078198
Les voies de signalisation activées ressemblent à celles de TGF-β mais ce sont les SMAD-1, -5 et -8 qui sont activées et non pas les SMAD-2 et -3. SMAD4 est toujours impliqué.
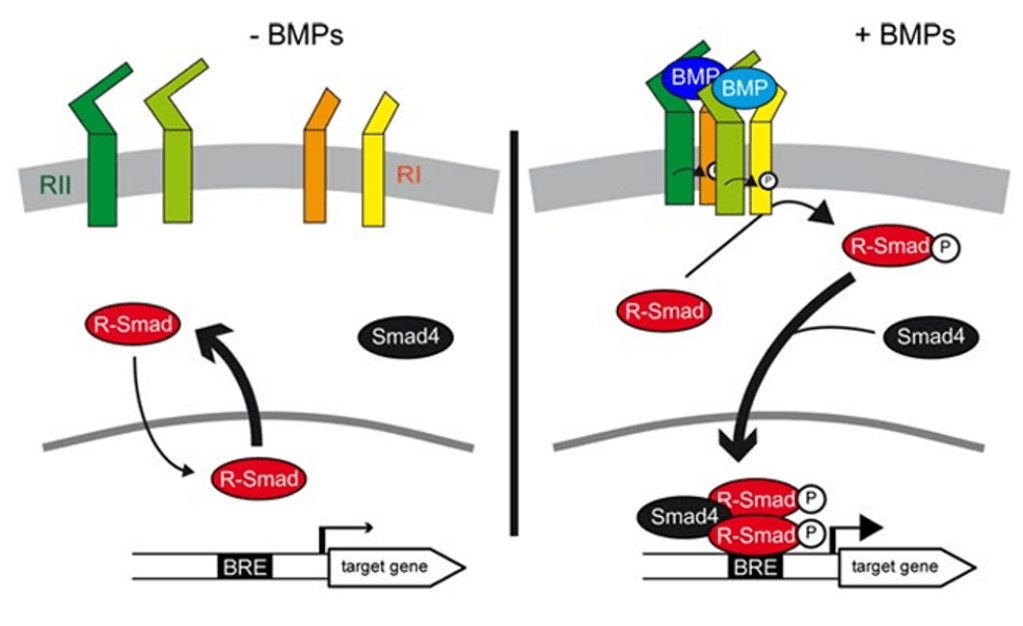
Une version commentée en détail de cette figure est disponible en vidéo. Source
Chez la drosophile, l’orthologue des BMP s’appelle dpp (pour decapentaplegic). Dpp se lie au récepteur de type I Tkv et au récepteur de type II Punt pour phosphoryler le facteur de transcription Mad. Mad phosphorylé (pMad) forme un complexe avec le Co-Smad (Medea) pour s’accumuler dans le noyau et activer ou inhiber la transcription du gène cible.
Les BMP sont fortement impliqués dans la mise en place de l’axe dorso-ventral et antéro-postérieur chez les Vertébrés.
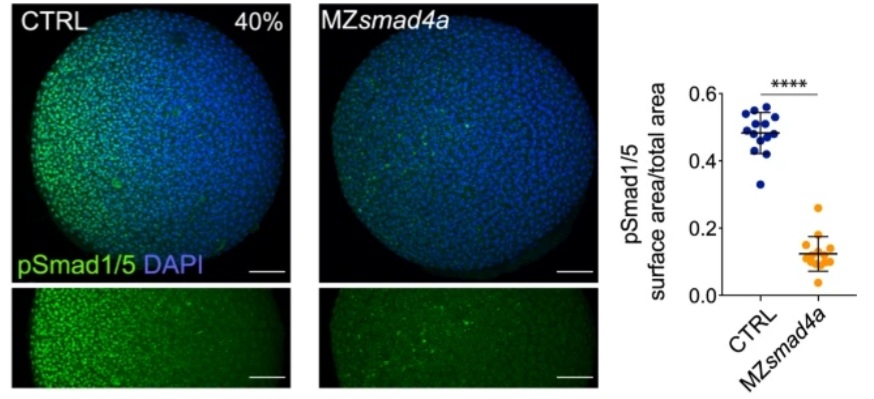
SMAD4 est commun entre la voie des BMP et la voie de Nodal (voir plus loin pour la voie Nodal). Chez le poisson-zèbre, BMP a besoin de SMAD4 en aval pour activer correctement ses gènes cibles alors que Nodal peut quand même activer ses propres gènes cibles via des voies de signalisation de compensation (Guglielmi et al., 2021).
Les ligands BMP peuvent être piégés dans l’espace intercellulaire et empêchés d’agir sur leurs récepteurs par diverses protéines sécrétées : Chordine, Noggin, Follistatine et Gremlin. Cette inhibition a des fonctions très importantes lors de la mise en place des axes, pour le maintien de la croissance du bourgeon de membre (Zuniga et al., 1999), pour le contrôle de l’apoptose interdigitale, la transition épithélio-mésenchymateuse des crêtes neurales (Sela-Donenfeld et Kalcheim, 2000) ou lors de la formation du cortex (Ichinose et al., 2021).
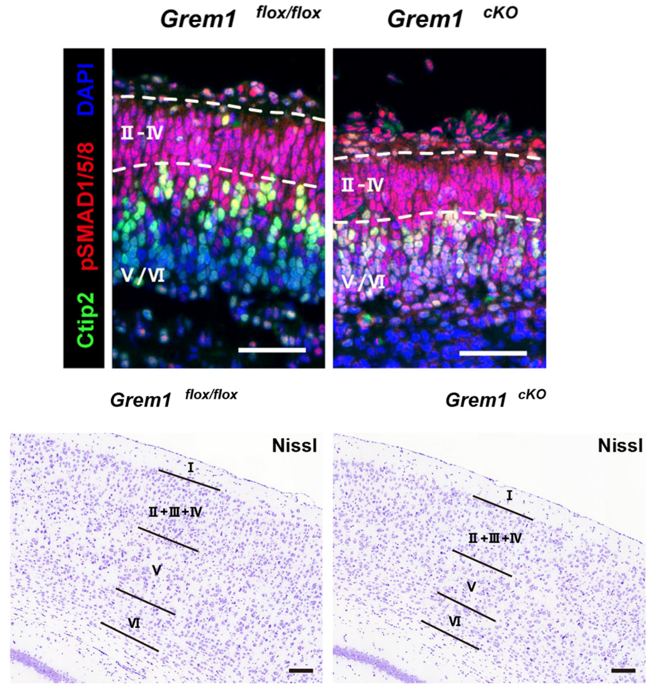
La signalisation BMP peut aussi être modulée à la hausse ou à la baisse par différents acteurs intracellulaires. Smurf1 est une E3 ubiquitine ligase qui active la dégradation des récepteurs aux BMP ainsi que de SMAD1/5 (Murakami et Etlinger, 2019). Le recrutement de Smurf1 peut être facilité par SMAD6 et SMAD7 qui peuvent également se fixer sur les récepteurs BMP activés de type I et bloquer la phosphorylation des SMAD1/5/8 (Yan et al., 2009).
Bambi a, quant à lui, une structure très proche des récepteurs de type I de BMPR, mais a un domaine intracellulaire raccourci, sans aucune activité sérine/thréonine kinase. Il s’agit donc d’un pseudo-récepteur, qui joue un rôle de dominant-négatif en bloquant les interactions entre les récepteurs de type I et de type II (Ornichtchouk et al., 1999). Bambi bloque non seulement la signalisation BMP, mais aussi TGF-β et Nodal. Bambi interagit en plus avec le récepteur aux Wnt, Frizzled et aussi avec son effecteur Dishevelled et il facilite leur interaction, ce qui facilite l’activation de la voie canonique Wnt/β-caténine (Lin et al., 2008). On voit donc que Bambi inhibe la voie de signalisation BMP (et apparenté) pour activer une autre voie de signalisation concurrente, Wnt.
La calcineurine qui est une phosphatase activée par les ions Ca2+ est capable de déphosphoryler SMAD1/5 et donc d’inhiber la voie de signalisation BMP. Ce rôle a été démontré en aval des FGF qui activent une voie de signalisation menant à une augmentation de Ca2+ cytoplasmique et donc à l’activation de la calcineurine dans le futur tissu neural chez la souris (Cho et al. 2014). Ainsi, les FGF contribuent à l’induction neurale (en plus de Chordine et de Noggin qui capturent les BMP avant qu’ils n’atteignent leurs récepteurs).
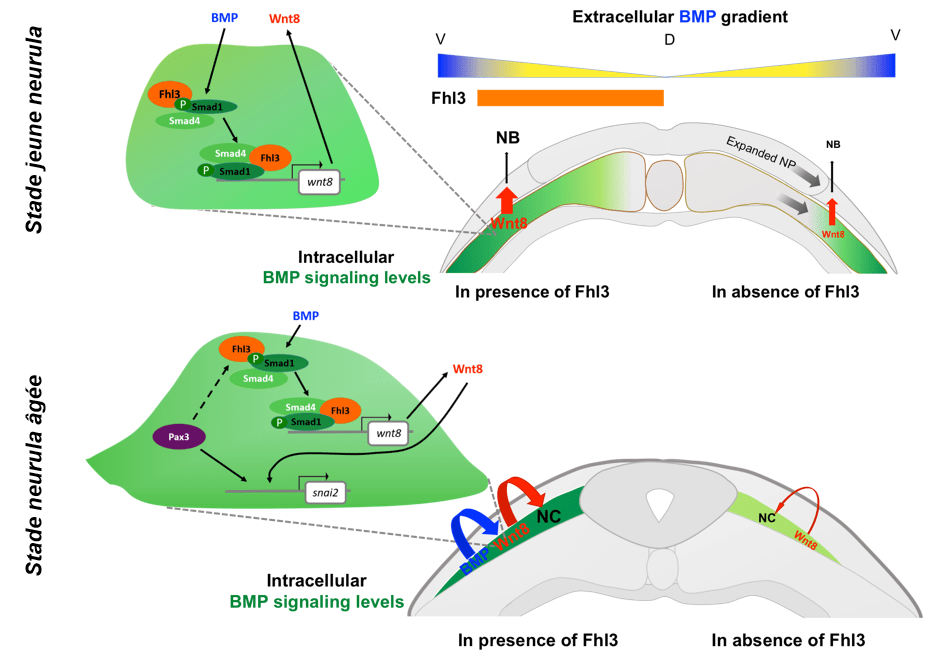
FHL3 est, au contraire, une protéine qui facilite la signalisation BMP en stimulant la fixation des complexes SMAD1/5/8-SMAD4 sur les séquences régulatrices de ses gènes-cibles. Le gène codant Wnt8 est ainsi plus fortement activé en aval de la signalisation BMP en présence de FHL3 et cela permet de mieux induire de la bordure neurale dans un premier temps puis de mieux spécifier les cellules de crêtes neurales dans un deuxième temps (Alkobtawi et al., 2021).
SMAD1/5/8 peuvent avoir des fonctions indépendantes de SMAD4. Notamment, ils peuvent se fixer sur le complexe Drosha et accélérer la maturation de pri-miARN en microARN. C’est le cas pour le microARN miR-21 qui contrôle la différenciation des cellules musculaires lisses de la paroi des vaisseaux sanguins sous le contrôle des BMP.
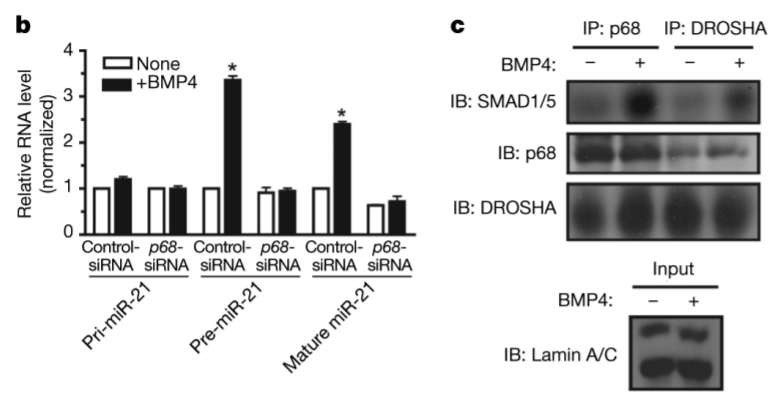
Nodal
Les ligands de la famille Nodal empruntent en partie les mêmes voies que la signalisation TGFβ. Cependant, les récepteurs, les gènes cibles et les interactants régulateurs sont différents.
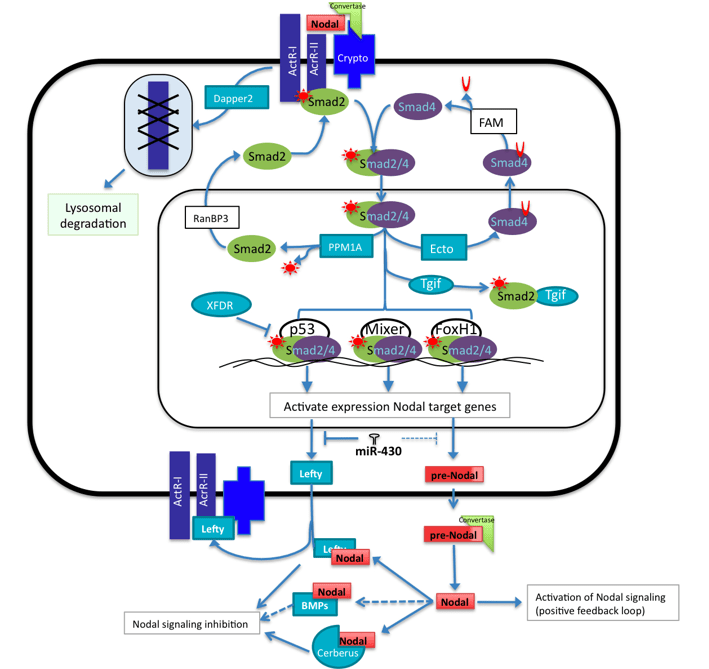
Source : https://en.wikipedia.org/wiki/Nodal_signaling_pathway#/media/File:Nodal_signaling.jpg
L’activine et Nodal partagent les mêmes récepteurs et activent les mêmes voies de signalisation. Souvent, on utilise l’activine plutôt que Nodal comme ligand pour des cultures in vitro car elle est plus facile à produire en tant que protéine recombinante.
La protéine Lefty est un antagoniste de Nodal et elle agit de 2 manières : en se fixant sur Nodal directement et en se fixant au co-récepteur Cripto et en empêchant l’interaction de Nodal avec lui de manière compétitive. Le gène codant Lefty est une cible de la voie de signalisation Nodal ce qui en fait un exemple classique de rétroaction négative. Les souris mutantes Lefty2-/- et les poissons-zèbres mutants perte-de-fonction pour Antivin (l’orthologue de Lefty) produisent trop de mésoderme et ont une ligne primitive trop étendue en conséquence d’une suractivation de la voie Nodal (Meno et al., 1999).
La signalisation Nodal est fortement active dans les cellules souches pluripotentes (ES ou iPS) en culture et est nécessaire au maintien de leurs propriétés. La différenciation de ces cellules s’accompagne souvent d’une baisse de la signalisation Nodal, liée entre autre à l’activation de l’expression de Lefty. Dans les cellules souches pluripotentes, l’expression de Lefty est réprimée par un microARN, miR-302. Si on surexprime ce microARN, l’expression de Lefty est plus faible que normalement et les cellules mettent plus de temps à se différencier. L’expression des gènes de pluripotence Nanog, Oct4 et Sox2 met plus de temps à s’éteindre (Barroso-DelJesus et al., 2011).
La voie de signalisation Nodal est essentielle pour mettre en place l’asymétrie droite-gauche. Elle est activée par un flux de liquide extracellulaire contrôlé par des battements ciliaires vers la gauche au sein de l’organisateur droite-gauche qui se trouve dans le plan de symétrie bilatérale et qui est dérivé du nœud de Hensen. La pression exercée vers la gauche active des mécanosenseurs ciliaires qui contiennent des canaux cationiques Pkd2 nécessaires à la mise en place de la polarité droite-gauche (Pennekamp et al., 2002). S’ensuit une entrée de Ca2+ dans le cytoplasme qui active une cascade de transduction aboutissant à l’inhibition de l’inhibiteur de la voie Nodal, Dand5 (aussi appelé Cerl2). Les ARNm de Dand5 sont dégradés plus rapidement sous l’action de la protéine Bicc1 activée par le Ca2+ (Nakamura et al., 2012, Maerker et al., 2021). La voie de signalisation Nodal peut ainsi agir et activer la transcription de Pitx2 (Yoshioka et al., 1998).
Bien que présentée ici de manière séparée, les signalisations Nodal et BMP peuvent être inter-dépendantes. Par exemple dans l’embryon de souris, Nodal dérivé de l’épiblaste induit la synthèse de BMP4 dans l’ectoderme extra-embryonnaire qui à son tour favorise l’expression de Nodal dans l’épiblaste (Robertson, 2014).
Signalons que l’hormone anti-Müllerienne (AMH) produite dans les testicules par les cellules de Sertoli et qui provoque la régression du canal de Müller chez les embryons mâles est un ligand de la surperfamille des TGF-β. Des mutations dans le gène codant l’AMH ou les sous-unités de son récepteur peuvent provoquer une persistance de canaux de Müller chez des enfants mâles (Belville et al., 2002). Chez les femelles, après la naissance, l’AMH est secrétée par les cellules de la granulosa dans les follicules ovariens et limite le recrutement des follicules à partir de la réserve.
VOIR LES EXERCICES SUR LES VOIES DE SIGNALISATION
- Adhérences cellule-cellule
- Arabidopsis thaliana
- Axe antéro-postérieur chez la drosophile
- Biomécanique du développement
- Caenorhabditis elegans
- Concepts principaux
- Contrôle de la traduction
- Contrôle de la transcription
- Contrôle génétique et épigénétique
- Croissance du tube pollinique et double fécondation chez les Angiospermes
- Croissance et guidage axonal
- Des modèles animaux moins classiques
- Développement de l’oeil des Vertébrés
- Développement et évolution
- Et l’Humain ?
- Exercices sur l’ovogenèse, la spermatogenèse et la fécondation
- Exercices sur le contrôle de l’expression des gènes
- Exercices sur le développement des bourgeons de membre
- Exercices sur le développement des muscles striés squelettiques
- Exercices sur le développement des végétaux et les hormones végétales
- Exercices sur les cycles et les divisions cellulaires
- Exercices sur les étapes du développement, les inductions embryonnaires et la mise en place des axes de polarité
- Exercices sur les matrices extracellulaires, le cytosquelette et les adhérences cellule-cellule
- Exercices sur les voies de signalisation
- Glossaire
- Glossaire des termes liés à la génétique
- Glossaire des termes liés au cytosquelette, la matrice extracellulaire, l’adhérence et la migration cellulaire
- Hématopoïèse et développement des cellules du système immunitaire
- Histoire de la biologie cellulaire et de la biologie du développement
- L’acide rétinoïque
- L’apoptose
- L’autophagie
- L’organogenèse
- L’ovogénèse prépare le développement embryonnaire
- La drosophile
- La fécondation
- La formation des somites
- La gastrulation
- La gastrulation (version allégée)
- La métamorphose chez les Hexapodes et les Amphibiens
- La neurogénèse chez les mammifères adultes
- La neurulation
- La poule
- La signalisation calcique
- La souris
- La voie de signalisation de l’auxine et ses rôles
- La voie de signalisation Hedgehog
- La voie de signalisation Hippo et ses composants YAP/TAZ
- La voie de signalisation Notch
- Le clivage
- Le cytosquelette
- Le destin des cellules et les réseaux de régulation génique
- Le développement des bourgeons de membre
- Le développement des muscles striés squelettiques
- Le développement des organes génitaux et des cellules germinales
- Le développement du cortex
- Le méristème apical caulinaire en phase végétative et lors de la formation d’une fleur
- Le poisson zèbre
- Le xénope
- Les cellules des crêtes neurales
- Les cellules et les gènes en action dans le développement
- Les cellules souches
- Les cellules tumorales
- Les cycles et les divisions cellulaires
- Les étapes du développement
- Les étapes du développement embryonnaire d’Arabidopsis thaliana et leur contrôle
- Les inductions embryonnaires et les gradients de morphogène
- Les matrices extracellulaires animales
- Les organismes modèles
- Les outils pour étudier l’expression et la fonction des gènes
- Les parois des cellules végétales
- Les techniques et les outils pour la biologie cellulaire
- Les transitions épithélio-mésenchymateuses et les migrations cellulaires
- Les vésicules extracellulaires
- Les voies de signalisation
- Les voies de signalisation FGF
- Mise en place des axes chez les Vertébrés
- Structures et processus cellulaires
- Voies de signalisation WNT