Par Patrick Pla, Université Paris-Saclay
Pour des raisons évidentes d’éthique, l’étude du développement humain est plus compliqué que l’étude de celui des animaux et des plantes. Les avortements (spontanés ou non) ont toujours été une importante source d’observation.
Cependant, les premières étapes pré-implantatoires ont pu être étudiées précisément depuis la mise au point de la fécondation in vitro à la fin des années 1970 (Niakan et al., 2012).
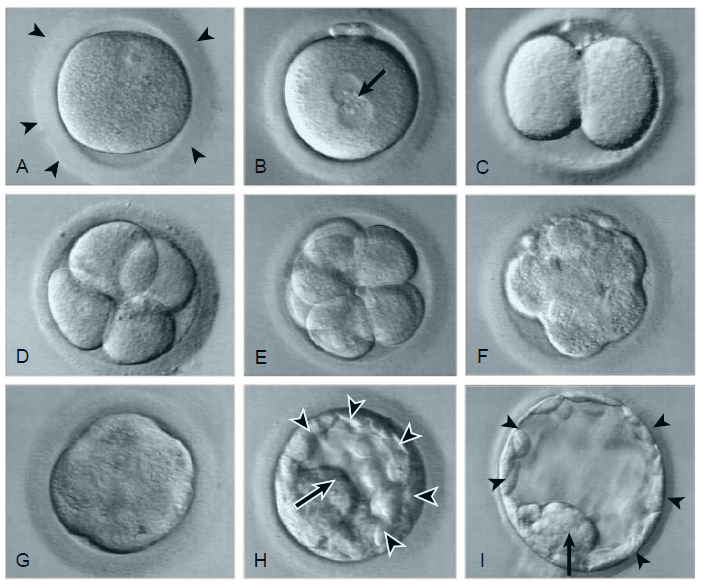
la zone pellucide (pointes de flèches). B, Peu après la fécondation in vitro (FIV),
les pronoyaux mâle et femelle (flèches) se sont formés. C, Stade à deux cellules. D, Stade à quatre cellules. E, Stade à huit cellules. F, Morula initiant la compaction. G, Morula compactée. H, Blastocyste précoce,
avec trophoblaste (pointes de flèches) et masse cellulaire interne (flèche). L’éclosion de la zone pellucide n’a pas eu lieu. I, Blastocyste éclos, avec
trophoblaste (pointes de flèches) et masse cellulaire interne (flèche). Le blastocoele au centre est bien visible. Source : Larsen’s Human Embryology, Elsevier

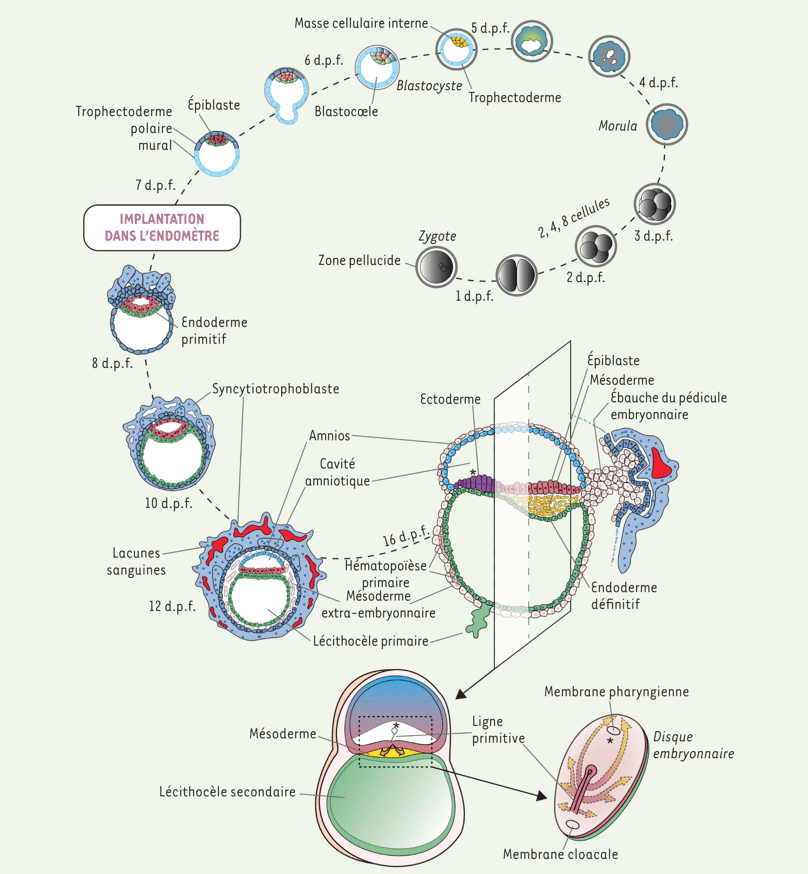
Clivages précoces (1 à 3 jours) : Succession de divisions cellulaires produisant 2, 4, puis 8 cellules. Morula (4 jours) : Sphère compacte de cellules.
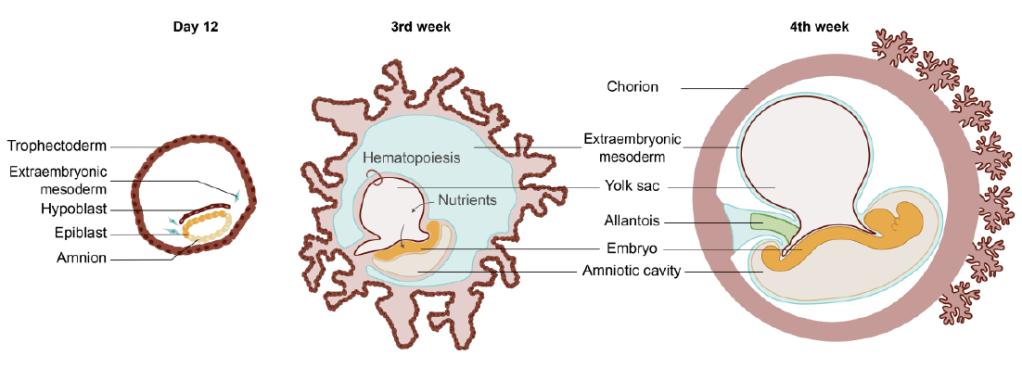
Blastocyste (5–6 jours) : Formation d’une cavité (blastocoele), différenciation en trophectoderme et masse cellulaire interne (futur embryon). Implantation (7–8 jours) : Le blastocyste s’implante dans l’endomètre. La masse cellulaire interne donne naissance à l’épiblaste et à l’hypoblaste (endoderme primitif). Le trophectoderme se différencie en trophectoderme mural et polaire. Développement des annexes embryonnaires (10–12 jours) : Formation du syncytiotrophoblaste (interface avec l’endomètre maternel), apparition de la cavité amniotique. Formation du mésoderme extra-embryonnaire et des lacunes sanguines : mise en place du support vasculaire nécessaire aux échanges avec la mère. Gastrulation (16 jours) : Apparition de la ligne primitive, formation du mésoderme intra-embryonnaire, mise en place des trois feuillets embryonnaires (ectoderme, mésoderme, endoderme définitif) dans le disque embryonnaire tridermique. dpf = jours après la fécondation. Source : https://www.medecinesciences.org/en/articles/medsci/full_html/2023/02/msc220234/msc220234.html
Pour le reste, le modèle souris a longtemps été la référence pour le développement des mammifères mais il existe de grandes différences entre le développement des rongeurs et des primates (dont le dernier ancêtre commun date d’environ 75 millions d’années), notamment la topologie générale de l’embryon au stade de la gastrulation.
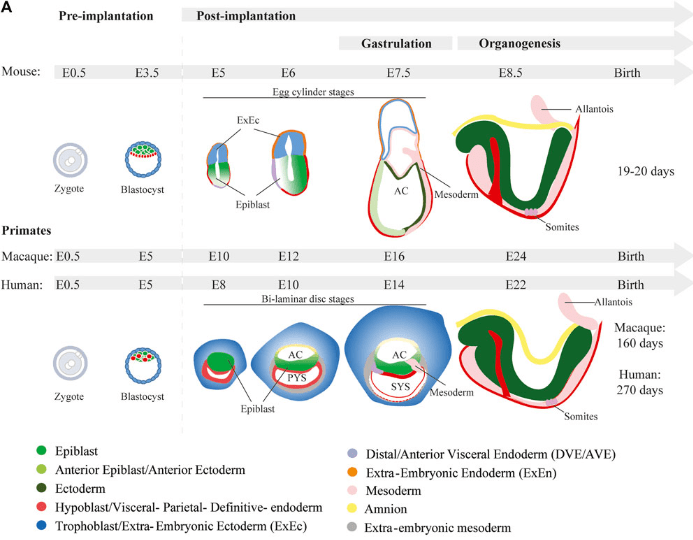
Egalement, la spécification de l’endoderme primitif chez l’homme ne dépend pas de la voie de signalisation FGF2 contrairement à ce qu’il se passe chez la souris (Roode et al., 2012) et l’expression de CDX2 qui est le marqueur du trophectoderme est activé au stade blastocyste chez l’Homme alors qu’il est activé plus tôt, dès le stade morula chez la souris (Niakan et al., 2013). Toutes ces différences plaident pour ne pas transposer directement les découvertes faites chez la souris chez l’Homme et pour le développement de modèles humains.
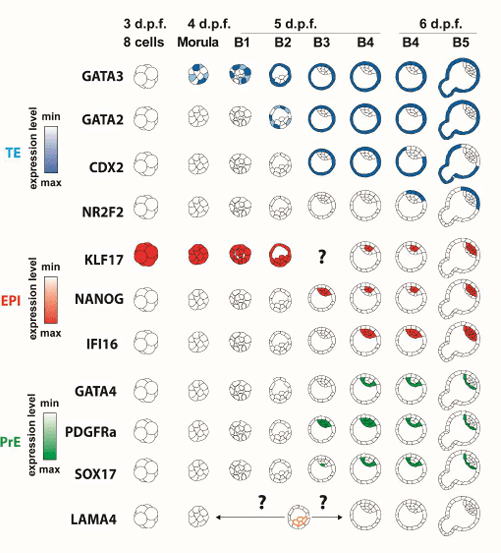
Les cellules souches pluripotentes que ce soit les cellules embryonnaires souches (ES) issues des blastocytes ou les cellules induites iPS sont maintenant une grande ressource pour connaître les étapes du développement embryonnaire humain et pouvoir expérimenter sur ces étapes. La topologie en 2D de la culture cellulaire classique a laissé la place à des cultures en 3D menant à la formation d’organoïdes qui présentent des similitudes importantes avec les mêmes organes dans les embryons.
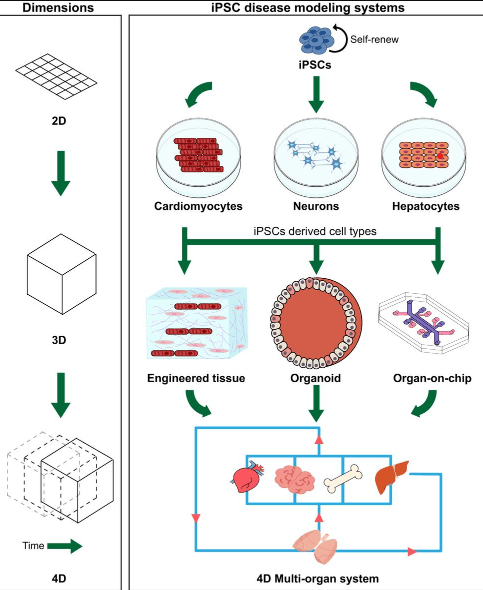
Des blastocystes issues de cellules pluripotentes humaines (ES ou iPS) avec une bonne organisation tridimensionnelle ont pu être obtenus avec divers protocoles (Luijkx et al., 2022).
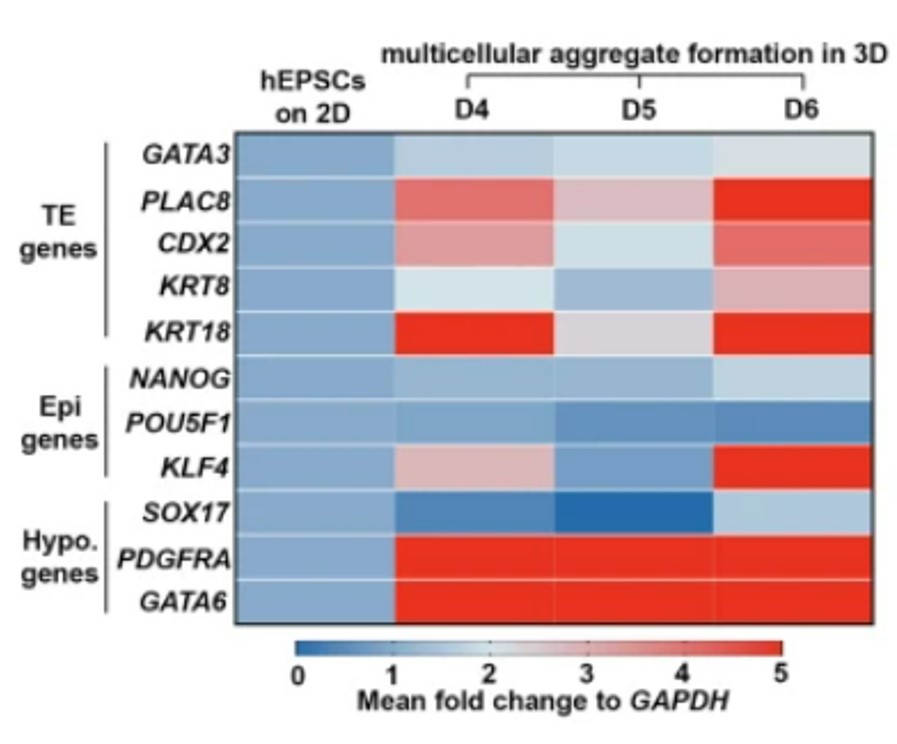
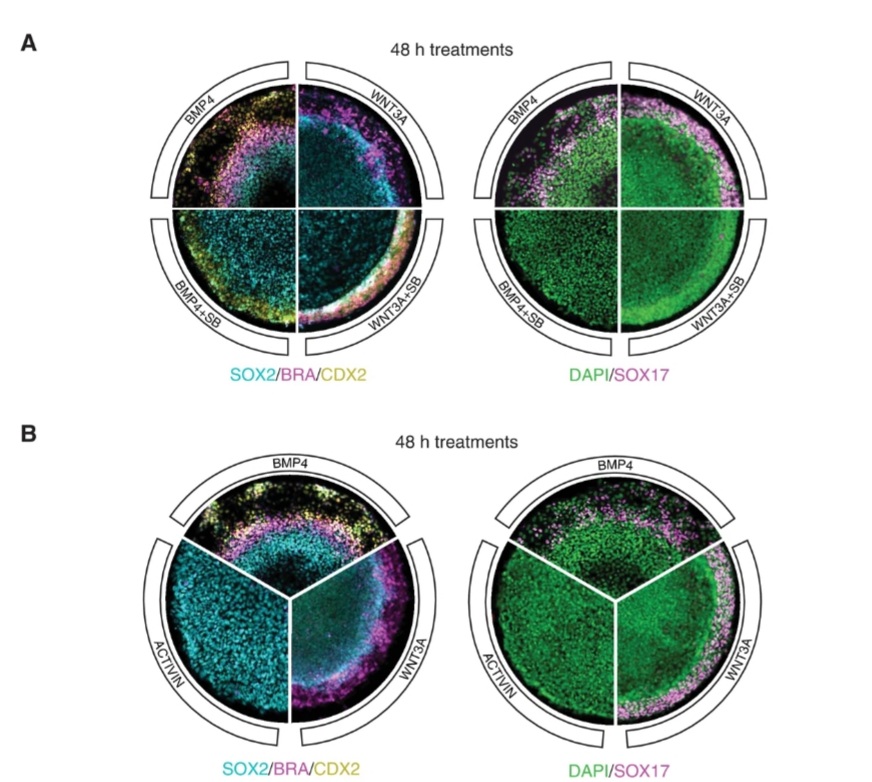
Egalement, Warmflash et al., 2014 ont rapporté que les cellules ES humaines cultivées dans des micro-disques recouverts de matrice extracellulaire (ECM) et stimulées avec BMP4, se différencient de manière reproductible en anneaux cellulaires, exprimant des marqueurs d’ectoderme, mésoderme, endoderme et de trophectoderme, disposés à partir du centre vers la périphérie. Les cellules mésendodermiques dans ces cultures présentent des caractéristiques de transitions épithélio-mésenchymateuses. Des gastruloïdes humains ont pu être obtenus et permettre l’étude des voies de signalisation BMP, Nodal et Wnt durant une période de développement jusqu’alors inaccessible (Yoney et al., 2018; Chhabra et al. 2019).
En parallèle de ces modèles, il y a eu une amélioration des conditions de culture de « vrais » embryons humains issus de fécondation in vitro (et non des modèles dérivés de cellules souches ES ou iPS) qui a repoussé les limites jusqu’à 14 jours de développement qui sont maintenant pleinement accessibles à l’expérimentation in vitro (dans les limites des règlements éthiques des différents pays).
En France, il est interdit de générer des embryons pour la recherche et seuls des embryons surnuméraires d’un projet de fécondation in vitro pour un couple peuvent être utilisés (avec le consentement du couple). Il est aussi interdit de réimplanter des embryons qui auraient été modifiés, notamment génétiquement (par exemple par la méthode CRISPR/Cas9). Toutes les études doivent être autorisées au préalable par l’Agence de la Biomédecine.
SITES POUR ALLER PLUS LOIN SUR LE DEVELOPPEMENT HUMAIN :
- Adhérences cellule-cellule
- Arabidopsis thaliana
- Axe antéro-postérieur chez la drosophile
- Biomécanique du développement
- Caenorhabditis elegans
- Concepts principaux
- Contrôle de la traduction
- Contrôle de la transcription
- Contrôle génétique et épigénétique
- Croissance du tube pollinique et double fécondation chez les Angiospermes
- Croissance et guidage axonal
- Des modèles animaux moins classiques
- Développement de l’oeil des Vertébrés
- Développement et évolution
- Exercices sur l’ovogenèse, la spermatogenèse et la fécondation
- Exercices sur le contrôle de l’expression des gènes
- Exercices sur le développement des bourgeons de membre
- Exercices sur le développement des muscles striés squelettiques
- Exercices sur le développement des végétaux et les hormones végétales
- Exercices sur les cycles et les divisions cellulaires
- Exercices sur les étapes du développement, les inductions embryonnaires et la mise en place des axes de polarité
- Exercices sur les matrices extracellulaires, le cytosquelette et les adhérences cellule-cellule
- Exercices sur les voies de signalisation
- Glossaire
- Glossaire des termes liés à la génétique
- Glossaire des termes liés au cytosquelette, la matrice extracellulaire, l’adhérence et la migration cellulaire
- Hématopoïèse et développement des cellules du système immunitaire
- Histoire de la biologie cellulaire et de la biologie du développement
- L’acide rétinoïque
- L’apoptose
- L’autophagie
- L’organogenèse
- L’ovogénèse prépare le développement embryonnaire
- La drosophile
- La fécondation
- La formation des somites
- La gastrulation
- La gastrulation (version allégée)
- La métamorphose chez les Hexapodes et les Amphibiens
- La neurogénèse chez les mammifères adultes
- La neurulation
- La poule
- La signalisation calcique
- La souris
- La superfamille TGFβ et ses voies de signalisation
- La voie de signalisation de l’auxine et ses rôles
- La voie de signalisation Hedgehog
- La voie de signalisation Hippo et ses composants YAP/TAZ
- La voie de signalisation Notch
- Le clivage
- Le cytosquelette
- Le destin des cellules et les réseaux de régulation génique
- Le développement des bourgeons de membre
- Le développement des muscles striés squelettiques
- Le développement des organes génitaux et des cellules germinales
- Le développement du cortex
- Le méristème apical caulinaire en phase végétative et lors de la formation d’une fleur
- Le poisson zèbre
- Le xénope
- Les cellules des crêtes neurales
- Les cellules et les gènes en action dans le développement
- Les cellules souches
- Les cellules tumorales
- Les cycles et les divisions cellulaires
- Les étapes du développement
- Les étapes du développement embryonnaire d’Arabidopsis thaliana et leur contrôle
- Les inductions embryonnaires et les gradients de morphogène
- Les matrices extracellulaires animales
- Les organismes modèles
- Les outils pour étudier l’expression et la fonction des gènes
- Les parois des cellules végétales
- Les techniques et les outils pour la biologie cellulaire
- Les transitions épithélio-mésenchymateuses et les migrations cellulaires
- Les vésicules extracellulaires
- Les voies de signalisation
- Les voies de signalisation FGF
- Mise en place des axes chez les Vertébrés
- Structures et processus cellulaires
- Voies de signalisation WNT
