Par Patrick Pla, Université Paris-Saclay
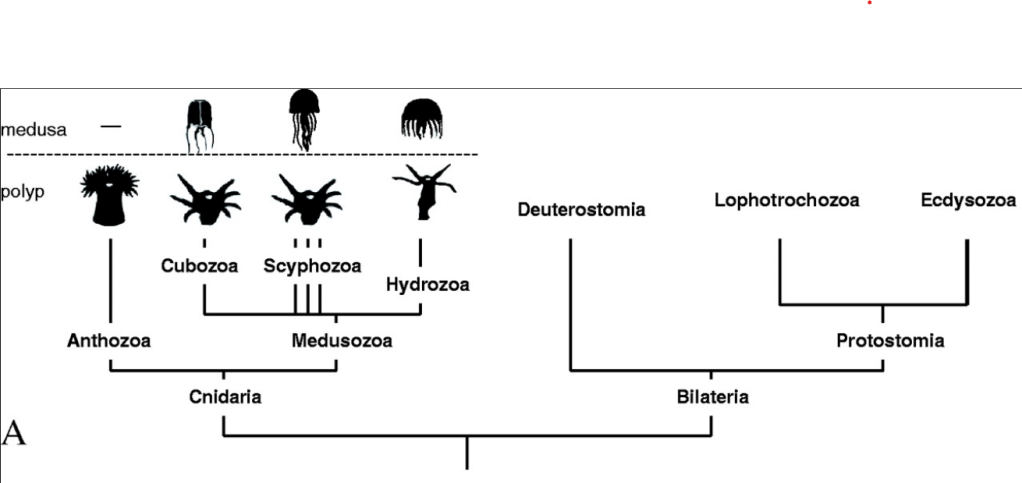
Les modèles « classiques » (drosophile, poulet, xénope, souris…) ont été choisis pour des raisons historiques et pratiques mais il faut parfois se garder de généraliser ce qui a été découvert chez eux. Par exemple, la mise en place de l’axe antéro-postérieur de la drosophile est un cas très particulier parmi les Insectes. La compréhension de la diversité du vivant et la mise en pratique d’une approche évo-dévo (lien entre la biologie du développement et l’évolution des organismes) nécessite une diversité d’organismes à étudier. En voici quelques-uns et c’est bien entendu une liste non exhaustive.
Nematostella vectensis (Cnidaire); Platynereis dumerilii (Annélides); Tribolium (Héxapode); L’oursin (Echinoderme); L’ascidie (Urocordé)
Un autre modèle « non classique » : la planaire est présenté dans
la partie sur la régénération chez les animaux.
Nematostella vectensis (Cnidaires)

Les Cnidaires sont des organismes à deux feuillets embryonnaire (pas de mésoderme) et à symétrie radiaire (mais avec une symétrie bilatérale résiduelle chez des Anthozoaires comme les anémones de mer et Nematostella).
Ils sont surtout étudiés pour la mise en place de leur axe de polarité oral-aboral qui présente des similitudes avec l’axe antéro-postérieur des Bilatériens (notamment l’expression des gènes orthologues aux gènes Hox mais pas seulement (voir plus loin)) et pour leur capacité de régénération. Les Cnidaires expriment aussi Brachyury qui est un marqueur important du mésoderme chez les Bilatériens alors même que chez les Cnidaires, il n’y a pas de mésoderme. Chez Nematostella vectensis, il marque la région orale.


Le séquençage complet de cette espèce a été réalisée en 2007 (Putnam et al., 2007).
Signalons que l’hydre d’eau douce est aussi un modèle courant parmi les Cnidaires.
Platynereis dumerilii (Annélides)

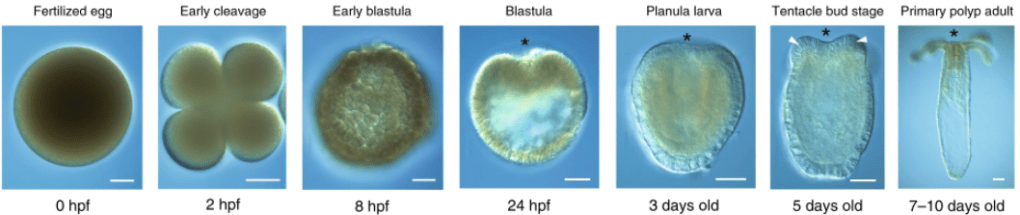
Platynereis dumerilii est un Annélide Polychète qui vit à proximité des côtes dans les mers et océans tempérés et tropicaux. L’adulte est long de 2 à 4 cm (les mâles sont plus courts). Son développement embryonnaire dure 24 heures (avec notamment une phase de clivage de type spiral) et aboutit à la production d’une larve trochophore qui commence sa métamorphose 48 heures après la fécondation. Un seul croisement de Platynereis permet de produire des milliers d’embryons (mais un individu ne peut participer qu’à une seule fécondation car il meurt après avoir émis ses gamètes).
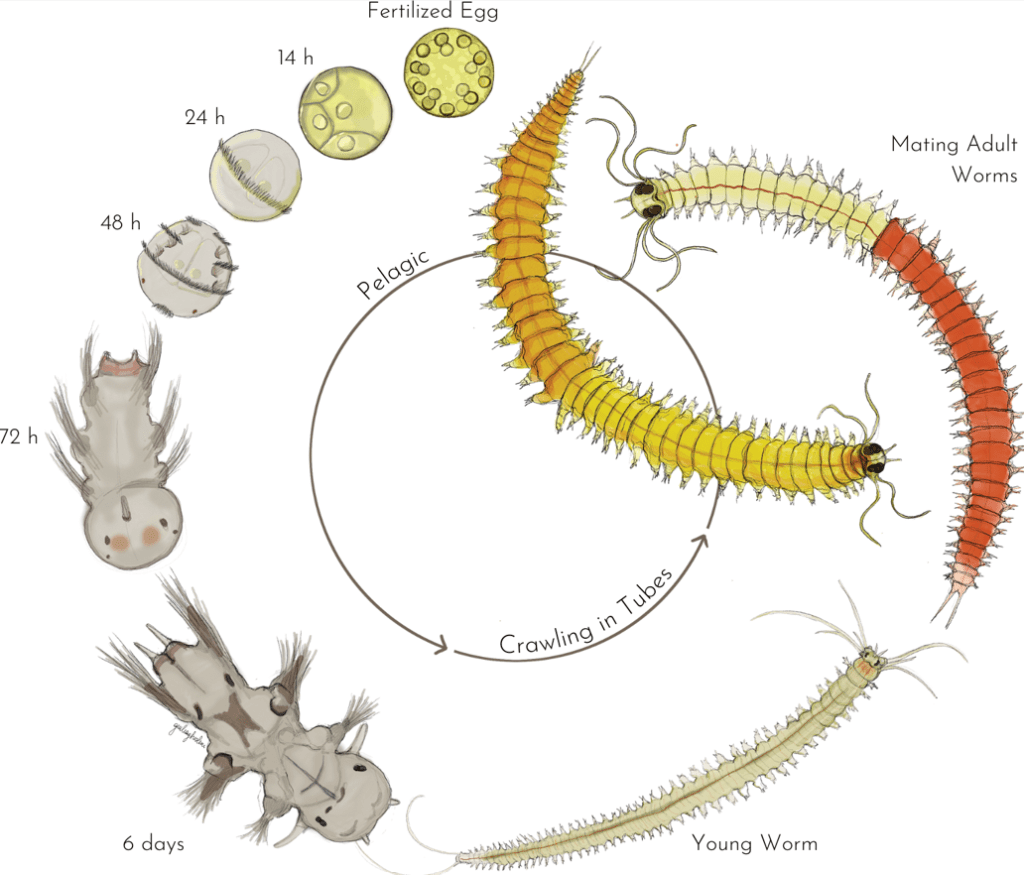
Voir les stades de développement de Platynereis.
Cet animal est devenu le modèle principal d’Annélide étudié. On peut réaliser de la transgénèse avec de l’ADN transposase ou de manière plus ciblée on peut introduire des modifications génétiques avec la méthode TALEN ou la méthode CRISPR-Cas9 (Bezares-Calderon et al., 2018). Il existe un très important polymorphisme génétique parmi les souches utilisées dans les laboratoires ce qui peut gêner certaines études génétiques.
En tant qu’organisme segmenté en métamères comme les Arthropodes et les Vertébrés, son étude présente de nombreux intérêts pour comprendre l’origine de la métamérie chez les Bilatériens. Son étude permet ainsi de mieux reconstituer les caractéristiques d’Urbilateria, l’ancêtre commun de tous les Bilatériens. Platynereis est aussi étudié pour ses capacités importantes de régénération.
Tribolium (Héxapode)
Il s’agit du ver de farine, un insecte dit ravageur, de la famille des Coléoptères et dont la larve peut s’attaquer à des stocks de farine.


Tribolium constitue un excellent modèle alternatif d’insecte à la drosophile. Son génome a été séquencé en 2008 (Tribolium Genome Sequencing Consortium, 2008). Le développement des segments de Tribolium se fait par croissance postérieure et non pas directement sur toute la longueur du corps comme chez la drosophile qui constitue plutôt une exception parmi les Insectes. Ainsi, certains processus de développement de Tribolium sont plus représentatifs et comparables à ceux des mammifères (Schroder et al., 2008). Les gènes ancestraux impliqués dans la communication entre les cellules et exprimés dans la zone de croissance pour l’extension de l’axe antéro-postérieur lors du développement font de Tribolium une espèce idéale pour étudier l’évolution du développement, notamment la spécification des segments.
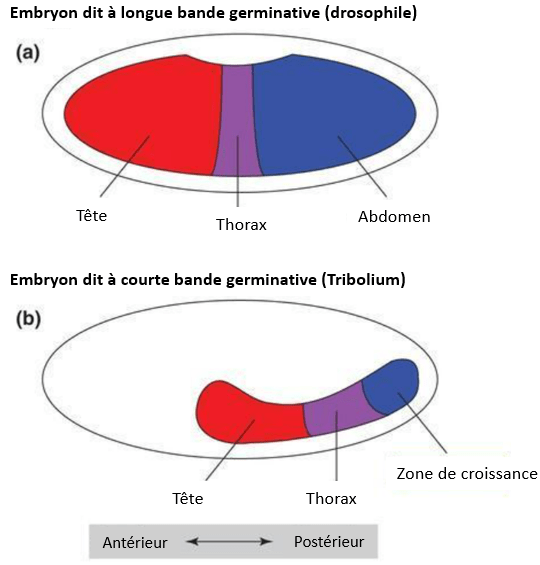
Il n’y a pas de bicoid chez Tribolium. La région antérieure est spécifiée à la place par une interaction synergique entre hunchback et orthodenticle (Schröder, 2003).
AUTRE RESSOURCE : https://planet-vie.ens.fr/thematiques/manipulations-en-svt/le-petit-ver-de-farine-tribolium-castaneum-elevage-et-utilisations
L’oursin (Echinoderme)
Les Echinodermes tels que les oursins ou les étoiles de mer sont des Deutérostomiens (le blastopore donne l’anus, la bouche se forme secondairement) et sont donc plus proches évolutivement des Vertébrés que les Arthropodes. Les larves d’Echinoderme (appelées pluteus) ont une symétrie bilatérale. Cette symétrie est modifiée lors de la métamorphose et devient une symétrie pentaradiée.
Plusieurs espèces d’oursin sont étudiées en laboratoire : Strongylocentrotus purpuratus (l’oursin pourpre) qui vit sur les côtes américaines et Paracentrotus lividus qui vit en Mer Méditerranée.



L’oursin est un modèle très classique pour étudier la fécondation.
L’oursin présente un certain nombre de différences avec la fécondation des Mammifères. Par exemple, la méiose est terminée au moment de l’entrée du spermatozoïde, donc il y a un véritable stade ovule alors que chez les Mammifères, ce stade n’existe pas en réalité (la fécondation concerne un ovocyte bloqué en métaphase II). Egalement, après la réaction acrosomale, des microfilaments d’actine se polymérisent dans le spermatozoïde pour former la protubérance acrosomiale chez l’oursin, ce qui n’a pas lieu chez les Mammifères. Signalons que l’ovocyte (et l’ovule) de l’oursin est oligolécithe. Il possède un peu de réserves énergétiques (en contraste avec l’ovocyte des Mammifères (en dehors des Monotrèmes) qui n’ont quasiment aucune réserve énergétique (ovocyte alécithe)).
C’est également un bon modèle pour étudier la détermination (et la non-détermination) cellulaire. En 1892, Hans Driesch a montré qu’en séparant les 2 (voire même les 4) premiers blastomères de l’oursin, on pouvait obtenir 2 (ou 4 larves), plus petites qu’habituellement, mais assez bien formées.

Cela démontrait la totipotence de ces cellules et aussi les capacités de régulation importantes des embryons à ce stade. Les expériences de Boveri sur des embryons d’oursins en 1901 ont montré que les modèles de développement pouvaient être déterminés par des gradients opposés.
Le génome de Strongylocentrotus purpuratus a été entièrement séquencé : il est quatre fois plus compact (800 millions de pb) que celui de l’Homme pour environ un même nombre de gènes (33.491 gènes) (Sea Urchin Sequencing Consortium, 2006). Il est bien adapté à l’étude des réseaux de régulation génique.
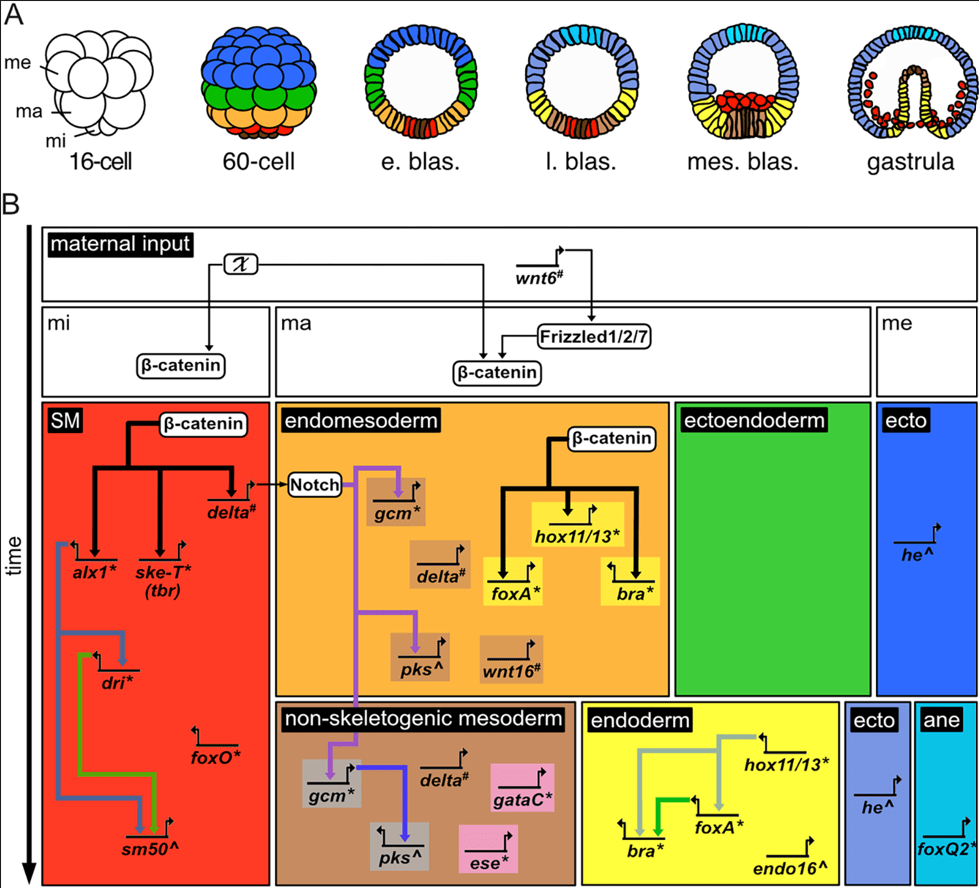
(A) Schémas illustrant les feuillets embryonnaire d’un oursin à 6 stades différents : stade 16 cellules (16-cell), stade 60 cellules (60-cell), stade blastula précoce (e. blas.), stade blastula tardif (l. blas.), stade blastula mésenchymateux (mes. blas.), stade gastrula (gastrula). Les domaines embryonnaires sont codés par couleur : neuroectoderme antérieur = cyan ; ectoderme = bleu foncé et clair ; ectoendoderme = vert ; endoderme = jaune ; endomésoderme = orange ; mésoderme non squelettique = marron clair ; mésoderme squelettique = rouge ; petits micromères = marron foncé ; indéterminé = blanc. Abréviations : ma, macromères ; me, mésomères ; mi, micromères. (B) Réseau de régulation génique simplifié de l’oursin, basé sur les données de Paracentrotus lividus, Lytechinus variegatus et Strongylocentrotus purpuratus. Dans le réseau génique, chaque domaine embryonnaire est mis en évidence par des cases utilisant le même code couleur qu’en (A), avec en plus le gris pour le mésoderme non squelettique aboral (dorsal) et le rose pour le mésoderme non squelettique oral (ventral). Les gènes sont nommés en fonction de leurs protéines correspondantes et indiqués par des lignes avec des flèches courbées. Les protéines sont présentées dans des cases blanches. Le réseau met en évidence la répartition par feuillet embryonnaire des gènes étudiés et les relations de régulation connues entre eux, directes ou indirectes (les flèches indiquant une activation transcriptionnelle). La progression développementale s’effectue de haut en bas. Abréviations et sigles : * = facteur de transcription; # = composant de voie de signalisation; ^ = gène marqueur de différenciation; ane = neuroectoderme antérieur ; ecto = ectoderme ; ma = macromères ; me = mésomères ; mi = micromères ; SM = mésoderme squelettique ; X = mécanisme d’activation inconnu. Source : https://journals.plos.org/plosbiology/article?id=10.1371/journal.pbio.3002880
Site de référence sur l’oursin.
Pour réaliser une fécondation in vitro chez l’oursin.
L’ascidie (Urocordé)
On peine à voir dans une ascidie adulte un organisme qui est plus proche de nous qu’un Insecte par exemple et Cuvier avait rangé l’ascidie parmi les Mollusques. Mais l’observation de la larve par Alexandre Kowalevsky (1840-1901) a révélé la présence d’une chorde, d’un tube neural dorsal qui nous permet de classer l’ascidie parmi les cordés épineuriens.

Trois espèces d’ascidies assez proches ont été étudiées pour leur développement : Ciona intestinalis, Styela partita et Phallusia mammillata.
Pour voir une vidéo du développement d’une ascidie, suivre ce lien.
L’étude des ascidies a historiquement permis de comprendre le rôle du cytoplasme dans la détermination cellulaire. En 1905, Edward Conklin a observé que le cytoplasme coloré en jaune de Styela partita était toujours, au cours des divisions cellulaires, hérité par les cellules dont les descendantes allaient donner des cellules musculaires.

Si on retire les cellules qui héritent de ce cytoplasme jaune (les blastomères B4.1) alors il n’y a plus de cellules musculaires. Si du cytoplasme jaune est transféré dans une cellule qui ne donne habituellement pas de muscle alors sa destinée change et elle donne du tissu musculaire. On a depuis compris le déterminisme moléculaire des propriétés de ce cytoplasme : il contient des ARNm qui permettent de synthétiser la protéine macho qui engage les cellules dans le lignage musculaire (Nishida et Sawada, 2001). Il s’agit d’un exemple classique de déterminisme de lignage autonome, par héritage de cytoplasme au cours des divisions cellulaires sans besoin d’induction en provenance des cellules voisines.
En raison de sa carte des territoires présomptifs précise très précoce avec un petit nombre de cellules, l’embryon d’ascidie est un système idéal pour élucider les mécanismes liés au positionnement des cellules au cours de la morphogenèse d’une blastula de chordés. Étant donné que les embryons d’ascidies présentent un modèle de clivage invariant sans migration cellulaire, ni mort cellulaire jusqu’au moment de la gastrulation, l’orientation du plan de division cellulaire est déterminante (Dumollard et al., 2017). Tous les blastomères ont un destin spécifié dans la blastula à 64 cellules et la plupart des divisions cellulaires au stade de 32 cellules sont des divisions asymétriques avec des destinées différentes pour chacune des cellules-filles (Lemaire et al., 2008).

L’ascidie se prête particulièrement bien à des analyses en scRNAseq (analyse transcriptomique en cellule unique) pour comprendre la spécification des destins cellulaires (Winkley et al., 2021).
EQUIPES FRANCOPHONES QUI TRAVAILLENT SUR DES MODELES MOINS CLASSIQUES :
Equipe « Biologie du développement comparative et régénération » – IGFL Lyon
Laboratoire de Biologie du Développement – CNRS Villefranche-sur-Mer
Equipe « Cellules souches, développement et évolution » – Institut Jacques Monod, Paris
Equipe « Réponse au stress, régénération et longévité » – IRCAN, Nice
- Adhérences cellule-cellule
- Arabidopsis thaliana
- Axe antéro-postérieur chez la drosophile
- Biomécanique du développement
- Caenorhabditis elegans
- Concepts principaux
- Contrôle de la traduction
- Contrôle de la transcription
- Contrôle génétique et épigénétique
- Croissance du tube pollinique et double fécondation chez les Angiospermes
- Croissance et guidage axonal
- Développement de l’oeil des Vertébrés
- Développement et évolution
- Et l’Humain ?
- Exercices sur l’ovogenèse, la spermatogenèse et la fécondation
- Exercices sur le contrôle de l’expression des gènes
- Exercices sur le développement des bourgeons de membre
- Exercices sur le développement des muscles striés squelettiques
- Exercices sur le développement des végétaux et les hormones végétales
- Exercices sur les cycles et les divisions cellulaires
- Exercices sur les étapes du développement, les inductions embryonnaires et la mise en place des axes de polarité
- Exercices sur les matrices extracellulaires, le cytosquelette et les adhérences cellule-cellule
- Exercices sur les voies de signalisation
- Glossaire
- Glossaire des termes liés à la génétique
- Glossaire des termes liés au cytosquelette, la matrice extracellulaire, l’adhérence et la migration cellulaire
- Hématopoïèse et développement des cellules du système immunitaire
- Histoire de la biologie cellulaire et de la biologie du développement
- L’acide rétinoïque
- L’apoptose
- L’autophagie
- L’organogenèse
- L’ovogénèse prépare le développement embryonnaire
- La drosophile
- La fécondation
- La formation des somites
- La gastrulation
- La gastrulation (version allégée)
- La métamorphose chez les Hexapodes et les Amphibiens
- La neurogénèse chez les mammifères adultes
- La neurulation
- La poule
- La signalisation calcique
- La souris
- La superfamille TGFβ et ses voies de signalisation
- La voie de signalisation de l’auxine et ses rôles
- La voie de signalisation Hedgehog
- La voie de signalisation Hippo et ses composants YAP/TAZ
- La voie de signalisation Notch
- Le clivage
- Le cytosquelette
- Le destin des cellules et les réseaux de régulation génique
- Le développement des bourgeons de membre
- Le développement des muscles striés squelettiques
- Le développement des organes génitaux et des cellules germinales
- Le développement du cortex
- Le méristème apical caulinaire en phase végétative et lors de la formation d’une fleur
- Le poisson zèbre
- Le xénope
- Les cellules des crêtes neurales
- Les cellules et les gènes en action dans le développement
- Les cellules souches
- Les cellules tumorales
- Les cycles et les divisions cellulaires
- Les étapes du développement
- Les étapes du développement embryonnaire d’Arabidopsis thaliana et leur contrôle
- Les inductions embryonnaires et les gradients de morphogène
- Les matrices extracellulaires animales
- Les organismes modèles
- Les outils pour étudier l’expression et la fonction des gènes
- Les parois des cellules végétales
- Les techniques et les outils pour la biologie cellulaire
- Les transitions épithélio-mésenchymateuses et les migrations cellulaires
- Les vésicules extracellulaires
- Les voies de signalisation
- Les voies de signalisation FGF
- Mise en place des axes chez les Vertébrés
- Structures et processus cellulaires
- Voies de signalisation WNT