Par Patrick Pla, Université Paris-Saclay
La mise en place des circuits neuronaux dans le système nerveux résulte d’une convergence de facteurs génétiques et environnementaux. La croissance et le guidage des axones est une étape clé de la mise en place de cette connectivité. Rappelons que le corps humain contient 1011 neurones, chacun formant en général 103 à 104 synapses, ce qui fait 1014-1015 connexions synaptiques. L’identité d’un neurone dépend fondamentalement à quelle cible il est connecté.
Au cours de leur différenciation, les neurones étendent d’abord plusieurs neurites qui ont tous le potentiel de devenir l’axone (stade 2) (Schelski et Bradke, 2017). Cette symétrie initiale est rompue lorsque l’un des neurites commence à s’étendre rapidement en tant qu’axone (stade 3), tandis que les autres neurites ne grandissent plus pendant un certain temps puis se différencient en dendrites (stade 4). La sélection d’un seul neurite comme axone est contrôlée par des signaux de rétroaction positifs et négatifs qui, respectivement, favorisent la formation d’axones et empêchent les neurites restants de se développer en axones (Arimura et Kaibushi, 2007).
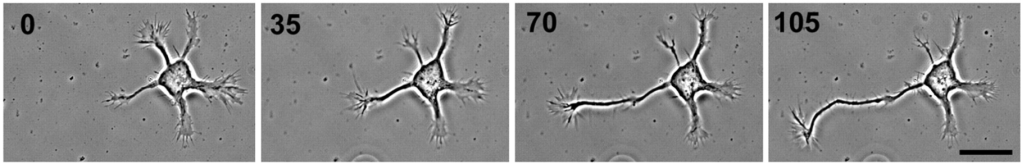
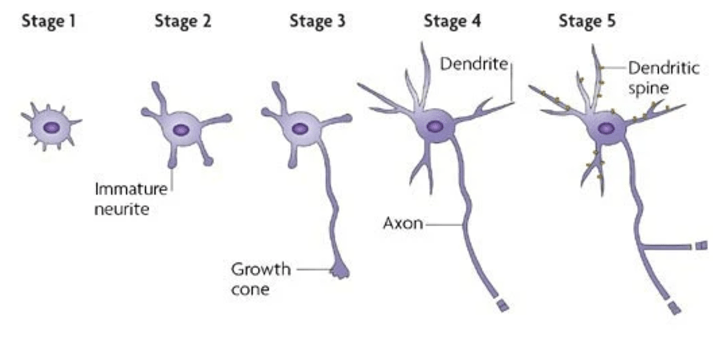
Une version commentée de cette figure est disponible en vidéo.
Source : https://www.nature.com/articles/nrn2056
Les axones ont une épaisseur comprise entre 0,1 et 15 µm mais peuvent avoir une longueur qui dépasse le mètre, ce qui implique un important contrôle de leur croissance sur un trajet qui peut être très long. L’étude de ces processus peut aussi être utile pour pouvoir stimuler la régénération axonale après une blessure.

- Rôle du cytosquelette
- Une intégration de signaux attractifs et répulsifs
- Traduction locale et stabilité protéique dans les cônes de croissance
- La mise en place des ramifications
- La régénération axonale
Rôle du cytosquelette
Les signaux qui contrôlent croissance et guidage des axones activent des cascades de signalisation qui mènent très souvent à des modifications du cytosquelette. Le guidage axonal peut être considéré comme un cas particulier de migration avec le corps cellulaire qui ne bouge pas et seulement l’avant de l’axone qui se déplace (cône de croissance). C’est pourquoi on trouve de nombreuses structures cellulaires ou acteurs moléculaires en commun entre croissance axonale et migration cellulaire (dont le cytosquelette et les protéines associées).
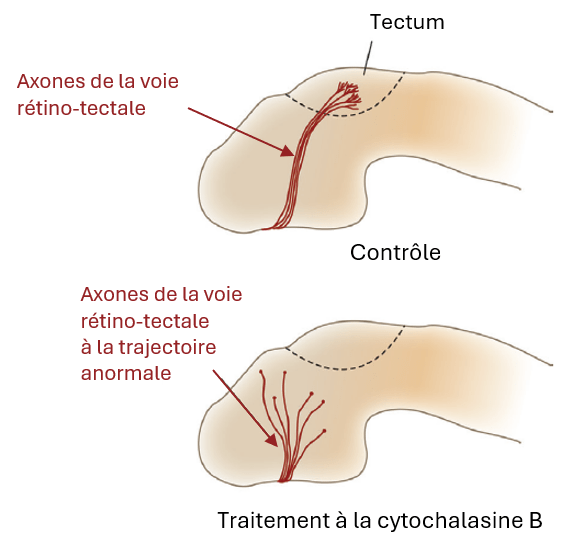
Un commentaire enrichi de cette figure est disponible en vidéo.
Source : https://www.sciencedirect.com/science/article/abs/pii/089662739390181P
L’extrémité des axones forme des cônes de croissance, soutenus par un réseau dynamique de microfilaments et de manière plus limitée, de microtubules. La polymérisation et la dépolymérisation cycliques des filaments d’actine dans le cône de croissance sont nécessaires pour générer la force mécanique qui provoque l’allongement axonal. Les cônes de croissance présentent une structure similaire aux lamellipodes des cellules migrantes avec également des filopodes.
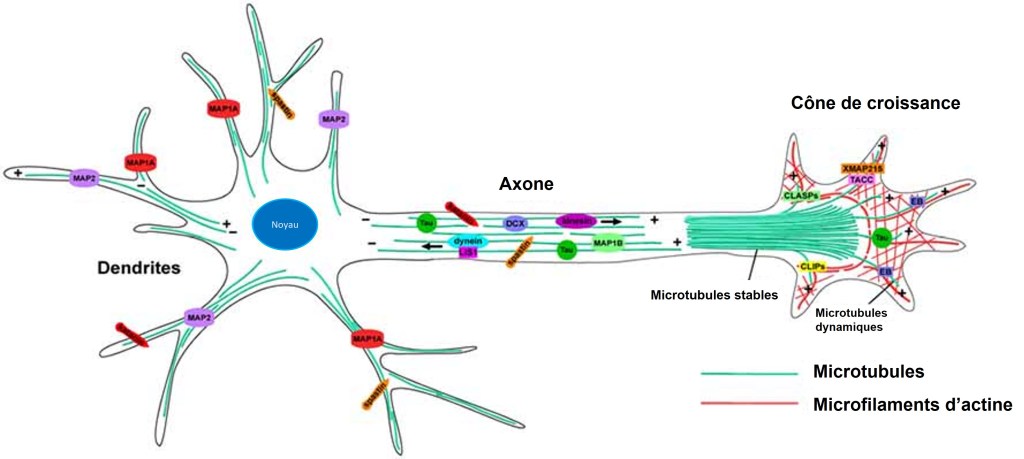
Une version commentée de cette figure est disponible en vidéo.
Source : https://www.frontiersin.org/articles/10.3389/fncel.2018.00165/full
La stabilisation des microfilaments d’actine dans les filopodes est un élément essentiel qui va faire « tourner » le cône de croissance vers un signal attractif. Les microtubules locaux doivent aussi être stabilisés car leur fonction de « rails » pour le transport permet d’apporter les éléments nécessaires à la reponse du cône de croissance à son environnement. L’importance de la stabilisation des microtubules est aussi montrée par le fait que de faibles doses de molécules stabilisatrices comme le taxol ou les épothilones facilitent la régénération axonale et la restauration fonctionnelle dans un modèle de blessure à la moelle épinière chez le rat. L’inhibition de la fidgétine qui est une enzyme qui détruit les microtubules a le même effet (Matamaros et al. 2019).
Les deux réseaux cytosquelettiques sont coordonnés par des protéines comme la Formine-2 qui stimule la polymérisation de l’actine, tout en stabilisant les microtubules dans les cônes de croissance. La Formine-2 y interagit à la fois l’actine et avec les tubulines et cette interaction est importante pour des changements de direction des cônes de croissance (Kundu et al., 2021). Des mutations perte-de-fonction du gène codant la Formine-2 sont associées à des retards mentaux et des déficiences sensoriels, probablement en association avec cette fonction coordinatrice (Law et al., 2014, Marco et al., 2018).
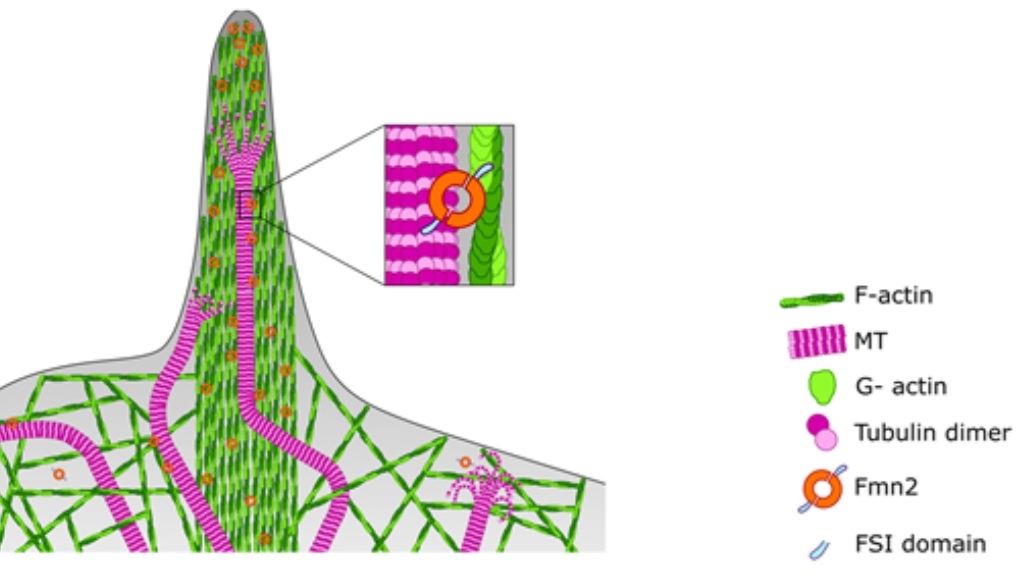
La croissance axonale ne doit pas non plus être trop excessive car les axones ne doivent pas « dépasser » leurs cibles et ne pas former trop de branchements. Par exemple, la protéine Efa6 inhibe la formation des microtubules et est nécessaire à ce que les axones aient une bonne longueur (Qu et al., 2019).
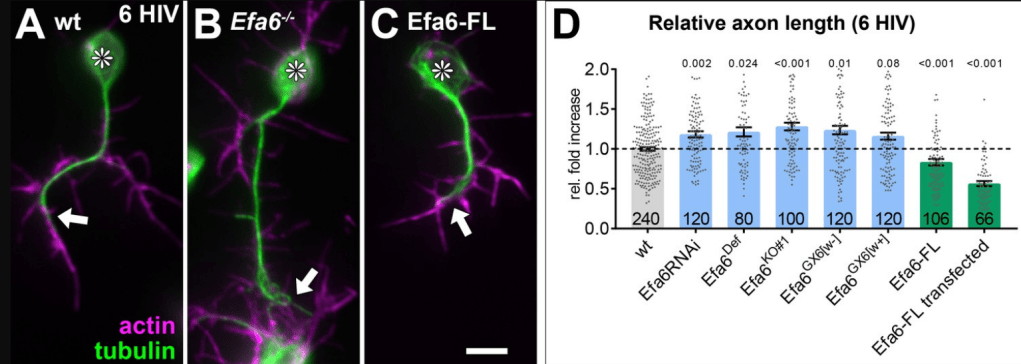
Exemples de neurones primaires de drosophile cultivés 6 heures in vitro (A–C), observés en immunofluorescence pour l’actine (magenta) et la tubuline (vert) ; les neurones sont soit des témoins de type sauvage (A), soit déficients en Efa6 (B), soit exprimant Efa6-FL :: GFP ce qui correspond à une surexpression (C) ; les astérisques indiquent les corps cellulaires, les flèches pointent vers les extrémités des axones ; Barre d’échelle en C = 10 µm. Quantification des longueurs d’axones (D). Les différents génotypes sont codés par couleur : gris, témoins de type sauvage ; bleu, différentes conditions de perte de fonction Efa6 ; vert, neurones surexprimant Efa6. Source : https://elifesciences.org/articles/50319
En amont des éléments du cytosquelette et tout particulièrement des microfilaments d’actine, on retrouve les petites GTPases Rho, Rac et Cdc42. Elles sont impliquées dans le développement des cônes de croissance et dans le guidage axonal.
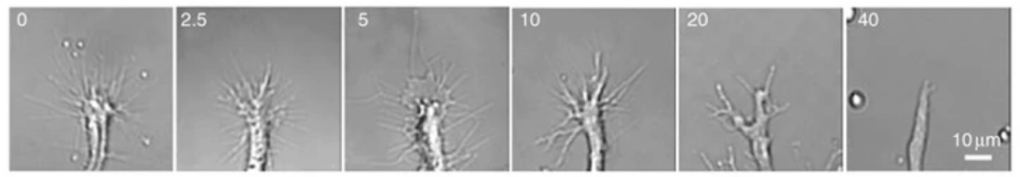
Récemment, une forme photoactivable de Rac a pu être exprimée in vivo dans des cônes de croissance de motoneurones de poisson-zèbre et la croissance des axones correspondants a pu être contrôlée par la lumière. La photoactivation de Rac a même permis de surmonter des signaux répulsifs et de faire passer des axones par des régions où ils ne peuvent pas pénétrer habituellement (Harris et al., 2020).
Une intégration de signaux attractifs et répulsifs
Les cônes de croissance « naviguent » sur de longues distances et subissent l’influence de signaux attractifs et répulsifs. Par exemple, des cônes de croissance de neurones sensitifs de ganglions de la racine dorsale (DRG) en culture vont être attirés par des fragments du tube neural dorsal mais repoussés par des fragments de tube neural ventral, expliquant que la destination habituelle des axones des neurones du DRG est le tube neural dorsal (Peterson et Crain, 1981).
Les cônes de croissance peuvent recevoir des instructions attractives ou répulsives :
- par paracrinie (ligands solubles) : par exemple, la nétrine-1, agissant par l’intermédiaire des récepteurs de la famille DCC, favorise la croissance des axones et médie l’attraction; les protéines Slit, d’autre part, sont des signaux répulsifs qui agissent à travers les récepteurs de la famille Robo (Robo1 et Robo2; Notez que Robo3 est une forme particulière qui ne se lie pas à Slit et qui agit comme un dominant-négatif sur les 2 autres récepteurs Robo, c’est-à-dire qu’il inhibe la répulsion (Sabatier et al., 2004)). Citons en exemple les axones des cellules ganglionnaires de la rétine (RGC) qui sont empêchés de croitre dans les couches de la rétine par l’expression de Slit, sauf au niveau la tâche aveugle à la base du nerf optique où les cellules expriment la nétrine et attirent les axones des RGC (Thompson et al., 2006, Höpker et al., 1999). Comme dans tous les cas de paracrinie, le gradient de diffusion des ligands impliqués est un élément essentiel. Par exemple, la diffusion de Slit est limitée en raison de leur forte affinité avec les composants de la matrice extracellulaire tels que le collagène IV et le dystroglycane (Xiao et al., 2011; Wright et al., 2012).
- par juxtracrinie (ligands transmembranaires) : Par exemple, les interactions impliquant les éphrines.
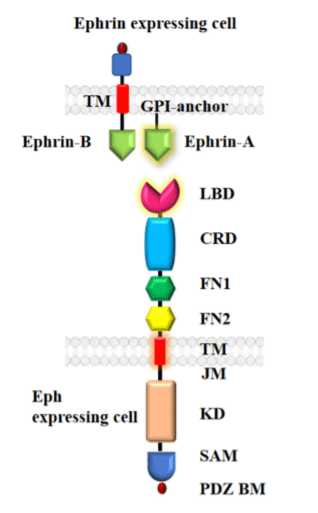
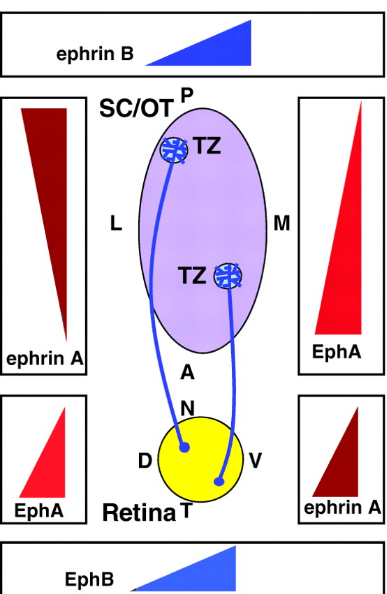
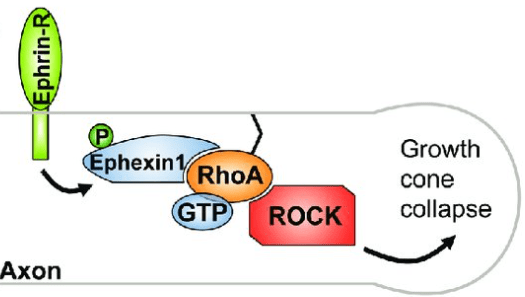
Source : https://www.tandfonline.com/doi/full/10.4161/sgtp.1.1.12672#d1e96
Les sémaphorines sont également impliquées dans le guidage axonal par juxtacrinie, même si certaines formes peuvent être secrétées et participer à la signalisation paracrine. Elles peuvent en effet être transmembranaires, ou associées à la membrane par une queue de glycosylphosphatidylinositol (GPI) mais aussi solubles.
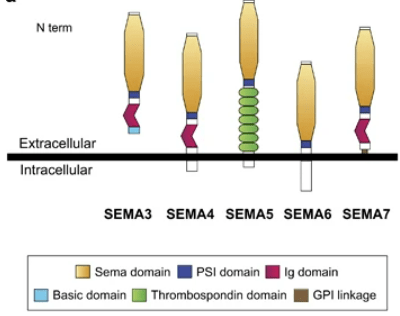
Les sémaphorines se lient aux protéines transmembranaires plexines et neuropilines. La signalisation activée par les sémaphorines au cours du développement est fondamentale pour la formation et l’organisation des circuits neuronaux. En effet, son dérèglement est lié à des maladies du développement du système nerveux telles que l’autisme et la schizophrénie (Gilabert-Juan et al., 2015, Mosca-Boidron et al., 2015).
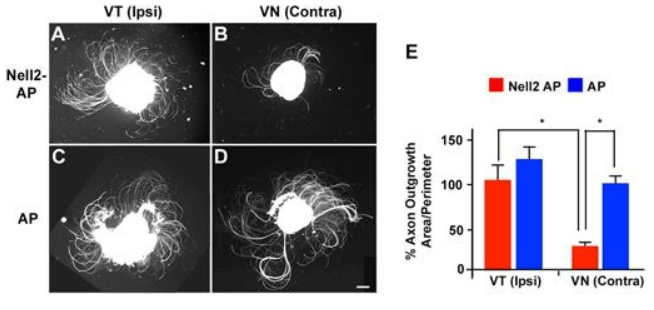
Prenons un exemple avec un ligand soluble (paracrinie). Nell2 (neural epidermal growth factor (EGF)-like-like 2, initialement identifiée chez le poussin et nommée « Nel ») est une glycoprotéine extracellulaire qui présente des similitudes structurelles avec la thrombospondine 1 et qui est principalement exprimée dans le système nerveux. Nell2 est exprimé dans la région dorso-médiale du dLGN, qui correspond au territoire du thalamus recevant les axones RGC ipsilatéraux (c’est-à-dire dont le corps cellulaire est du même côté (côté droit par exemple)). Des analyses de traçage d’axones in vivo ont montré que le régionalisation spécifique de la projection des RGC est perturbée chez les souris Nell2 knock-out (Nell2−/−) : les axones RGC controlatéraux envahissaient anormalement le domaine ipsilatéral du dLGN, alors que les axones ipsilatéraux se terminaient par des plaques partiellement fragmentées, formant ainsi un motif en mosaïque de zones de terminaison d’axones controlatéraux et ipsilatéraux. In vitro, Nell2 induit un effondrement du cône de croissance et provoque une répulsion dans les axones RGC controlatéraux, mais pas ipsilatéraux. Cette inhibition spécifique de l’axone controlatéral a été observée à la fois dans les RGC de type sauvage et Nell2-/-. Ces résultats prouvent que Nell2 agit comme une molécule de guidage inhibitrice spécifique des axones RGC controlatéraux et les empêche d’envahir le territoire ipsilatéral du dLGN (Nakamoto et al., 2019).
Un même récepteur peut être capable d’intégrer des signaux attractifs et répulsifs. Néogénine (NEO1), un récepteur à un domaine transmembranaire de la superfamille des Ig, est capable de se lier à la Nétrine-1 (qui est généralement attractrice) et à RGM (qui est répulsive). L’interaction RGM/NEO1 aboutit à l’activation de la petite GTPase Rho et à la rétraction du cône de croissance. En présence des 2 ligands, il se forme un trimère Nétrine-1/RGM/NEO1 ce qui a pour conséquence d’inhiber les effets de chacun des ligands (Robinson et al., 2021).
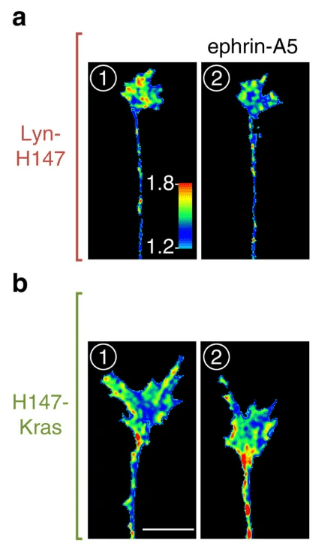
Une partie des molécules de guidage axonal, notamment la Nétrine-1, la sémaphorine-3A et des éphrines, nécessite des radeaux lipidiques pour attirer ou repousser les axones. Les radeaux lipidiques sont des microdomaines hautement ordonnés et dynamiques de la membrane plasmique qui sont enrichis en cholestérol, en sphingolipides et en gangliosides, et sont essentiels pour un large éventail de voies de signalisation. Par exemple, les éphrines de type A nécessaires au développement de la rétinotopie (organisation spatiale des projections axonales en provenance de la rétine), induisent une réduction de la concentration d’AMPc spécifiquement à proximité des radeaux lipidiques dans les cônes de croissance des cellules ganglionnaires rétiniennes. La rétraction des axones nécessite en revanche une forte signalisation AMPc à proximité des radeaux lipidiques. Tout dépend de l’adressage ou de l’exclusion des sous-types d’adénylyl cyclase des radeaux lipidiques (Averaimo et al., 2016).
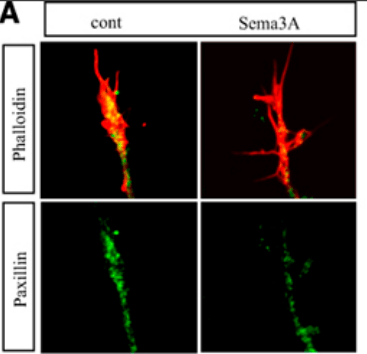
Les facteurs attracteurs ou répulsifs peuvent agir sur les interactions cône de croissance-matrice extracellulaire (MEC) qui sont importants pour la croissance et le guidage axonal. Par exemple, la Sémaphorine-3A (sema3A) qui agit via des récepteurs Neuropiline/Plexine peut diminuer l’état d’activation de l’intégrine β1 (c’est-à-dire diminuer ses capacités à interagir avec la MEC) et promouvoir le désassemblage des points focaux d’adhérence contenant la paxilline (Bechara et al., 2008). Ces points focaux sont des éléments essentiels de la motilité où la cellule prend appui sur la MEC pour avancer. Leur désassemblage constitue donc un frein majeur à la croissance axonale dans une région où il y a de la Sémaphorine-3A.
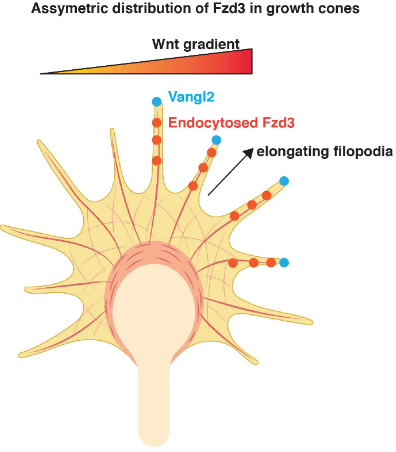
Les molécules implqiuées dans la polarité planaire (PCP) peuvent également intervenir :
* soit de manière cellulaire-autonome comme dans le cas des neurones commissuraux où Frizzled3 et Vangl2 (deux membres de la voie Wnt/PCP) sont nécessaires dans les axones pour qu’ils tournent antérieurement après avoir atteint la région médiane sagittale (Lyuksyutova et al., 2003; Schafer et al., 2011)
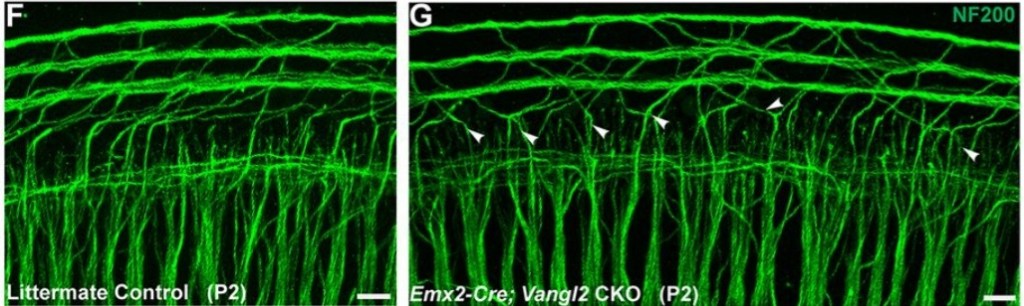
* soit de manière non cellulaire-autonome où c’est l’environnement des axones en croissance qui doit avoir une polarité planaire correcte (cas des axones des neurones du ganglion spiral de type II dans la cochlée) (Ghimire et al., 2018).
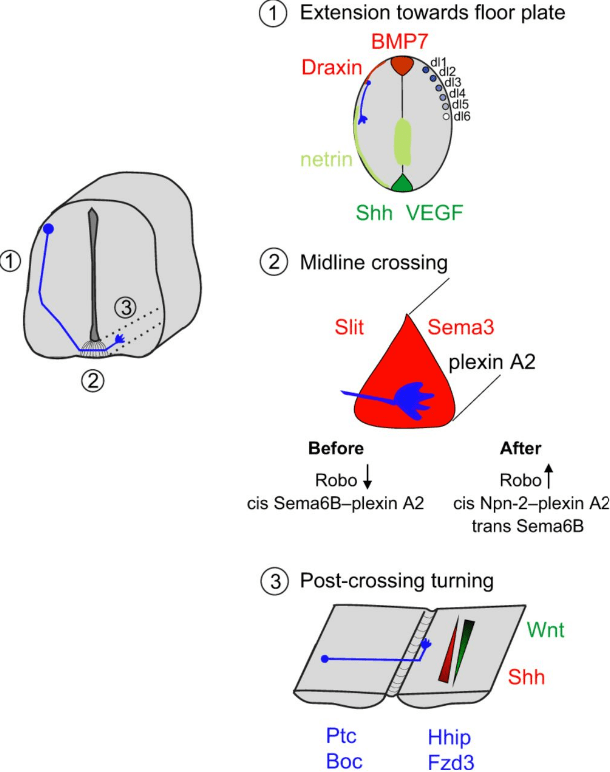
Un exemple classique : les neurones commissuraux lors du développement de la moelle épinière
Par définition, les neurones commissuraux ont leur axone qui passe du côté contralatéral. La classe la plus dorsale des neurones commissuraux de la moelle épinière, les neurones dI1, a été largement étudiée en ce qui concerne le guidage de leur axone vers la région la plus ventrale du tube neural : la plaque du plancher. Ces axones traversent ensuite la ligne médiane et tournent vers l’avant à la sortie de la plaque du plancher du côté controlatéral.
Pour cette population particulière d’axones, des molécules de guidage et des récepteurs contrôlant toutes les étapes de ce processus de navigation ont été identifiés et comprennent des attractifs et des répulsifs à longue portée, ainsi que des éléments de guidage à courte portée.
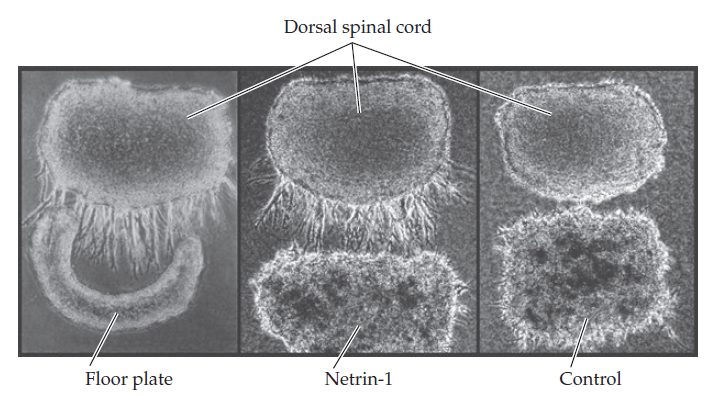
Des morceaux de moelle épinière dorsale d’embryons de rat (en haut de chaque image) sont cultivés avec un morceau de la plaque du plancher (la partie la plus ventrale de la moelle épinière (à gauche) ou un agrégat de cellules COS sécrétant de la nétrine-1 dont le vecteur d’expression a été introduit dans ces cellules (au milieu) ou un agrégat de cellules COS témoins avec le vecteur d’expression vide (à droite). Contrairementa u contrôle, la plaque de plancher et la nétrine-1 provoquent toutes deux la croissance abondante et dirigée de faisceaux d’axones commissuraux à partir du tissu de la moelle épinière dorsale. Source : https://www.cell.com/cell/abstract/0092-8674(94)90421-9
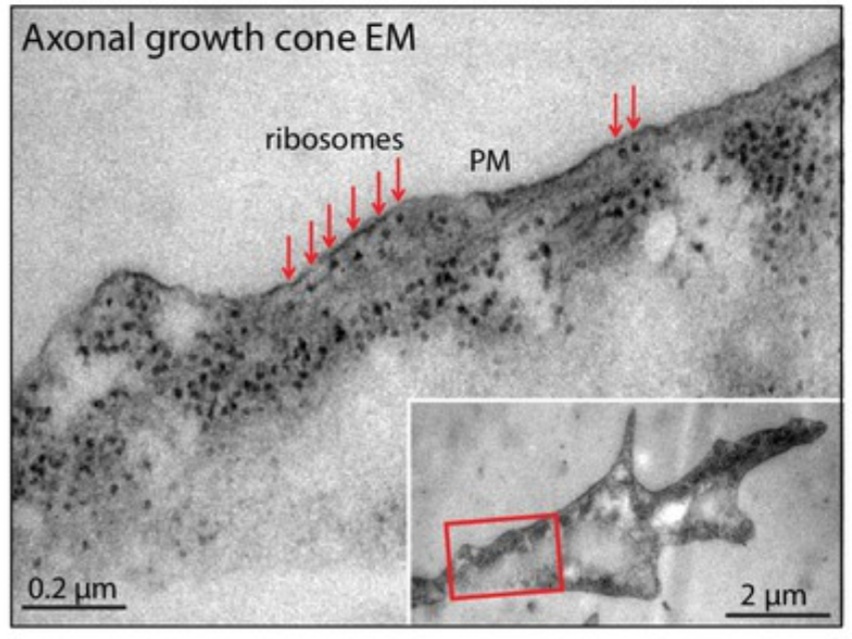
Traduction locale et stabilité protéique dans les cônes de croissance
La production locale de protéines par une traduction d’ARNm spécifiques transportés dans les cônes de croissance est un élément essentiel.
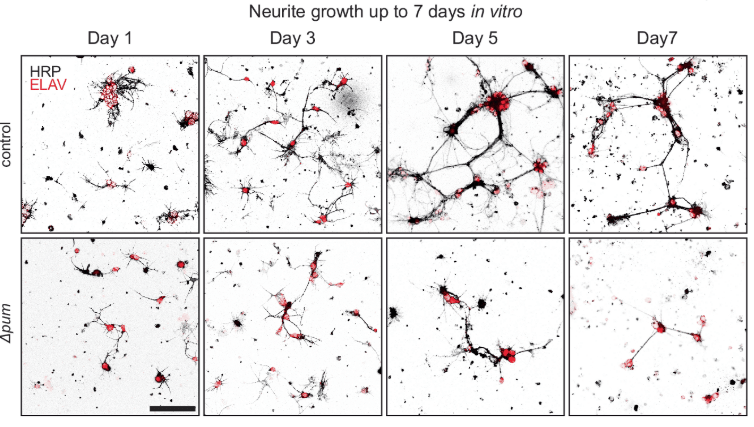
Le transport des ARNm est contrôlé par des protéines qui s’associent à la région 3’UTR des ARNm tel que les protéines de la famille Pumilio (Goldstrohm et al., 2018). Pumilio2, notamment, empêche le transport des ARNm qui possèdent une séquence qu’il reconnaît dans leur 3’UTR (appelée PBE = Pumilio-Binding Element) et permet ainsi que seuls les ARNm « pertinents » soient transportés vers le cône de croissance (Martinez et al., 2019).
D’autres protéines telle que ZBP1 facilitent le transport des ARNm vers le cône de croissance et plus tard vers la synapse (Turner-Bridger et al., 2020). ZBP1 interagit directement avec KIF11 (kinésine-5), une protéine motrice dirigée vers l’extrémité positive des microtubules (Song et al., 2015).
Du reticulum endoplasmique est aussi transporté vers les cônes de croissance et les ribosomes peuvent s’accrocher dessus pour la traduction de protéines transmembranaires ou sécrétées. Par exemple, dans les motoneurones en développement, la traduction locale dans les cônes de croissance est stimulée par des facteurs neurotrophiques comme le BDNF (qui agit via son récepteur TrkB) (Deng et al., 2021).
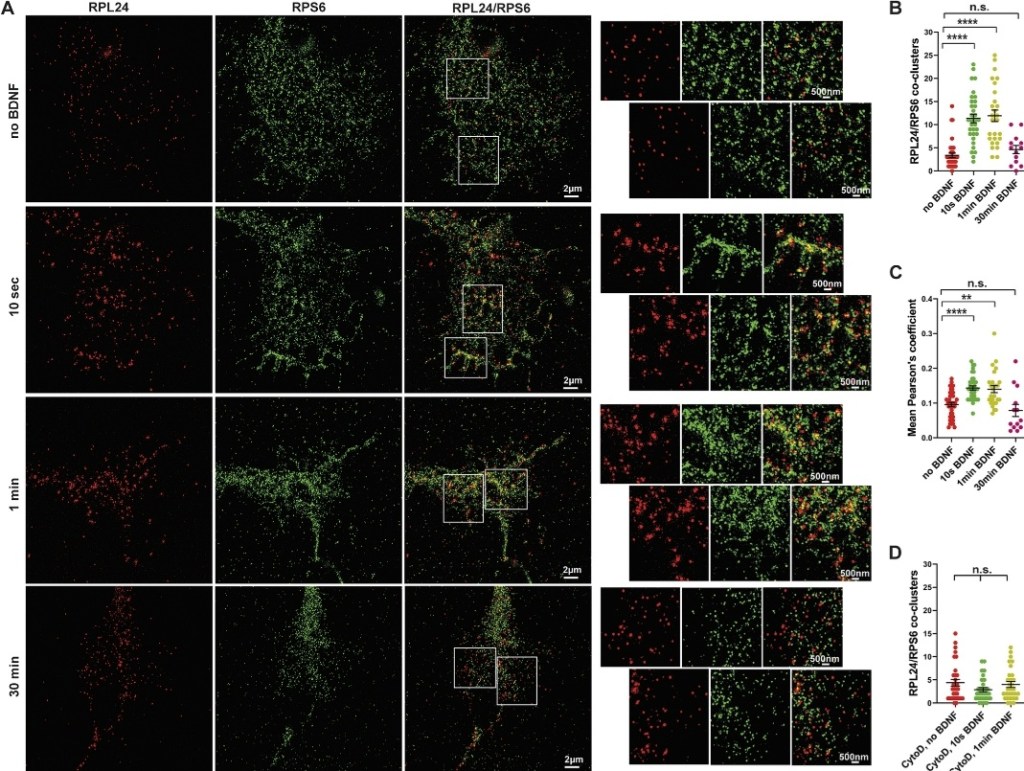
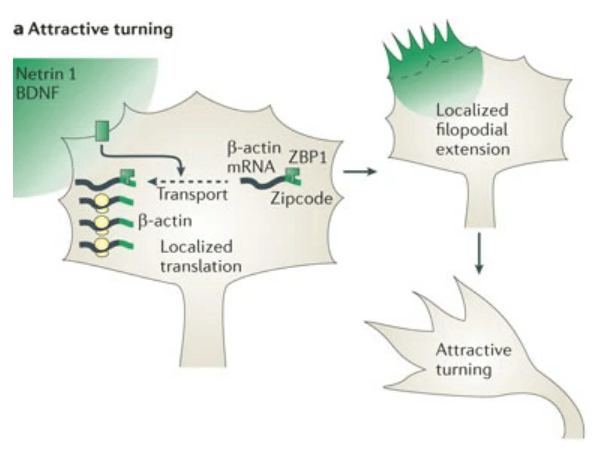
Des signaux attracteurs tels que la nétrine-1 (via le récepteur DCC), le BDNF (via le récepteur TrkB) et le NGF (via le récepteur TrkA) induisent la synthèse locale de composants cytosquelettiques tels que la β-actine (Leung et al. 2006, Willis et al. 2007, Yao et al. 2006).
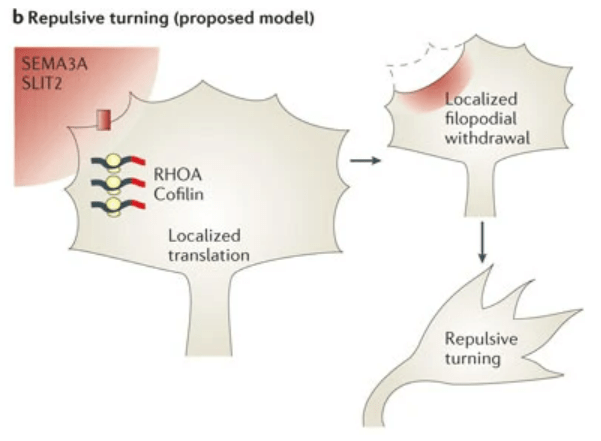
En revanche, des signaux répulsifs tels que Sema3A (via les récepteurs Nrp1/PlexinA), Slit2 (via le récepteur Robo2) ou de certaines éphrines induisent la traduction de régulateurs négatifs du cytosquelette tels que RhoA et la cofiline, entraînant un effondrement du cône de croissance (Piper et al. 2006).
La synthèse mais aussi la dégradation des protéines est un paramètre important pour la croissance et le guidage axonal. Le système ubiquitine-protéasome permet de diminuer rapidement la quantité d’une protéine donnée dans le cône de croissance, ce qui permet de répondre rapidement à des signaux. Par exemple, une activité normale du protéasome dans les axones en croissance de cellules ganglionnaires rétiniennes est nécessaire pour que la nétrine puisse repousser ces axones (Campbell et Holt, 2001). L’ubiquitine ligase Cdh1-APC qui est connue pour jouer un rôle lors de la mitose (et notamment le déclenchement de l’anaphase) joue un rôle important dans la croissance axonale (Konishi et al., 2004). Elle agit non seulement dans le cône de croissance mais aussi dans le noyau où elle cible SnoN, un co-répresseur transcriptionnel (Stegmüller et al., 2006). SnoN stimule la croissance axonale dans les cellules granulaires du cervelet et donc l’action de Cdh1-APC module et limite la croissance axonale de ces neurones.
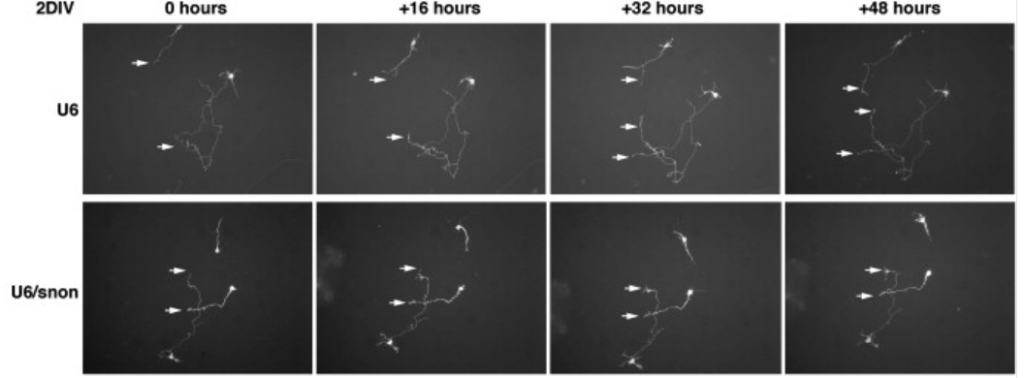
La mise en place des ramifications
La plupart des neurones développent plusieurs branches à partir de leurs axones uniques pour établir des connexions synaptiques à différentes destinations (Gibson et Ma, 2011 ; Kalil et Dent, 2014).
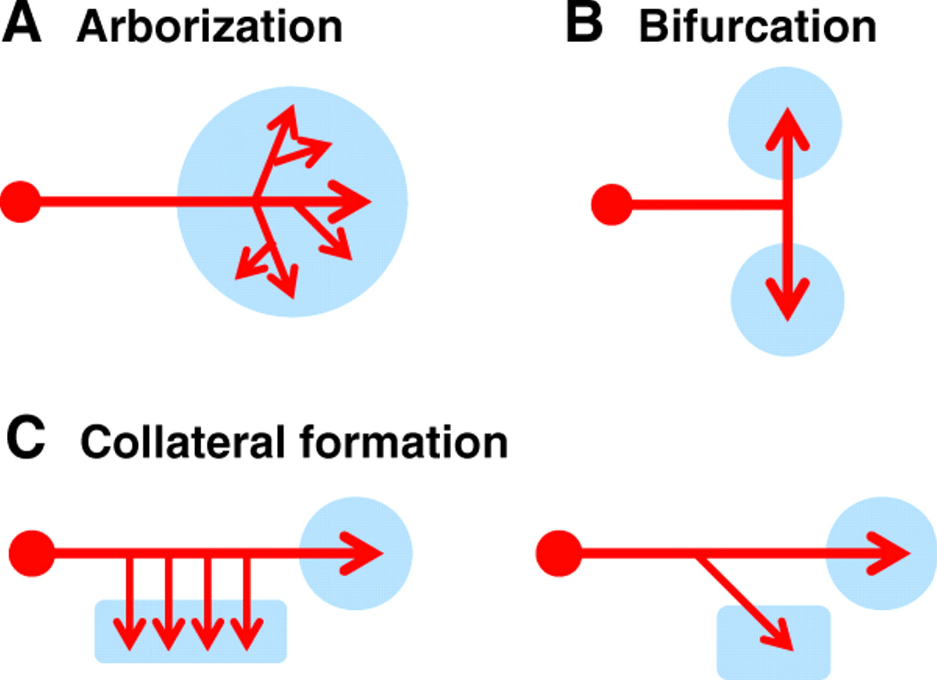
L’architecture ramifiée se forme en plusieurs étapes, notamment l’initiation, la maturation, la croissance, le guidage et l’élimination des branches, qui sont régulées par des signaux extracellulaires et des activités neuronales (Gibson et Ma, 2011). Les branches peuvent se remodeler par compétition (Lichtman et Colman, 2000 ; Schuldiner et Yaron, 2015) ou en réponse à des blessures (Kerschensteiner et al., 2004 ; Tuszynski et Steward, 2012). Étant donné que chaque branche a des besoins structurels et fonctionnels uniques, les branchements constituent des « points de décision » potentiels pour le transport axonal.
Des protéines régulant le cytosquelette et tout particulièrement les microtubules ont été impliqués dans le contrôle des ramifications, par exemple DCX (Doublecortine) (Sébastien et al., 2025).
La régénération axonale
La régénération des axones est essentielle pour restaurer les fonctions nerveuses mais elle est très limitée après une lésion dans le système nerveux central (SNC) chez les mammifères adultes par rapport au système nerveux périphérique (Muramatsu et Yamashita, 2014). Ce défaut est attribué à des molécules inhibitrices du SNC et à des facteurs neuronaux intrinsèques (Curcio et Bradke, 2018).
Dans le système nerveux périphérique, les cellules de Schwann qui sont dérivées des cellules de crêtes neurales (et absentes du SNC) jouent un rôle central dans la régénération. La partie distale de l’axone dégénère,
tout comme une courte partie de la partie proximale. Les cellules de Schwann qui avaient formé la gaine de myéline de l’axone se dédifférencient et prolifèrent. Avec les cellules microgliales et les macrophages recrutés à partir de la circulation sanguine, elles récupèrent et éliminent les débris. Cette réponse est appelée dégénérescence wallérienne, d’après l’anatomiste du
XIXème siècle, Augustus Waller, qui l’a décrite pour la première fois.
Ensuite, un nouveau cône de croissance émerge de la partie proximale de l’axone et croit en utilisant des signaux envoyés par les cellules de Schwann. Les mitochondries jouent notamment un rôle essentiel dans la régénération des axones en se déplaçant vers le cône de croissance et en soutenant ses fonctions (Cartoni et al., 2016; Han et al., 2016). La densité des mitochondries axonales augmente après une lésion, et les axones qui ne parviennent pas à augmenter la densité mitochondriale présentent une faible régénération. Ce processus est partiellement régulé par la kinase DLK-1 et par la protéine Armcx1 qui s’insère dans la membrane mitochondriale et interagit avec les protéines chargées du transport des motochondries.
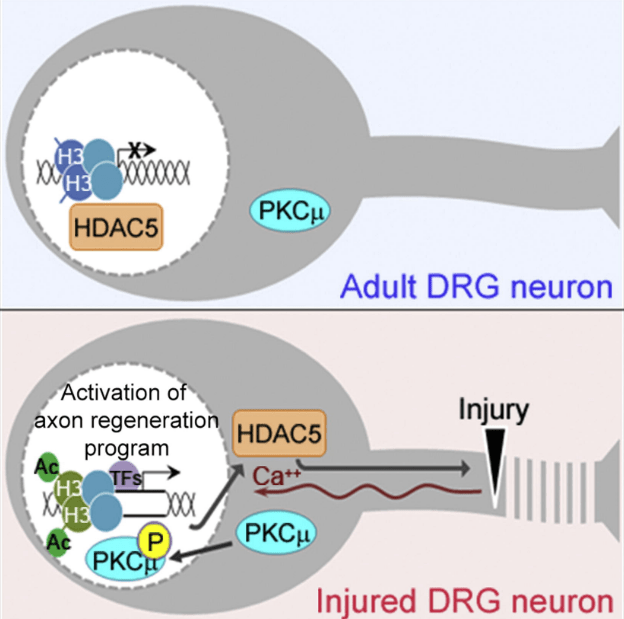
Des changements impliquent bien sûr le cytosquelette pour la régénération et notamment les modifications post-traductionnelles de la tubuline qui compose les microtubules. Une augmentation de tubulines tyrosinées et une diminution de tubulines acétylées se produisent à proximité du site de la lésion après la ligature du nerf sciatique adulte. L’axotomie favorise l’exportation nucléaire de HDAC5 (Cho et al. 2013) et son gradient axonal est corrélé au gradient de désacétylation de la tubuline induit par la lésion (Cho et Cavalli 2012). La désacétylation de la tubuline est un mécanisme nécessaire pour stimuler la formation d’un cône de croissance dynamique et l’inhibition de HDAC5 conduit à une régénération moins efficace.
Dans le SNC, des signaux inhibiteurs en provenance des oligodendrocytes empêchent la régénération.
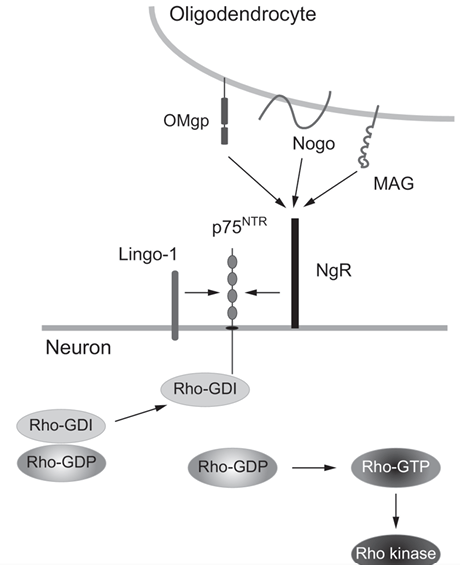
La compréhension de ces mécanismes pourrait conduire au développement de traitements régénératifs pour les lésions du SNC.
- Adhérences cellule-cellule
- Arabidopsis thaliana
- Axe antéro-postérieur chez la drosophile
- Biomécanique du développement
- Caenorhabditis elegans
- Concepts principaux
- Contrôle de la traduction
- Contrôle de la transcription
- Contrôle génétique et épigénétique
- Croissance du tube pollinique et double fécondation chez les Angiospermes
- Des modèles animaux moins classiques
- Développement de l’oeil des Vertébrés
- Développement et évolution
- Et l’Humain ?
- Exercices sur l’ovogenèse, la spermatogenèse et la fécondation
- Exercices sur le contrôle de l’expression des gènes
- Exercices sur le développement des bourgeons de membre
- Exercices sur le développement des muscles striés squelettiques
- Exercices sur le développement des végétaux et les hormones végétales
- Exercices sur les cycles et les divisions cellulaires
- Exercices sur les étapes du développement, les inductions embryonnaires et la mise en place des axes de polarité
- Exercices sur les matrices extracellulaires, le cytosquelette et les adhérences cellule-cellule
- Exercices sur les voies de signalisation
- Glossaire
- Glossaire des termes liés à la génétique
- Glossaire des termes liés au cytosquelette, la matrice extracellulaire, l’adhérence et la migration cellulaire
- Hématopoïèse et développement des cellules du système immunitaire
- Histoire de la biologie cellulaire et de la biologie du développement
- L’acide rétinoïque
- L’apoptose
- L’autophagie
- L’organogenèse
- L’ovogénèse prépare le développement embryonnaire
- La drosophile
- La fécondation
- La formation des somites
- La gastrulation
- La gastrulation (version allégée)
- La métamorphose chez les Hexapodes et les Amphibiens
- La neurogénèse chez les mammifères adultes
- La neurulation
- La poule
- La signalisation calcique
- La souris
- La superfamille TGFβ et ses voies de signalisation
- La voie de signalisation de l’auxine et ses rôles
- La voie de signalisation Hedgehog
- La voie de signalisation Hippo et ses composants YAP/TAZ
- La voie de signalisation Notch
- Le clivage
- Le cytosquelette
- Le destin des cellules et les réseaux de régulation génique
- Le développement des bourgeons de membre
- Le développement des muscles striés squelettiques
- Le développement des organes génitaux et des cellules germinales
- Le développement du cortex
- Le méristème apical caulinaire en phase végétative et lors de la formation d’une fleur
- Le poisson zèbre
- Le xénope
- Les cellules des crêtes neurales
- Les cellules et les gènes en action dans le développement
- Les cellules souches
- Les cellules tumorales
- Les cycles et les divisions cellulaires
- Les étapes du développement
- Les étapes du développement embryonnaire d’Arabidopsis thaliana et leur contrôle
- Les inductions embryonnaires et les gradients de morphogène
- Les matrices extracellulaires animales
- Les organismes modèles
- Les outils pour étudier l’expression et la fonction des gènes
- Les parois des cellules végétales
- Les techniques et les outils pour la biologie cellulaire
- Les transitions épithélio-mésenchymateuses et les migrations cellulaires
- Les vésicules extracellulaires
- Les voies de signalisation
- Les voies de signalisation FGF
- Mise en place des axes chez les Vertébrés
- Structures et processus cellulaires
- Voies de signalisation WNT
