Par Patrick Pla, Université Paris-Saclay
Vidéo introductive sur C. elegans (activez les sous-titres pour la version française) :
Caenorhabditis elegans est un Nématode, donc un Ecdysozoaire (comme la drosophile). Il possède une cuticule dont la mue est contrôlée par des Ecdystéroïdes. Contrairement à la drosophile, son corps n’est pas métamérisé et il a l’aspect d’un ver rond.
Avec un cycle de vie de quelques jours seulement (dont un développement embryonnaire qui ne dure que 16 heures), une capacité à survivre dans un congélateur indéfiniment en état de vie ralentie, un plan corporel simple, une petite taille (1 mm de long) et un cycle de vie inhabituel bien adapté aux études génétiques, il a tout d’un organisme modèle idéal.


Une version commentée de cette figure est disponible en vidéo.
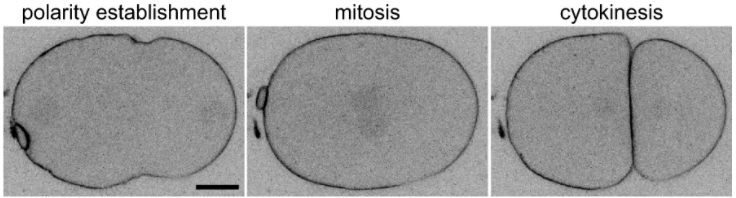
Source : https://www.mdpi.com/2073-4409/10/8/1966
C. elegans est hermaphrodite, produisant des spermatozoïdes au stade larvaire L4 puis ensuite des ovocytes. Il peut exister quelques mâles dans les populations (à une fréquence < 0,2%), qui sont XO (alors que les hermaphrodites sont XX; il n’y a pas de chromosome Y).

Chez C. elegans, la majorité des individus sont des hermaphrodites, capables de se reproduire seuls par autofécondation. Au cours du développement larvaire des hermaphrodites, des testicules se forment et produisent des spermatozoïdes, qui sont stockés. Des ovaires se développent également, mais l’ovogenèse n’a lieu que plusieurs jours plus tard, au stade adulte. Les ovules produits sont fécondés par les spermatozoïdes stockés au cours de l’autofécondation ce qui produit majoritairement des descendants hermaphrodites (>99 %) et très rarement des mâles (<1 %). En revanche, lors d’une fécondation croisée entre un mâle et un hermaphrodite, la descendance est composée à parts égales de mâles et d’hermaphrodites (50/50). Ce système reproducteur particulier offre aux chercheurs de multiples manières d’étudier les gènes et leur transmission.
La dominance de l’auto-fécondation comme mode de reproduction est très utile en génétique car les allèles intéressants obtenus par mutagenèse ne vont pas être dilués par des allèles sauvages.
L’autre principal atout de C. elegans est son nombre restreint et précis de cellules. L’adulte de C. elegans comporte exactement 959 cellules somatiques (et un nombre variable d’ovules et de spermatozoïdes). Parmi ces 959 cellules, il y a 302 neurones et 56 cellules gliales. C’est un degré inhabituel de précision quantitative pour le nombre de cellules d’un animal et permet une traçabilité des lignages et une reproductibilité des observations très importante. Cela est du à la succession de divisions stéréotypées, au positionnement des cellules, à l’orientation des divisions et des attributions des destinées cellulaires. Une description minutieusement détaillée de la séquence des événements menant aux différents lignages cellulaires et à toutes les cellules différenciées est disponible.


L’ensemble du lignage embryonnaire de C. elegans est disponible sur ce lien.
Son connectome, c’est-à-dire l’ensemble des connections des neurones de son système nerveux (7.600 synapses), a été étudié depuis 1986 et est entièrement connu depuis 2019 (White et al., 1986, Cook et al., 2019).
Des méthodes de traitement d’images se développent pour pouvoir encore mieux suivre une par une les cellules de C. elegans, notamment dans la période tardive du développement embryonnaire et lors du développement larvaire où les muscles de l’animal sont actifs et où l’animal se plie et se replie sur lui-même. Voir par exemple cette vidéo (Christensen et al., 2021) où on « déplie » virtuellement un embryon de C. elegans pour mieux apprécier l’organisation de ses neurones.
La découverte du premier effecteur animal de l’apoptose, Ced-3, a été réalisée chez Caenorhabditis elegans en 1986 (Ellis et Horvitz, 1986, lien vers une version commentée de cet article). Cet organisme modèle se prêtait bien à ce genre d’étude car on connaît très précisément le nombre de ses cellules à tout stade de développement et donc une apoptose diminuée chez un mutant ne pouvait pas passer inaperçue.

Source : https://els-jbs-prod-cdn.jbs.elsevierhealth.com/pb/assets/raw/journals/research/cell/libraries/annotated-classics/ACEllis.pdf
L’un des tout premier miRNA caractérisé, Let-7 (abréviation de lethal-7), a été découvert chez C. elegans (Reinhardt et al., 2000). Il inhibe l’expression de la protéine Ras et chez les Mammifères, il joue in rôle important pour éviter certains cancers.
Son génome de 130 millions de paires de bases (réparties sur 6 paires de chromosomes) a été le premier génome séquencé chez un animal (1998). Il code environ 21 000 protéines, et de nombreux mutants et autres outils sont disponibles pour l’analyse fonctionnelle des gènes. Bien que le ver ait un plan corporel très différent du nôtre, la conservation des mécanismes biologiques permet à ce que ce ver soit un modèle pour de nombreux processus de développement et de biologie cellulaire qui se produisent dans le corps humain (divisions asymétriques, apoptose…). 60 à 80% des gènes humains ont un orthologue chez C. elegans.
En laboratoire, on cultive C. elegans sur des plaques d’agar ensemencées avec Escherichia coli comme source de nourriture.
POUR ALLER PLUS LOIN
Pour voir ce qu’a apporté l’étude de Caenorhabditis elegans
sur les divisions asymétriques,
suivre ce lien
Site de référence sur Caenorhabditis elegans
QUELQUES LABORATOIRES FRANCOPHONES QUI TRAVAILLENT SUR CE MODELE :
Equipe « Autophagie et développement » – I2BC, Université Paris-Saclay
Equipe « Plasticité et reprogrammation directe chez C. elegans » – IGBMC, Strasbourg
- Adhérences cellule-cellule
- Arabidopsis thaliana
- Axe antéro-postérieur chez la drosophile
- Biomécanique du développement
- Concepts principaux
- Contrôle de la traduction
- Contrôle de la transcription
- Contrôle génétique et épigénétique
- Croissance du tube pollinique et double fécondation chez les Angiospermes
- Croissance et guidage axonal
- Des modèles animaux moins classiques
- Développement de l’oeil des Vertébrés
- Développement et évolution
- Et l’Humain ?
- Exercices sur l’ovogenèse, la spermatogenèse et la fécondation
- Exercices sur le contrôle de l’expression des gènes
- Exercices sur le développement des bourgeons de membre
- Exercices sur le développement des muscles striés squelettiques
- Exercices sur le développement des végétaux et les hormones végétales
- Exercices sur les cycles et les divisions cellulaires
- Exercices sur les étapes du développement, les inductions embryonnaires et la mise en place des axes de polarité
- Exercices sur les matrices extracellulaires, le cytosquelette et les adhérences cellule-cellule
- Exercices sur les voies de signalisation
- Glossaire
- Glossaire des termes liés à la génétique
- Glossaire des termes liés au cytosquelette, la matrice extracellulaire, l’adhérence et la migration cellulaire
- Hématopoïèse et développement des cellules du système immunitaire
- Histoire de la biologie cellulaire et de la biologie du développement
- L’acide rétinoïque
- L’apoptose
- L’autophagie
- L’organogenèse
- L’ovogénèse prépare le développement embryonnaire
- La drosophile
- La fécondation
- La formation des somites
- La gastrulation
- La gastrulation (version allégée)
- La métamorphose chez les Hexapodes et les Amphibiens
- La neurogénèse chez les mammifères adultes
- La neurulation
- La poule
- La signalisation calcique
- La souris
- La superfamille TGFβ et ses voies de signalisation
- La voie de signalisation de l’auxine et ses rôles
- La voie de signalisation Hedgehog
- La voie de signalisation Hippo et ses composants YAP/TAZ
- La voie de signalisation Notch
- Le clivage
- Le cytosquelette
- Le destin des cellules et les réseaux de régulation génique
- Le développement des bourgeons de membre
- Le développement des muscles striés squelettiques
- Le développement des organes génitaux et des cellules germinales
- Le développement du cortex
- Le méristème apical caulinaire en phase végétative et lors de la formation d’une fleur
- Le poisson zèbre
- Le xénope
- Les cellules des crêtes neurales
- Les cellules et les gènes en action dans le développement
- Les cellules souches
- Les cellules tumorales
- Les cycles et les divisions cellulaires
- Les étapes du développement
- Les étapes du développement embryonnaire d’Arabidopsis thaliana et leur contrôle
- Les inductions embryonnaires et les gradients de morphogène
- Les matrices extracellulaires animales
- Les organismes modèles
- Les outils pour étudier l’expression et la fonction des gènes
- Les parois des cellules végétales
- Les techniques et les outils pour la biologie cellulaire
- Les transitions épithélio-mésenchymateuses et les migrations cellulaires
- Les vésicules extracellulaires
- Les voies de signalisation
- Les voies de signalisation FGF
- Mise en place des axes chez les Vertébrés
- Structures et processus cellulaires
- Voies de signalisation WNT
