Par Patrick Pla, Université Paris-Saclay
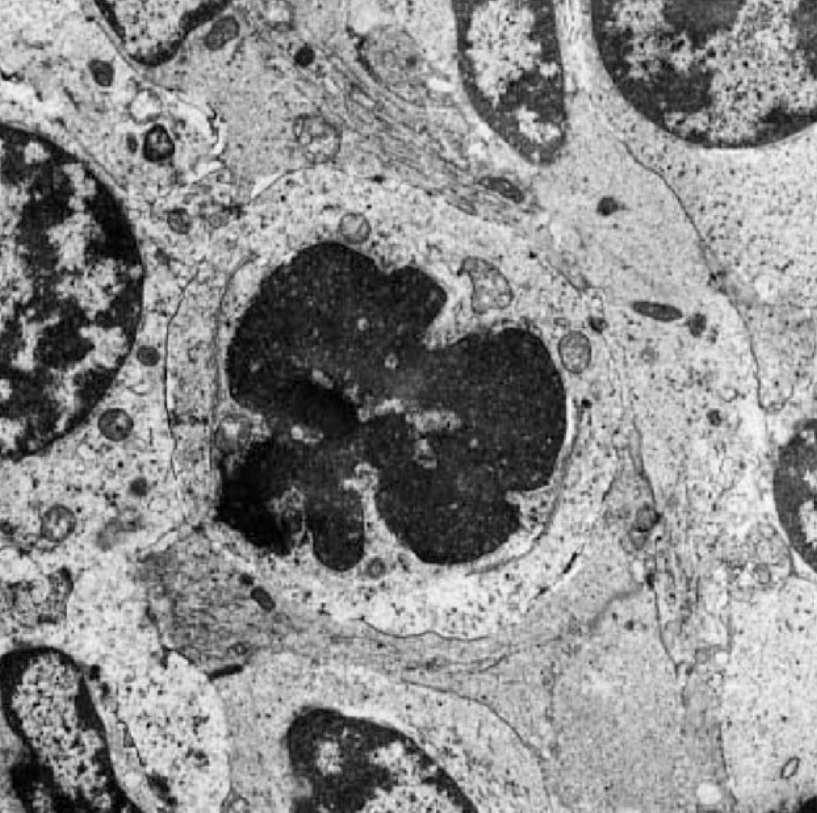
L’apoptose permet de faire disparaître des cellules sans que leur contenu soit déversé dans les tissus. Le noyau se condense, l’ADN se fragmente, les cellules diminuent de volume et expriment à leur surface des signaux qui vont stimuler leur phagocytose par d’autres cellules (par exemple de la phosphatidylsérine, un phospholipide qui est normalement présent très majoritairement sur le feuillet interne de la membrane plasmique et qui se retrouve en majorité sur le feuillet externe lors de l’apoptose). Des grosses cellules peuvent se fragmenter en structures plus petites appelées corps apoptotiques et sont alors entourées d’une membrane plasmique altérée. Ce sont alors ces corps apoptotiques qui sont phagocytés. Tout le processus ne déclenche pas d’inflammation.
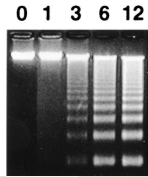
Comme les clivages se produisent dans les régions de liaison entre les nucléosomes, les fragments se séparent selon un motif en échelle caractéristique (les plus petits fragments correspondent à l’ADN dans un nucléosome, les plus grands à l’ADN dans plusieurs nucléosomes car toutes les régions entre les nucléosomes ne sont pas forcément clivées). Source : https://genesdev.cshlp.org/content/14/5/549.long
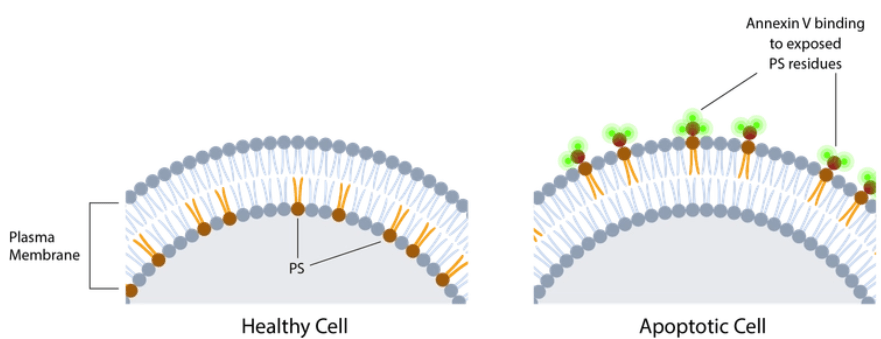
La technique de choix pour observer l’apoptose est le TUNEL (Terminal Transferase dUTP Nick End Labeling). Au cours de l’apoptose, l’ADN se fragmente. On fait agir sur des embryons ou des cellules en culture fixés une Terminal Transférase qui ajoute des nucléotides marqués (par exemple du BrdUTP) à l’extrémité des fragments d’ADN puis ces nucléotides sont reconnus par un anticorps couplé à un fluorophore. Les cellules apoptotiques ont beaucoup plus de marquage que les cellules normales à cause de la fragmentation de l’ADN et donc apparaissent fluorescentes. Une autre méthode repose sur le fait qu’une cellule apoptotique présente de la phosphatidylsérine sur la moitié externe de sa membrane plasmique (alors qu’une cellule normale n’en possède que sur sa moitié cytoplasmique). L’annexine A5 (ou annexine V) est une protéine qui reconnait la phosphatidylsérine et peut être couplée à un fluorophore ce qui permet de reconnaitre les cellules apoptotiques par fluorescence.
Chez les métazoaires, les mécanismes apoptotiques sont conservés au cours de l’évolution et permettent aux organismes multicellulaires de préserver l’homéostasie tissulaire (Ameisen, 2002). Des mutations qui inhibent des membres des voies de signalisation de l’apoptose sont très courantes dans les cellules tumorales (Hanahan et Weinberg, 2000).

L’apoptose a lieu de multiples fois au cours du développement, ce qui peut paraître paradoxal alors que l’organisme se construit. Mais le développement peut se dérouler selon un processus sélectif darwinien où plus de cellules que nécessaires sont produites et seules les cellules les plus fonctionnelles survivent : c’est typiquement le cas des neurones (Buss et al., 2006). L’apoptose peut permettre d’éliminer des structures devenues inutiles de part une détermination qui était jusqu’alors bipotentielle : cas de l’élimination des canaux de Wolff (chez les mammifères femelles) et des canaux de Müller (chez les mâles) et elle a un rôle dans la morphogenèse qui fonctionne alors comme de la sculpture (apoptose dans la zone interdigitale qui permet de séparer les doigts).
L’apoptose peut aussi jouer le rôle de « contrôle qualité » des populations cellulaires. Par exemple, chez le poisson-zèbre, les cellules qui ne répondent pas correctement à un gradient morphogène de Wnt (en activant trop ou pas assez sa voie de signalisation impliquant la β-caténine) meurent par apoptose.

Ced-3 a été le premier effecteur apoptotique découvert chez Caenorhabditis elegans en 1986 (Ellis et Horvitz, 1986, lien vers une version commentée de cet article). Cet organisme modèle se prête bien à ce genre d’étude car on connaît très précisément le nombre de ses cellules à tout stade de développement et donc une apoptose diminuée chez un mutant ne peut pas passer inaperçue.

Les premiers orthologues de ced-3 chez les mammifères, la caspase-9 chez l’homme (anciennement appelée enzyme de conversion de l’interleukine-1β) et Nedd-2 chez la souris, ont été décrits peu après (Yuan et al., 1993). Des homologues de ces protéines ont également été trouvés chez les insectes, à savoir Dcp-1 et Drice chez la drosophile. Ces protéines qui déclenchent l’apoptose ont été nommées caspases, qui signifie cysteine-aspartic proteases, reflétant leur spécificité pour les sites contenant des liaisons peptidiques avec l’acide aspartique, qu’elles clivent à l’aide de la cystéine présente dans leur site actif (QACXG). Jusqu’à présent, environ 15 membres de la famille des caspases ont été décrits chez l’homme et la souris (Shalini et al., 2015).
Il est à noter que chez les mammifères, certaines caspases sont également impliquées dans l’inflammation. Un rôle également non apoptotique pour la caspase effectrice clé, la caspase-3, a été identifié dans la formation des fibres du cristallin. Les cellules épithéliales qui forment le cristallin perdent leur noyau au cours de cette différenciation sans mourir et la caspase-3 contrôle ce processus (Ishizaki et al., 1998).
Les caspases 3 et 7 ont aussi été impliqués dans des processus non apoptotiques tels que l’autophagie (Samarasekera et al., 2025).
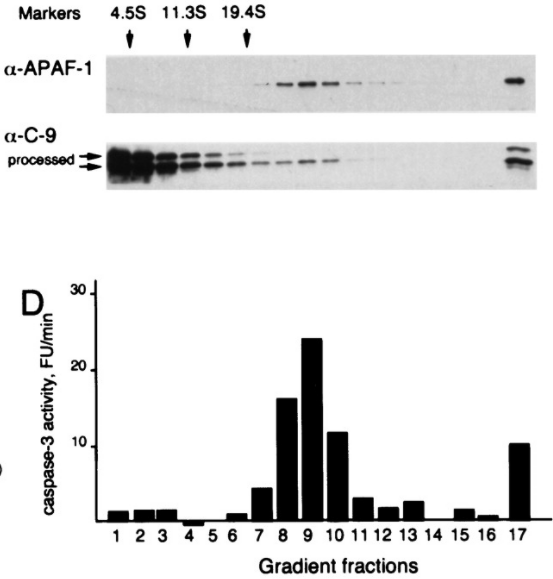
Les caspases apoptotiques sont classées en deux groupes : les caspases initiatrices (caspase-2, -8, -9 et -10) et les caspases exécutrices (caspase-3, -6 et -7). Ces protéases sont synthétisées sous forme de zymogènes inactifs. Elles doivent se dimériser pour devenir actives et cela nécessite le clivage d’un prodomaine N-terminal. Les caspases initiatrices peuvent s’auto-activer via autocatalyse, cependant, des interactions supplémentaires avec un complexe de protéines d’activation sont généralement nécessaires. Par exemple, le taux d’activation de la caspase-9 est supérieur de plusieurs ordres de grandeur par rapport à la forme libre lorsqu’elle est ancrée dans un complexe supramoléculaire appelé apoptosome contenant la protéine APAF-1 (Rodriguez et Lazebnik, 1999). La caspase-8 est plutôt activée par un autre complexe, le complexe de signalisation induisant la mort (DISC).
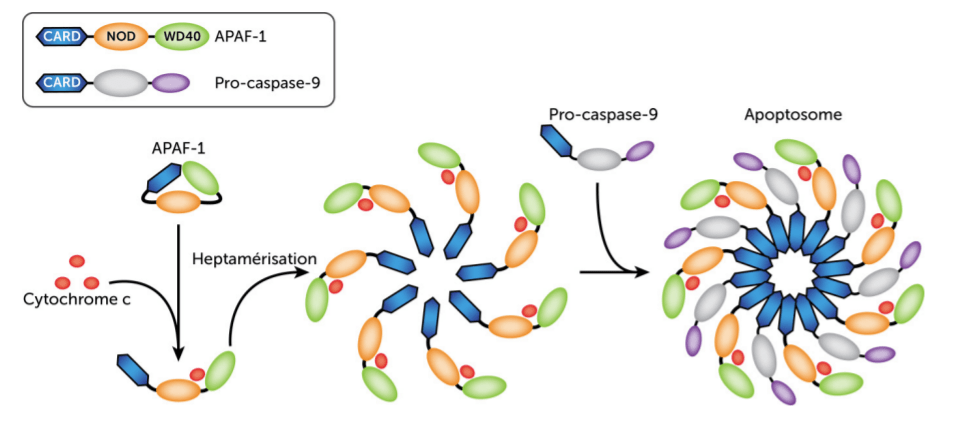
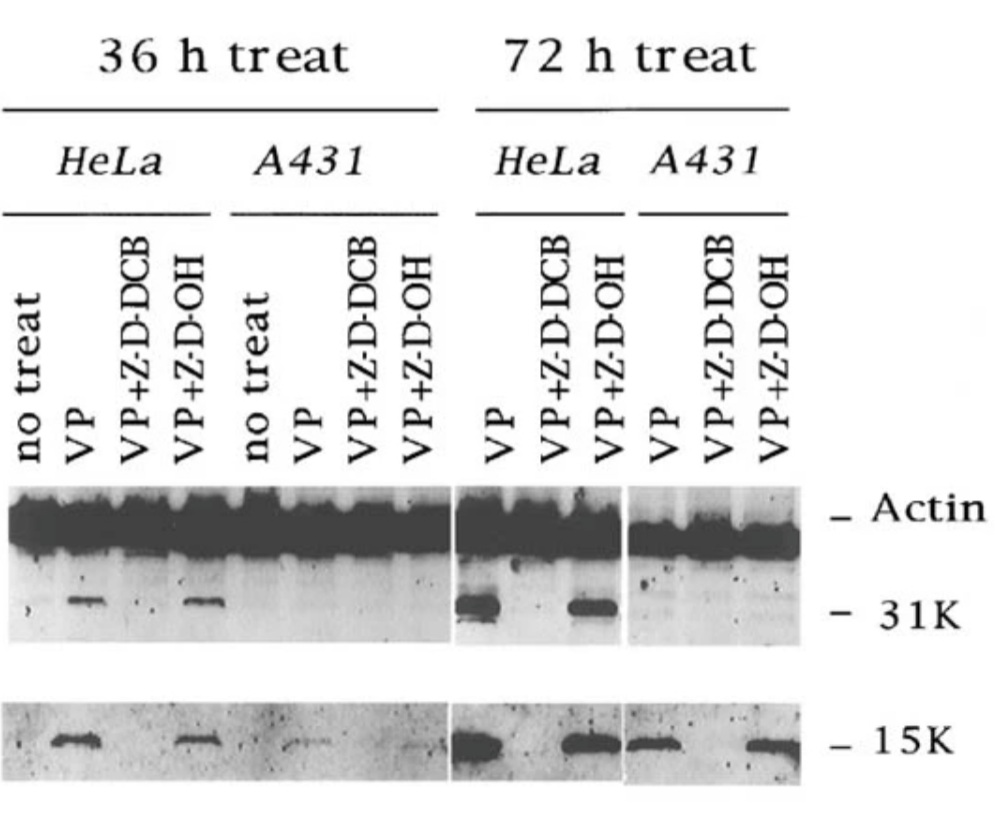
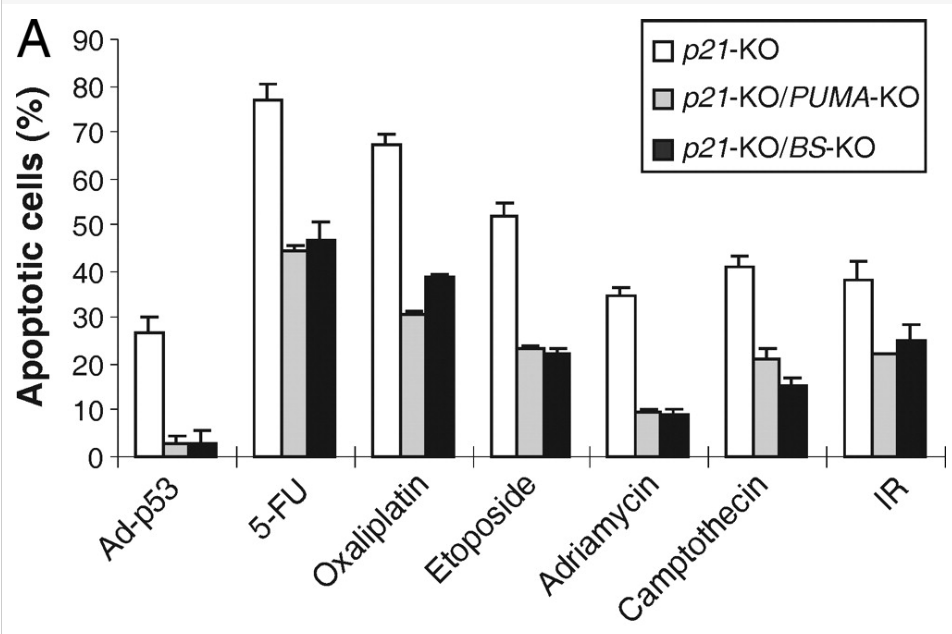
Eliminer l’expression de APAF-1 et donc abolir la formation de l’apoptosome peut sauver des cellules embryonnaires de l’apoptose comme dans l’exemple suivant :
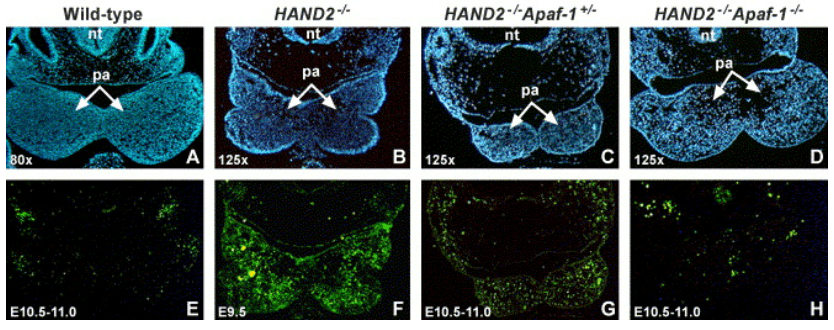
Source : https://www.sciencedirect.com/science/article/pii/S0012160604007791
Les caspases exécutrices sont activées par les caspases initiatrices, puis elles clivent un large ensemble de substrats, conduisant à l’apoptose (Kumar, 2007).
Une version commentée de cette figure est disponible en vidéo.
Source : http://genesdev.cshlp.org/content/13/24/3179.long
Plusieurs centaines de protéines sont clivées par les caspases lors de l’apoptose. Elles ciblent notamment des protéines structurales comme les constituants du cytosquelette : actine, kératines et lamines nucléaires (Caulin et al., 1997; Mashima et al., 1997). Cela participe à la condensation cytoplasmique et nucléaire observée lors de cette mort cellulaire.
Les caspases ciblent également des protéines impliquées dans le métabolisme et la réparation de l’ADN comme PARP (Poly ADP Ribose Polymerase) ou les DNA-PK (DNA-dependent Protein Kinase). Les caspases ciblent la protéine ICAD (Inhibitor of Caspase-Activated DNase), qui est normalement associée en complexe avec la DNase CAD. Cette dernière n’est alors plus inhibée et peut participer à la fragmentation de l’ADN caractéristique de l’apoptose (Enari et al., 1998).
Certaines protéines ciblées par les caspases sont impliquées dans des processus non apoptotiques, notamment la prolifération et la différenciation cellulaires (Kuranaga et Miura, 2007). Au cours de tels processus, l’étendue des cibles des caspases reste strictement contrôlée dans le temps et dans l’espace, évitant la mort cellulaire. Des cibles habituelles des caspases en cas d’apoptose sont protégées. Par exemple, dans l’érythropoïèse, le facteur de transcription GATA-1 est protégé de la protéolyse médiée par les caspases par la protéine chaperon Hsp70 (De Maria et al., 1999 ; Ribeil et al., 2007).
Signalons qu’il existe également des voies de signalisation de l’apoptose indépendantes des caspases qui peuvent être médiées par d’autres protéases. Citons les cathepsines, les calpaïnes, la serpine/endonucléase LEI/L-DNase II (Leukocyte Elastase Inhibitor/LEI-derived DNase II) ou le facteur AIF (Apoptosis Inducing Factor) qui peuvent médier la fragmentation de l’ADN en absence d’activation des caspases, ou encore des sérine-protéases mitochondriales comme Omi/HtrA2, localisée dans l’espace intermembranaire mitochondrial et pouvant être relarguée dans le cytosol (Cregan et al., 2004; Mathiasen et Jäättelä, 2002; Torriglia et al., 2008)
En amont de la cascade d’activation des caspases, on trouve deux voies appelées extrinsèques et intrinsèques. Dans la voie extrinsèque, la stimulation des récepteurs de mort tels que Fas/Apo1 ou TRAIL, conduit à l’activation de la caspase-8 initiatrice et au clivage en aval de la caspase-3 effectrice. Le ligand Fas est par exemple exprimé à la surface des lymphocytes T cytotoxiques et des cellules NK (Natural Killer) et peut provoquer la mort de cellules infectées par des virus, de certaines cellules tumorales et de cellules issues d’une greffe.
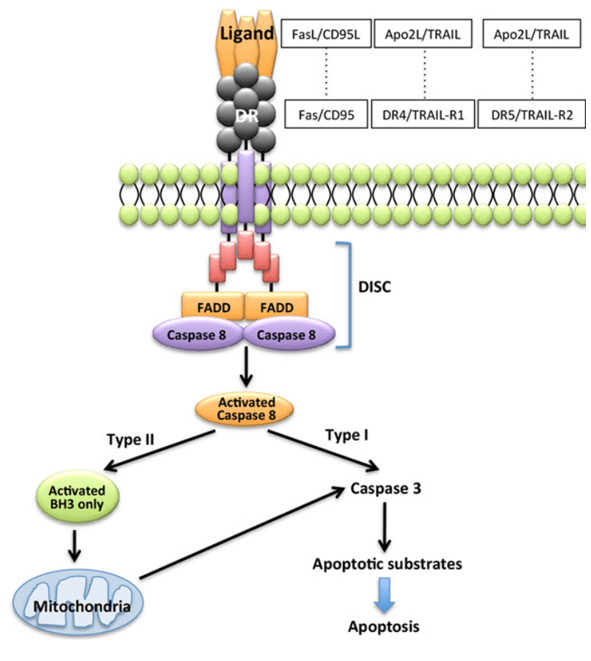
La voie intrinsèque implique les mitochondries, et notamment la libération du cytochrome c de l’espace intermembranaire mitochondrial dans le cytosol. Le cytochrome c libéré se lie à la protéine d’amarrage Apaf-1 et facilite la formation du complexe apoptosome qui recrute et active la caspase-9. Ce complexe apoptosome caspase-9/APAF-1/cytochrome c est la forme holoenzymatique de la caspase-9, qui active par clivage protéolytique l’exécuteur de l’apoptose caspase-3 comme nous l’avons vu.
Les mitochondries jouent un rôle central dans l’activation des caspases par la voie intrinsèque (Singh et al., 2019). Lors de divers stimuli induisant la mort, la membrane externe mitochondriale est altérée, permettant la libération du cytochrome c dans le cytosol et l’activation ultérieure de la cascade des caspases. Ce phénomène, appelé perméabilisation de la membrane externe mitochondriale, est strictement régulé par la famille de protéines Bcl-2 (Kale et al., 2018).
Les protéines de la famille Bcl-2 partagent un ou plusieurs domaines d’homologie Bcl-2 (BH) (Youle et Strasser, 2008). Sur la base d’analyses de structure et de fonction, les protéines Bcl-2 ont été classées en trois groupes : à domaine BH3 uniquement, multidomaine pro-apoptotique et multidomaine anti-apoptotique (Chipuk et al., 2010).
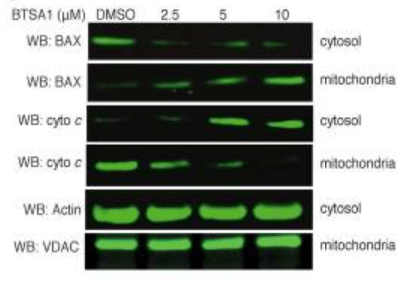
Une fois activées, les protéines multidomaines pro-apoptotiques, telles que Bax et Bak, forment des canaux sur la membrane externe des mitochondries, induisant la fuite d’agents activateurs de l’apoptose dans le cytosol, notamment le cytochrome c (Bleicken et al., 2013) ou encore Smac/Diablo, des protéines qui s’attachent aux protéines inhibitrices de l’apoptose, IAP (ou XIAP) et les inhibent (Rehm et al., 2003).
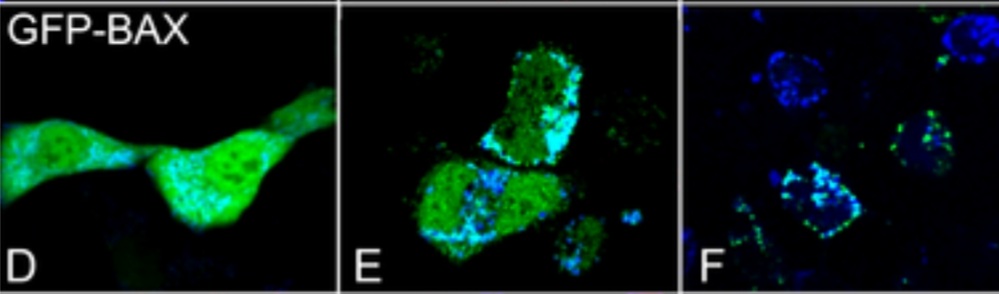
Une version commentée de cette figure est disponible en vidéo.
Source : https://journals.plos.org/plosone/article/figures?id=10.1371/journal.pone.0184434

Les protéines multidomaines anti-apoptotiques, notamment Bcl-2, Bcl-xL et Mcl-1, neutralisent Bax et Bak en formant des hétérodimères avec eux à travers un sillon hydrophobe formé par leurs domaines BH1, BH2 et BH3, protégeant ainsi la cellule de l’apoptose (Petros et al., 2004). Bcl-xL est capable de faire sortir Bax des mitochondries, l’empêchant de former les canaux sur la membrane externe de ces organites qui font sortir des agents pro-apoptotiques comme le cytochrome C vers le cytosol (Edlich et al., 2011).

Les protéines à domaine BH3 seul sont des protéines pro-apoptotiques qui jouent le rôle de « sentinelles » capables d’intégrer divers stress cellulaires et de déplacer l’équilibre en faveur des acteurs pro-apoptotiques en antagonisant les membres de la famille anti-apoptotique Bcl-2 ou en activant Bax et Bak (Youle et Strasser, 2008). Par exemple, l’expression du gène codant la protéine PUMA est activée par p53 à la suite de dommages à l’ADN qui ne sont pas réparés et PUMA inhibe l’activité des acteurs anti-apoptotiques et stimule l’activité des acteurs pro-apoptotiques (Wang et al., 2007).
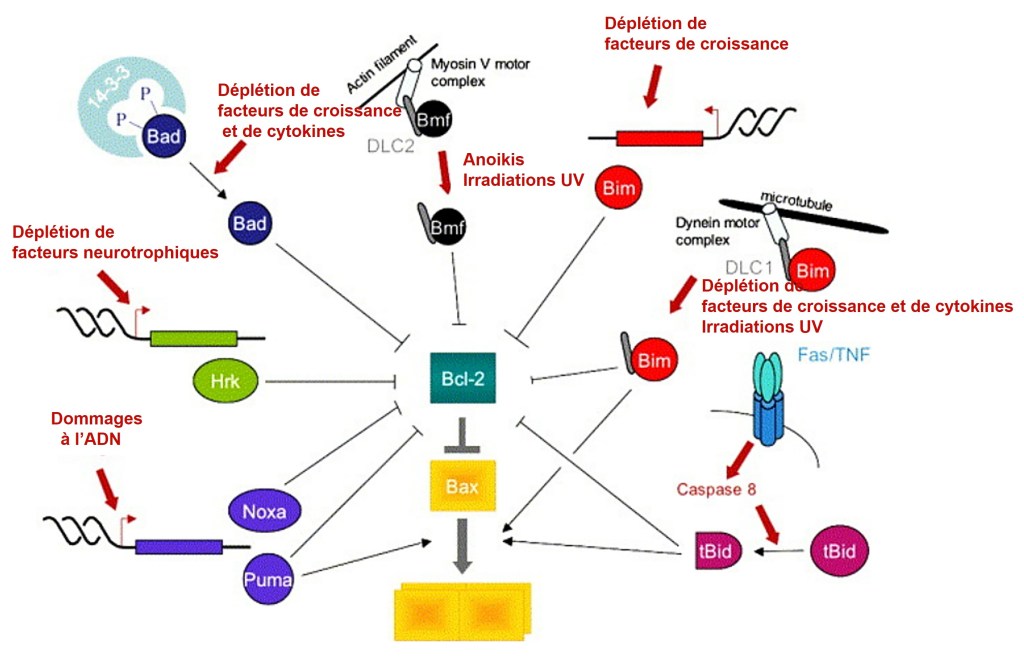
Les facteurs dits de survie sont des ligands qui activent des voies de signalisation qui s’opposent à l’apoptose. Elles peuvent agir en augmentant l’expression de Bcl-2 ou de Bcl-xL, en inactivant Bad (c’est ce que fait Akt par exemple) ou en inhibant des inhibiteurs de IAP (ces derniers sont anti-apoptotiques).
Les noms des protéines impliquées dans l’apoptose sur cette page sont ceux des Mammifères. L’apoptose a été abondamment étudiée chez le nématode C. elegans et chez la drosophile. Dans ces modèles, il existe des protéines orthologues à celles des Mammifères.
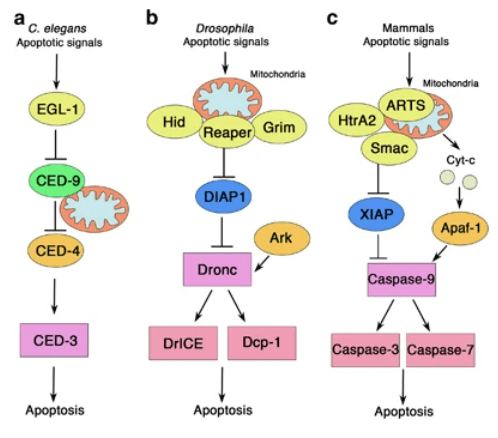
Certains virus empêchent l’activation des voies apoptotiques ce qui prolonge la vie des cellules qu’ils ont infectées et favorise leur propagation. Par exemple, le virus de la famille de l’herpès HHV8, responsable de la maladie de Kaposi, exprime une protéine vFLIP qui inhibe la caspase-8 (Ruder et al., 2020).
Un déclenchement déficient de l’apoptose est une des caractéristiques des cellules tumorales. Cela assure leur survie et leur croissance, et également leurs résistances aux traitements (Hata et al., 2015). Elles expriment souvent plus fortement des membres anti-apoptotique de la famille Bcl-2. Par exemple, dans le lymphome folliculaire, qui est le second lymphome le plus fréquent chez l’adulte (4000 nouveaux cas chaque année en France), est le plus souvent causé par une translocation qui déplace le gène codant Bcl-2 (qui veut dire d’ailleurs B-cell lymphoma 2) situé sur le chromosome 18 vers une région du chromosome 14 qui contient les séquences régulatrices d’un gène codant une chaîne lourde d’immunoglobulines exprimée dans les lymphocytes B. Ainsi, Bcl-2 est surexprimé et bloque toute possibilité d’apoptose, même en cas d’accumulation d’autres mutations qui causent des cancers. Des mutations gain-de-fonction dans la séquence codante de Bcl-2 peuvent aussi être décelées dans certains lymphomes folliculaires (Correia et al., 2015).
Des nouvelles molécules thérapeutiques sont étudiées pour inhiber leur activité (tel le venetoclax (Konopleva et al., 2016)) ou également pour stimuler directement des protéines pro-apoptotiques telles que Bax (Reyna et al., 2017).
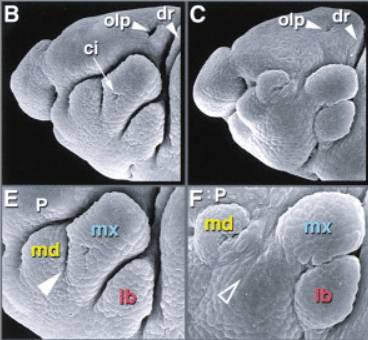
Dans certains cas, l’apoptose peut provoquer une prolifération réactive des cellules environnantes. Les premières observations dans ce sens ont été réalisées en 1977, chez la drosophile, où il a été démontré que, malgré l’élimination jusqu’à 60 % des cellules, les disques imaginaux de l’aile peuvent produire une aile de taille normale en raison de l’augmentation ultérieure de la mitose parmi les cellules survivantes. La prolifération cellulaire accrue et le repeuplement rapide des tumeurs après un traitement cytotoxique (soit par rayonnement ionisant, soit par chimiothérapie) sont des facteurs connus depuis longtemps dans la mauvaise réponse au traitement des cancers chez les patients. Parmis les mécanismes mis en évidence, citons l’activation de la production de prostaglandines E2 par la caspase-3 (Donato et al., 2014).
Il existe d’autres morts cellulaires régulées que l’apoptose : la ferroptose est une mort cellulaire par accumulation de peroxides de phospholipides. Cette accumulation peut être provoquée par des ions Fe2+ d’où son nom. Elle peut aussi être provoquée par un défaut de glutathion qui ne peut plus jouer son rôle d’antioxydant ou par l’inhibition de l’expression de la glutathione peroxidase-4 (GPX4) qui est l’enzyme qui catalyse la réaction protectrice (Yang et al., 2014). Au cours de la ferroptose, il n’y a pas de fragmentation de l’ADN contrairement à l’apoptose (Han et al., 2020). La nécroptose est une autre forme de mort cellulaire souvent activée par l’inflammation et caractérisée par une destruction de l’intégrité de la membrane plasmique ce qui la rapproche de la nécrose. La nécroptose est médiée par un complexe appelé nécrosome et qui dépend notamment de la phosphorylation de RIPK3, l’un des composants du nécrosome, et de la phosphorylation de MLKL (Zhang et al., 2009). La nécroptose peut s’observer par exemple dans le cas de cellules infectées par des virus qui inhibent les caspases activatrices de l’apoptose (Berghe et al., 2014). Le relargage de composants intracellulaires dans le milieu extérieur à la cellule peut alors amplifier l’inflammation. Citons également la pyroptose qui correspond à la formation de pores dans la membrane plasmique par les protéines de la famille des gasdermines.
L’élimination des cellules apoptotiques
Les cellules qui subissent une mort cellulaire programmée sont généralement englouties par des cellules phagocytaires ce qui évite les réponses inflammatoires ou maintient l’homéostasie tissulaire. L’échec de ce processus entraînerait une accumulation redondante de cellules apoptotiques dans l’organe, conduisant finalement au développement de maladies inflammatoires auto-immunes ou neurodégénératives (Doran et al., 2020).
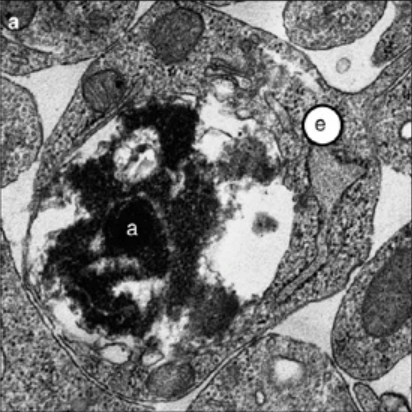
Avant d’être reconnus par les phagocytes, les cellules apoptotiques libèrent ou exposent certaines molécules qui favorisent leur reconnaissance et leur élimination. Par exemple, les phosphatidylsérines des phospholipides de la membrane plasmique sont normalement cantonnées au feuillet interne de la membrane plasmique mais les cellules en apoptose l’exposent sur le feuillet externe. Cela sert de signal pour la phagocytose (Naeini et al., 2020).
Les macrophages de mammifères sont divisés en deux sous-groupes en fonction de leurs cytokines inflammatoires (Röszer, 2015), M1 et M2. Ce sont les macrophages M2 qui sont impliqués dans la phagocytose des cellules apoptotiques. Les cellules épithéliales et les fibroblastes peuvent également absorber une quantité limitée de particules apoptotiques et jouer un certain rôle (Cao et al., 2004; Monks et al., 2005; Juncadella et al., 2013).
- Adhérences cellule-cellule
- Arabidopsis thaliana
- Axe antéro-postérieur chez la drosophile
- Biomécanique du développement
- Caenorhabditis elegans
- Concepts principaux
- Contrôle de la traduction
- Contrôle de la transcription
- Contrôle génétique et épigénétique
- Croissance du tube pollinique et double fécondation chez les Angiospermes
- Croissance et guidage axonal
- Des modèles animaux moins classiques
- Développement de l’oeil des Vertébrés
- Développement et évolution
- Et l’Humain ?
- Exercices sur l’ovogenèse, la spermatogenèse et la fécondation
- Exercices sur le contrôle de l’expression des gènes
- Exercices sur le développement des bourgeons de membre
- Exercices sur le développement des muscles striés squelettiques
- Exercices sur le développement des végétaux et les hormones végétales
- Exercices sur les cycles et les divisions cellulaires
- Exercices sur les étapes du développement, les inductions embryonnaires et la mise en place des axes de polarité
- Exercices sur les matrices extracellulaires, le cytosquelette et les adhérences cellule-cellule
- Exercices sur les voies de signalisation
- Glossaire
- Glossaire des termes liés à la génétique
- Glossaire des termes liés au cytosquelette, la matrice extracellulaire, l’adhérence et la migration cellulaire
- Hématopoïèse et développement des cellules du système immunitaire
- Histoire de la biologie cellulaire et de la biologie du développement
- L’acide rétinoïque
- L’autophagie
- L’organogenèse
- L’ovogénèse prépare le développement embryonnaire
- La drosophile
- La fécondation
- La formation des somites
- La gastrulation
- La gastrulation (version allégée)
- La métamorphose chez les Hexapodes et les Amphibiens
- La neurogénèse chez les mammifères adultes
- La neurulation
- La poule
- La signalisation calcique
- La souris
- La superfamille TGFβ et ses voies de signalisation
- La voie de signalisation de l’auxine et ses rôles
- La voie de signalisation Hedgehog
- La voie de signalisation Hippo et ses composants YAP/TAZ
- La voie de signalisation Notch
- Le clivage
- Le cytosquelette
- Le destin des cellules et les réseaux de régulation génique
- Le développement des bourgeons de membre
- Le développement des muscles striés squelettiques
- Le développement des organes génitaux et des cellules germinales
- Le développement du cortex
- Le méristème apical caulinaire en phase végétative et lors de la formation d’une fleur
- Le poisson zèbre
- Le xénope
- Les cellules des crêtes neurales
- Les cellules et les gènes en action dans le développement
- Les cellules souches
- Les cellules tumorales
- Les cycles et les divisions cellulaires
- Les étapes du développement
- Les étapes du développement embryonnaire d’Arabidopsis thaliana et leur contrôle
- Les inductions embryonnaires et les gradients de morphogène
- Les matrices extracellulaires animales
- Les organismes modèles
- Les outils pour étudier l’expression et la fonction des gènes
- Les parois des cellules végétales
- Les techniques et les outils pour la biologie cellulaire
- Les transitions épithélio-mésenchymateuses et les migrations cellulaires
- Les vésicules extracellulaires
- Les voies de signalisation
- Les voies de signalisation FGF
- Mise en place des axes chez les Vertébrés
- Structures et processus cellulaires
- Voies de signalisation WNT
