Patrick Pla, Université Paris-Saclay
Les forces mécaniques jouent un rôle clé dans la morphogenèse de l’embryon. Les changements de forme importants qui se produisent pendant l’organogenèse sont en grande partie générés par les cellules de l’embryon lui-même, donc le comportement mécanique de ces cellules doit être étroitement régulé pour produire l’architecture tissulaire appropriée. De plus, de nombreuses expériences, dans lesquelles des tissus embryonnaires sont coupés ou des portions sont retirées, montrent que les cellules réagissent de manière adaptative à une perte de tension pour ramener le tissu à un certain équilibre mécanique.
Plus récemment, il a également été démontré que les paramètres mécaniques de l’environnement peuvent affecter la différenciation cellulaire et le fonctionnement des cellules différenciées (Engler et al., 2006).
Les effets mécaniques se répercutent à différentes échelles : des organes jusqu’aux tissus, puis aux cellules puis aux éléments du cytosquelette. En retour, la réaction du cytosquelette peut avoir des effets qui « remontent » jusqu’à l’échelle des tissus et des organes.

Même en dehors du développement, les cellules épithéliales sont capables d’ajuster de manière autonome leurs propriétés mécaniques et biochimiques en réponse à des stimuli mécaniques pour éviter une accumulation excessive de contraintes susceptibles de perturber l’intégrité structurelle de l’épithélium. Ce maintien de l’homéostasie du tissu épithélial nécessaire à l’exécution des fonctions physiologiques, est appelé mécanoadaptation.
- Quelques précisions sur la microscopie à force atomique
- Les rôles du cytosquelette
- Les rôles de la matrice extracellulaire
- Importance de la voie Hippo (YAP/TAZ)
- Implication d’autres voies de signalisation
- La formation de cavités liquidiennes et leurs rôles lors du développement
- Les particularités biomécaniques des cellules végétales
Quelques précisions sur la microscopie à force atomique
La microscopie à force atomique (AFM) est souvent utilisée dans les études de biomécanique. Contrairement aux microscopes optiques traditionnels qui utilisent la lumière, l’AFM fonctionne en « sondant » la surface d’un échantillon. Une pointe extrêmement fine (de l’ordre du nanomètre), fixée à un levier souple, balaie la surface à l’échelle de l’atome. Les forces qui s’exercent entre la pointe et les atomes de l’échantillon déforment le levier. En mesurant ces déformations (par les modifications de la réflexion d’un laser le plus souvent), on peut reconstituer une image en trois dimensions de la surface d’un échantillon avec une résolution atomique et mesurer la répartition de forces de l’ordre du nanonewton qui s’exercent entre la pointe et l’échantillon.
Le modèle de Hertz décrit la mécanique du contact entre un indenteur (comme la pointe d’un AFM) et un matériau déformable (comme une cellule). Lorsqu’une pointe sphérique est utilisée, la relation entre la force appliquée (F) et la profondeur d’indentation delta (δ) est donnée par :

où :
- E* est le module de Young réduit (dépend des propriétés du matériau de la pointe et de l’échantillon),
- R est le rayon de la pointe AFM (forme sphérique),
- δ est la profondeur d’indentation (déformation de la cellule par la pointe).
En ajustant les courbes force-indentation obtenues en AFM avec le modèle de Hertz, les chercheurs peuvent estimer le module de Young (E), qui quantifie la rigidité des cellules.
Le module de Young (E) est une mesure de la rigidité ou de l’élasticité d’un matériau. Il est défini par :

où :
- La contrainte correspond à la force appliquée par unité de surface,
- La déformation est le changement relatif de la structure sous l’effet de la contrainte.
Un module de Young élevé signifie que le matériau est rigide, tandis qu’un module faible indique qu’il est souple et facilement déformable.
Les rôles du cytosquelette
Le cytosquelette est un réseau dynamique de filaments protéiques (filaments d’actine, microtubules et filaments intermédiaires) qui assure le soutien structurel, contrôle la forme des cellules et assure la génération et la transmission de force au sein des cellules. Au cours du développement embryonnaire, le cytosquelette joue un rôle biomécanique crucial dans la morphogenèse, la formation des tissus et la régulation du devenir cellulaire.
POUR UNE PRESENTATION GENERALE DU CYTOSQUELETTE, VOIR CETTE PAGE
La morphogenèse tissulaire est déterminée par des déformations cellulaires locales essentiellement dépendantes des réseaux contractiles d’actomyosine. Par exemple, la dépression dans la plaque neurale qui initie la formation de la gouttière neurale lors de la neurulation dépend de la constriction apicale des cellules de la ligne médiane qui ont un rôle moteur essentiel (Haigo et al., 2003 ; Nishimura et Takeichi , 2008 ; Nishimura et al., 2012 ; McShane et al., 2015). Cette constriction apicale dépend des interactions entre l’actine et la myosine. Des régulateurs de l’actine et de la myosine sont ainsi nécessaires pour la fermeture de la plaque neurale (Brouns et al. , 2000 ; McGreevy et al., 2015).
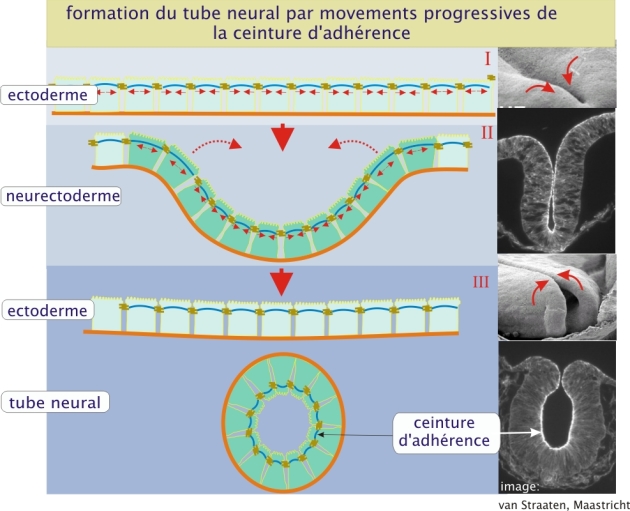
1) Au stade initial, les cellules du neuroectoderme sont disposées en épithélium avec des ceintures d’adhérence (en marron) riches en complexes d’actine-myosine (bleu) à leur pôle apical. 2) Sous l’effet d’une contraction apicale médiée par l’actomyosine, les cellules présentent une déformation qui génère une courbure du tissu. Ce mécanisme de constriction apicale induit une invagination du neuroectoderme. Les flèches rouges indiquent les forces de traction exercées par la contraction actomyosinique, dirigées vers le centre.
3) La fusion des plis neuraux au niveau de la ligne médiane permet la fermeture du tube neural. Les ceintures d’adhérence se repositionnent pour former une nouvelle jonction apicale autour de la lumière du tube neural. Ce remodelage tissulaire repose sur la coordination spatio-temporelle de forces mécaniques intrinsèques, pilotées par la dynamique du cytosquelette et des jonctions cellulaires. À droite, des images en microscopie montrent les étapes correspondantes in vivo, avec des flèches rouges illustrant les mouvements cellulaires et les sites de courbure. Source : https://ressources.unisciel.fr/biocell/chap4/co/module_Chap4_9.html
Certaines déformations similaires ont lieu lors de la gastrulation chez la souris.

Les microfilaments d’actine sont impliqués dans de nombreux changements de forme. Par exemple, lors de sa morphogenèse, le cœur passe d’un tube droit à un tube en forme de C, ce qui constitue la première preuve d’asymétrie gauche-droite chez l’embryon. La formation d’une boucle en C consiste en deux composantes de déformation principales : la flexion ventrale et la rotation dextre. Une polymérisation continue de l’actine est nécessaire à la composante de flexion de la boucle C cardiaque et les changements de forme des cellules myocardiques induits par la polymérisation provoquent cette déformation.

Certains mouvements de la gastrulation chez l’oiseau sont contrôlés par la contraction graduelle d’un anneau d’actomyosine supracellulaire à grande échelle localisé entre les territoires embryonnaire et extraembryonnaire. La propagation de ces forces est rendue possible par une réponse du disque embryonnaire épithélial qui est similaire à celle d’un fluide. Un modèle mathématique simple de mouvement fluidique provoqué par un anneau de tension est capable de modéliser les mouvements « en vortex » qui accompagnent la formation de la ligne primitive. La géométrie de l’embryon en gastrulation résulte ainsi de la transmission de forces actives générées le long de sa frontière (Saadaoui et al., 2020).

Un autre exemple est apporté par le développement de l’oeil de la drosophile et la mise en place de sa courbure durant la métamorphose. Ce processus biomécanique assure une mise en place adéquate de la morphologie rétinienne via la transmission de tension et la maturation de la rigidité cellulaire, dépendante de réseaux d’adhérence et de contractilité intracellulaire par les interactions actine-myosine (Decker et al., 2025).

On peut mesurer directement la force générée par un cycle d’interaction entre l’actine et la myosine. À l’aide de pinces optiques, on place un microfilament d’actine unique près d’une molécule de myosine immobilisée sur une bille. Grâce à une microscopie vidéo performante, on peut détecter des déplacements aussi petits qu’un nanomètre. En présence d’ATP et sous faible force opposée, le filament d’actine s’est déplacé par à-coups de 11 nm, ce qui correspond au déplacement unitaire produit par un cycle d’interaction actine-myosine. Lorsque la force appliquée par les pinces est plus grande et l’immobilisation de l’actine totale, on peut observer des impulsions de force d’environ 5 piconewtons (pN), indiquant la force développée par un cycle d’interaction actine-myosine. De plus, ces impulsions durent plus longtemps à faible concentration d’ATP, ce qui soutient l’idée que la liaison de l’ATP à la myosine est nécessaire pour permettre son détachement. Ces résultats fournissent une quantification directe des mouvements et forces produits à l’échelle moléculaire durant l’interaction de la myosine avec l’actine.

Les microfilaments d’actine (avec la myosine) peuvent générer des déformations et des forces comme nous venons de le voir, mais elles peuvent aussi répondre à des forces et des contraintes. En effet, l’assemblage et l’architecture des réseaux d’actine ramifiés sont sensibles à la force exercées sur les cellules. Sous une charge, les réseaux d’actine ramifiés assemblés in vitro à partir de protéines purifiées croissent plus lentement Cela vient en partie du fait que les ramifications mises en place par le complexe Arp2/3 se détachent plus facilement (Pandit et al., 2020).

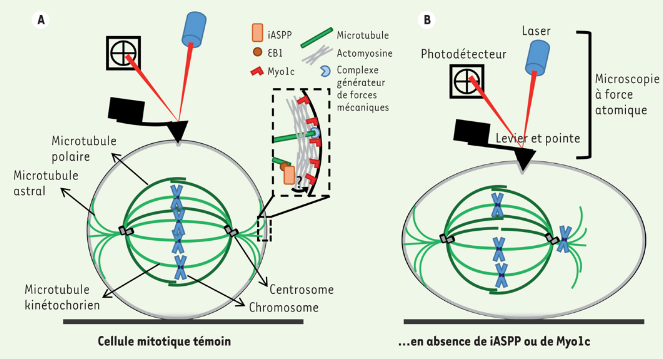
Les microtubules participent également à la biomécanique du développement, par exemple lorsque les contraintes mécaniques participent à la régulation de l’orientation de la division cellulaire. Ainsi, dans les épithéliums de mammifères, le recrutement aux contacts intercellulaires de LGN (une protéine adaptatrice qui participe au complexe qui ancre les microtubules astraux à la membrane) est favorisé par une tension jonctionnelle élevée (ressentie par les jonctions adhérentes contenant la E-cadhérine), conduisant à l’alignement des divisions cellulaires avec l’axe de la tension tissulaire (Hart et al., 2017).

Par ailleurs, les cellules doivent adopter la bonne forme (généralement arrondie pour les cellules animales) pour entrer en mitose car les microtubules astraux doivent être correctement ancrés à la périphérie de la cellule et notamment à son réseau cortical d’actine. Cela passe par une augmentation de la pression osmotique intracellulaire et par une rigidification du cortex cellulaire (Stewart et al., 2011).
Les rôles de la matrice extracellulaire
La matrice extracellulaire (MEC) est un réseau complexe de protéines et de polysaccharides situé autour des cellules. Elle ne se contente pas de fournir un simple support structurel : elle joue un rôle actif et essentiel dans le développement embryonnaire et la régénération tissulaire.
POUR UNE PRESENTATION GENERALE DES MATRICES EXTRACELLULAIRES, VOIR CETTE PAGE
La MEC influence la forme, la migration et la différenciation des cellules en exerçant des forces mécaniques ou en modulant celles que les cellules peuvent ressentir. Elle agit comme un « milieu physique » dont la rigidité (« stiffness » en anglais) varie selon les tissus.
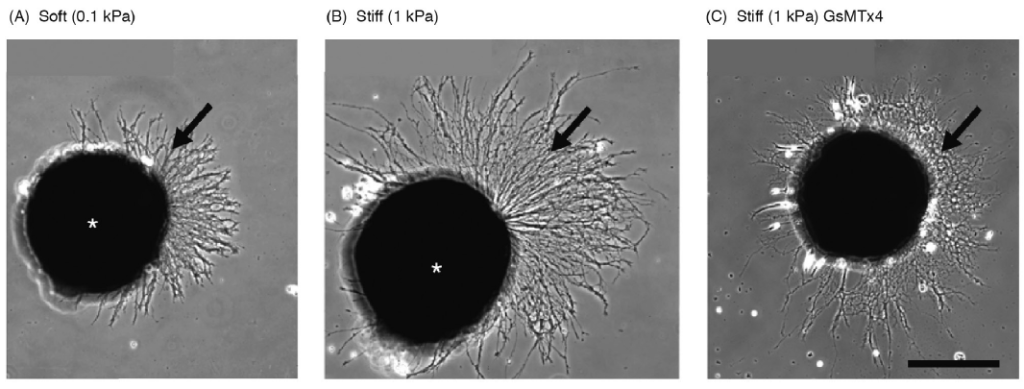
Les cellules en migration tout comme les axones en développement grâce à leur cône de croissance sont sensibles à la rigidité de la MEC qu’ils traversent.
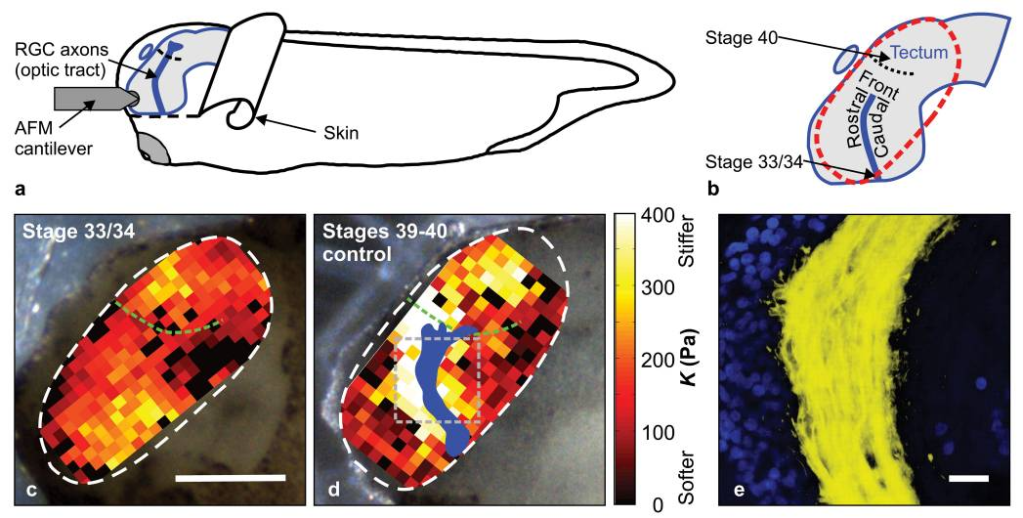
In vivo, les axones des cellules ganglionnaires de la rétine de xénope suivent le chemin où le tissu est le plus dur durant leur trajet vers le tectum.
La rigidité de la MEC a une influence importante sur le nombre de points focaux d’adhérence, les protéines qui y sont associées et la répartition du cytosquelette.

Pour migrer efficacement dans différents tissus, les cellules doivent détecter et s’adapter aux variations des propriétés mécaniques de leur environnement. Dans ce processus adaptatif, les points focaux d’adhérence (PFA) peuvent coupler le comportement des fibres de stress (ou de tension) d’actomyosine avec les modifications de la matrice extracellulaire. Il existe plusieurs types de fibres de tension.

Les PFA associés à l’allongement des fibres de tension dorsales sont associés à de faibles forces de traction, tandis que les PFA associés à l’allongement lent des fibres de tension ventrales sont associés à des forces de traction importantes.

Au-delà de la rigidité statique, la viscoélasticité est aussi importante et correspond au comportement mécanique dynamique de la MEC, caractérisé par une relaxation des contraintes en fonction du temps. On mesure ce paramètre par le temps de demi-relaxation de la contrainte (vitesse à laquelle la contrainte diminue sous une déformation constante).
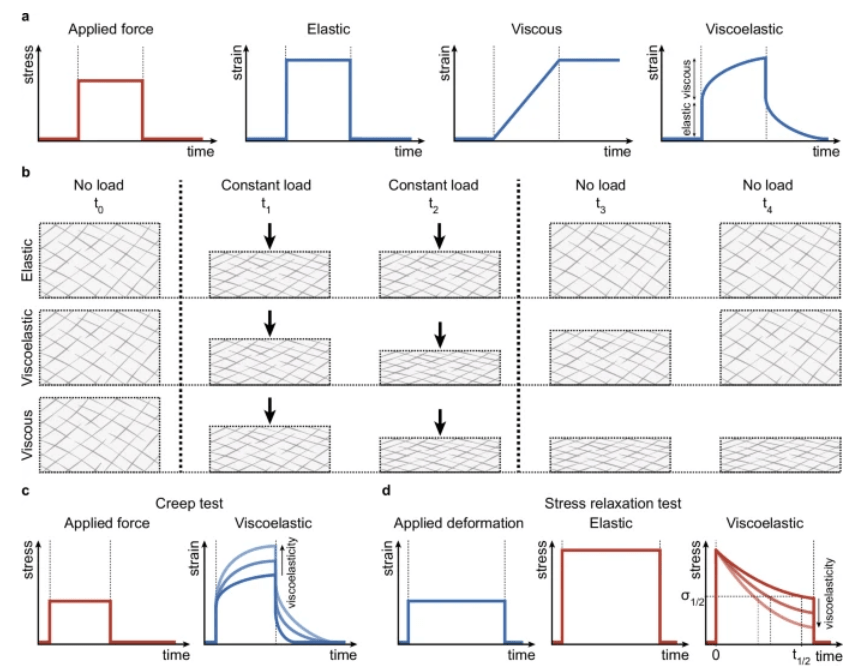
La viscoélasticité varie au cours du développement. Par exemple, la viscoélasticité du tissu cérébral évolue au cours de la maturation du tissu nerveux et une forte viscoélasticité soutient l’activité neuronale, tandis que les tissus fibrotiques perdent leur équilibre viscoélastique normal, altérant la mécanotransduction cellulaire (Guo et al., 2019). Dans l’épiblaste de la souris, des signaux moléculaires régulent l’activité des métalloprotéinases matricielles, ce qui induit un remodelage local de la membrane basale et une relaxation des contraintes, favorisant ainsi la croissance embryonnaire (Courbot et al., 2025).
Une plus grande viscoelasticité de la MEC peut favoriser le développement des cancers (Elosegui-Artola et al., 2023).
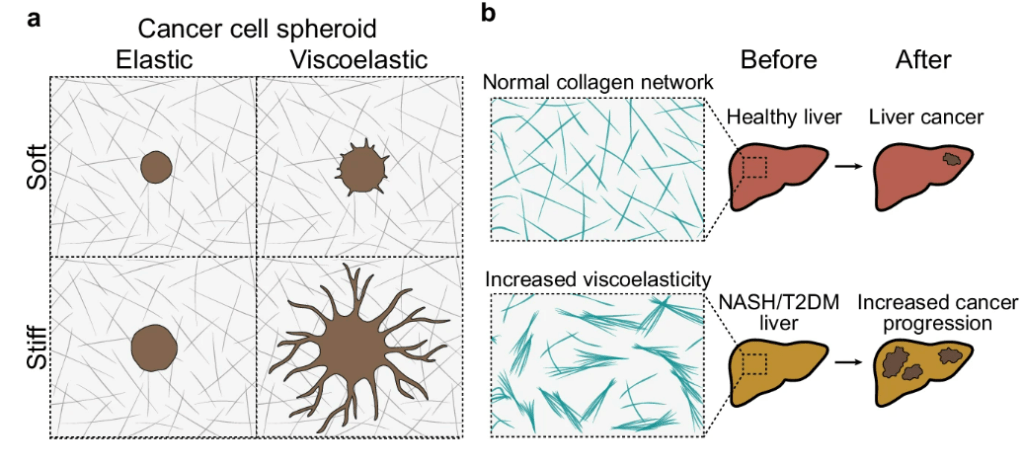
Importance de la voie Hippo (YAP/TAZ)
La voie Hippo est une voie de signalisation importante qui assure un lien important entre la biomécanique cellulaire, la topologie des tissus et l’expression des gènes dans de nombreux processus développementaux. les divers stimuli mécaniques contrôlent l’importation nucléaire et donc l’activité de YAP/TAZ, le coactivateur transcriptionnel de la voie. La mécanotransduction menant à l’activation de YAP/TAZ peut être déclenchée par la densité cellulaire (soit par l’adhérence cellule-cellule, soit par la surface cellulaire réduite (Zhao et al., 2007 ; Aragona et al., 2013 ; Benham-Pyle et al., 2015), par la rigidité de la matrice extracellulaire (MEC) (Dupont et al., 2011; Aragona et al., 2013 ; Elosegui-Artola et al., 2016), et par la contrainte de cisaillement (Nakajima et al., 2017).

et TAZ (coactivateur transcriptionnel avec motif de liaison PDZ) sont localisés
dans le noyau et actifs dans des conditions mécaniques expérimentales qui
favorisent le développement de forces de résistance intracellulaires élevées, telles qu’une forme de cellule étalée, une matrice extracellulaire (MEC) rigide ou un étirement entre des micropiliers rigides (à gauche).
L’îlot de fibronectine micro-imprimé carré (panneau du droite) est représenté. Les cellules ont été colorées pour l’actine filamenteuse (F-actine) avec de la phalloïdine (vert) et pour YAP et TAZ (rouge). Dans ces conditions, YAP et TAZ sont activées et nucléaires.
Dans des conditions mécaniques dans lesquelles les cellules développent de faibles forces contractiles (par exemple, lorsqu’elles sont cultivées sur
de petites zones adhésives favorisant une petite taille de cellule, sur une matrice extracellulaire molle ou sur des micropiliers pliables), YAP et TAZ sont inactivés et se relocalisent dans le cytoplasme.
Un îlot de fibronectine micro-imprimé carré est représenté. L’activité réduite de YAP et TAZ oriente les réponses cellulaires vers l’apoptose ou l’arrêt de la croissance ou détourne la différenciation vers des destins cellulaires qui seraient spécifiés sur une matrice molle, par exemple, les adipocytes. La régulation expérimentale des niveaux de YAP et de TAZ permet d’obtenir un contrôle similaire du comportement cellulaire, quel que soit leur environnement mécanique (non représenté). Source.
Les composants des points d’adhérences focaux, qui relient cytosquelette et MEC, régulent également l’activité YAP/TAZ en modulant la localisation subcellulaire de YAP (Kim et Gumbiner, 2015; Elosegui-Artola et al., 2016). La rigidité de la MEC et la géométrie cellulaire contrôlent l’activité YAP/TAZ grâce à de petites RhoGTPases déclenchant la tension du cytosquelette d’actomyosine (Dupont et al., 2011). Les forces exercées par l’ECM peuvent entraîner l’activité YAP/TAZ par le biais de différents mécanismes. La GTPase RAP2 liée à Ras transduit la rigidité de la MEC en réponses cellulaires YAP/TAZ via l’activation de la voie Hippo (Meng et al., 2018).
Le complexe nucléaire SWI/SNF inhibe YAP/TAZ en réponse à une signalisation mécanique, de telle sorte que pour déclencher l’activité YAP/TAZ, l’accumulation nucléaire de YAP/TAZ et l’inhibition de SWI/SNF sont nécessaires (Chang et al., 2018) . Les forces de la MEC peuvent réguler le transport à travers les pores nucléaires entraînent l’importation nucléaire de YAP d’une manière indépendante d’Hippo (Elosegui-Artola et al., 2017). De plus, Piezo1, un canal ionique mécanosensible, peut médier les effets de la rigidité du substrat sur la localisation nucléaire du YAP (Pathak et al., 2014).
YAP/TAZ ne sont pas seulement modulés par des forces mécaniques, mais peuvent aussi contribuer en retour à des modifications dans les forces mécaniques dépendantes de l’actomyosine en régulant l’expression des gènes du cytosquelette et de la MEC (Porazinski et al., 2015; Lin et al., 2017; Nardone et al., 2017). De plus, les signaux extracellulaires peuvent activer ou inhiber l’activité YAP/TAZ via les récepteurs couplés aux protéines G (GCPR). Les GTPases Rho médient l’activation de YAP/TAZ par les GPCR, modulant la tension du cytosquelette d’actomyosine (Yu et al., 2012). YAP/TAZ peut aussi indirectement augmenter la rigidité de la MEC ce qui provoque une boucle de rétroaction positive (la rigidité de la MEC activant YAP/TAZ) (Calvo et al., 2013).
YAP/TAZ peut être influencé par le mécanorécepteur Piezo1. Par exemple, la localisation nucléaire de YAP est compromise en l’absence de PIEZO1 dans les cellules progénitrices périostéales qui alors se différencient en cellules de tendons et non pas en cellules osseuses (Wang et al., 2025).

À gauche : En environnement rigide, l’activation de PIEZO1 permet l’entrée de calcium (Ca²⁺) dans la cellule, ce qui active la voie YAP et favorise l’expression du facteur Scx. Cette cascade de signalisation oriente les cellules vers une différenciation ostéogénique, favorisant la régénération osseuse.
À droite : En environnement plus souple, PIEZO1 n’est pas activé, le calcium n’entre pas, YAP reste inactif et l’expression de Scx est réduite. Cela oriente les cellules vers une différenciation tendineuse, favorisant la régénération des tendons. Source : https://www.cell.com/cell-reports/fulltext/S2211-1247(25)00401-2
Implication d’autres voies de signalisation
La β-caténine est un élément important liant stimuli mécaniques et voies de signalisation car elle est associée aux cadhérines dans les jonctions adhérentes et est également impliquée dans la voie de signalisation Wnt. Par exemple, lors de la gastrulation chez la drosophile, la tension mécanique générée par la constriction apicale des cellules msodermiques déclenche une voie de signalisation impliquant la phosphorylation d’Armadillo/β-caténine sur la tyrosine-667, qui est libérée des jonctions adhérentes et pénètre dans le noyau pour maintenir l’expression de Twist, le facteur de transcription essentiel pour la détermination du mésoderme. Ce mécanisme est conservé car il se retrouve également chez le poisson-zèbre (Brunet et al., 2013).

L’interaction vinculine/α-caténine est particulièrement importante pour transmettre les forces de tension entre l’extérieur et l’intérieur de la cellule dans un épithélium (Seddiki et al., 2018). La tension intracellulaire induit des changements conformationnels dans l’α-caténine exposant son site cryptique de liaison à la vinculine (VBS pour Vinculin Binding Site) (Yonemura et al., 2010; Yao et al., 2014). Une fois liée à l’α-caténine, la vinculine réalise une transition vers une conformation ouverte capable de se lier au cytosquelette d’actine, permettant à son tour aux complexes d’adhésion de se renforcer et de résister à des forces plus élevées dans les cellules sous tension (le Duc et al., 2010; Dumbauld et al., 2013).

La formation de cavités liquidiennes et leurs rôles lors du développement
Plusieurs étapes du développement impliquent la formation de cavités remplies de liquide lors du développement : formation du blastocoele au cours du développement précoce, de la cavité amniotique, de la cavité coelomique, de la lumière du tube neural qui se remplit de liquide céphalo-rachidien ou formation de l’antrum dans les follicules de De Graaf. La pression qu’exerce le liquide dans cette cavité joue un rôle essentiel dans la morphogenèse.

Une pression excessive du liquide céphalorachidien (LCR) dans la lumière du tube neural au niveau du cerveau en développement, notamment observée dans des pathologies telles que l’hydrocéphalie, peut avoir des effets profonds et durables sur la structure et le fonctionnement du cerveau. Cette pression accrue entraîne la dilatation des ventricules cérébraux et la compression des tissus cérébraux, perturbant ainsi les processus neurodéveloppementaux normaux.
Les particularités biomécaniques des cellules végétales
Les particularités biomécaniques des cellules végétales proviennent principalement de deux éléments non présents chez les animaux : la paroi cellulaire à l’extérieur des cellules et la pression de turgescence de la vacuole à l’intérieur des cellules. Ces facteurs sont essentiels pour le développement, la croissance et la morphogenèse des plantes.
La paroi cellulaire, composée majoritairement de cellulose, hémicelluloses, pectines, lignine et autres polymères, est la principale structure conférant rigidité et résistance aux cellules végétales. La cellulose forme des microfibrilles très résistantes (avec un module d’élasticité environ la moitié de celui de l’acier), qui déterminent la directionnalité de la croissance cellulaire en orientant la déposition des microfibrilles selon les contraintes mécaniques (Cheng et al., 2009). Les microtubules corticaux ont un rôle fondamental dans l’orientation des microfibrilles de cellulose car les enzymes permettant la polymérisation de la cellulose sont liés en complexe avec eux.
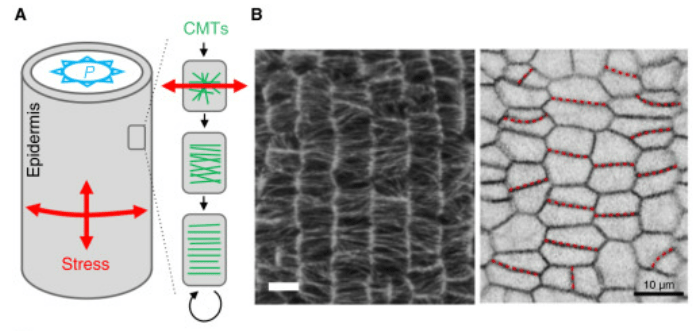
A) La vue schématique montre la pression dans un cylindre modélisant par exxemple une tige liée à la turgescence (P) des cellules et les directions principales des contraintes mécaniques (flèches rouges, “Stress”) qui en résultent dans l’épiderme. Sous contrainte, les microtubules corticaux (CMTs, verts) s’orientent parallèlement à la direction de la contrainte la plus forte, ce qui guide le dépôt des microfibrilles de cellulose et la croissance cellulaire dans une direction préférentielle.
B) Image centrale : Visualisation par microscopie montrant l’orientation régulière des microtubules corticaux dans l’épiderme d’une plante; Image de droite : Vue du contour des cellules épidermiques, avec les nouvelles parois cellulaires mises en évidence par des traits rouges (lignes pointillées), qui illustrent la formation de parois suivant une orientation contrôlée par les contraintes mécaniques. Source : https://www.sciencedirect.com/science/article/pii/S0960982220318200
La pression interne élevée due à la turgescence exerce une force contre la paroi cellulaire, contribuant à la tension mécanique. Cette pression joue un rôle clé dans la croissance cellulaire en stimulant l’extension de la paroi, mais elle doit être compensée par la rigidité de la paroi pour éviter la rupture cellulaire.
