Niveaux de difficulté : * = embryon; ** = têtard; *** = mature
EXERCICE 1

*1.1 En quoi ces stades du développement sont-ils particuliers en ce qui concerne les cycles cellulaires ?
*1.2 Analysez et interprétez les variations de la quantité de Cycline B1.
*1.3 Expliquez la base biologique du test de l’activité de Cdk1.
*1.4 Analysez et interprétez les variations de l’activité de Cdk1.
**1.5 Que nous révèle l’analyse des oscillations de la quantité de Cdk1 phosphorylée sur la tyrosine 15 ?
**1.6 Analysez et interprétez les variations de la proportion de Cdc25C hyperphosphorylée.
**1.7 Analysez et interprétez les variations de la quantité de Cdc25C phosphorylé sur la sérine 287.
EXERCICE 2

*2.1 A quelle étape de la méiose se trouvent les ovocytes ? Quel est le génotype de ces ovocytes produits par les femelles Ccnb2+/- ?
*2.2 Que cherche-t-on à vérifier avec le western-blot en A ?
*2.3 Que nous apprend l’expérience en B ?
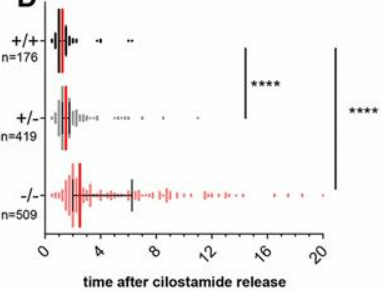
*2.4 Analysez et interprétez les résultats.
EXERCICE 3

*3.1 Quels sont les effets de la surexpression de AurB-GFP sur AurA, AurB et AurC et leurs formes phosphorylées mis en évidence dans ce western-blot ?
*3.2 Quel est l’effet de la surexpression de AurB-GFP sur l’activité kinase de AurB sur l’histone H3 ?
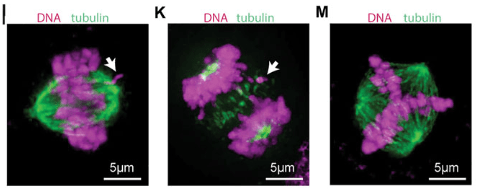
*3.3 Décrivez et caractérisez les défauts observés sur ces figures mitoses (dont vous préciserez le stade).
**3.4 Qu’est-ce qui pourrait être à l’origine des défauts observés en I et K ?
EXERCICE 4
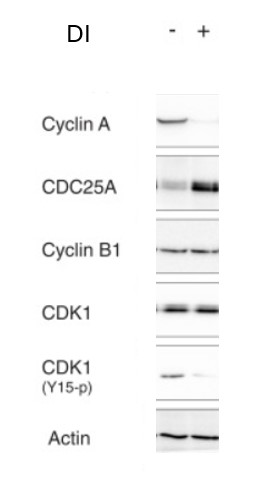
*4.1 Est-ce que le système de dégradation inductible de la cycline A a fonctionné ?
*4.2 Quel est l’effet sur l’expression de la dégradation de la cycline A sur l’expression de CDC25A ? Donnez des hypothèses pour l’expliquer.
*4.3 Quel est l’effet sur CDK1 ? Expliquez l’origine probable de cet effet.
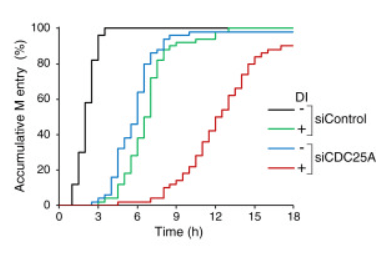
**4.4 Analysez les résultats et interprétez.
EXERCICE 5
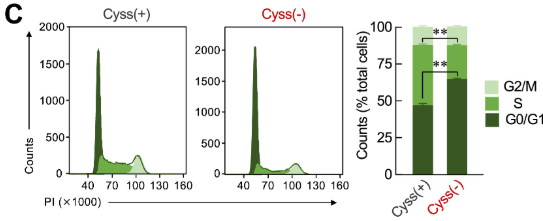
Beaucoup de cellules tumorales sont très dépendantes de l’apport extérieur de cystéine. On cultive pendant 24h des cellules d’hépatocarcinomes de souris dans un milieu supplémenté en cystéine (Cyss(+)) ou dans un milieu appauvri en cystéine (Cyss(-)). On analyse par cytométrie en flux la fluorescence de l’iodure de propidium. Source : https://www.jbc.org/article/S0021-9258(24)02392-5/fulltext
*5.1 Qu’est-ce que la cytométrie en flux ? Quelle information nous apporte la fluorescence de l’iodure de propidium ?
*5.2 Analysez et interprétez les résultats de l’expérience.
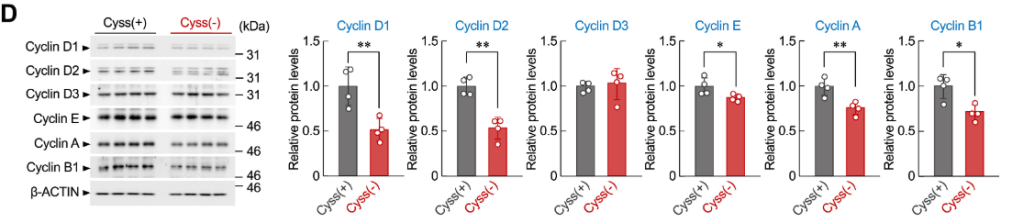
On réalise quatre expériences indépendantes comme précédemment et on extrait les protéines que l’on soumet à une analyse western-blot avec les anticorps indiqués. Les graphiques présentent les résultats de la quantification en normalisant par rapport aux cultures en milieu supplémenté en cystéine.
*5.3 Pourquoi réalise-t-on une détection avec l’anticorps anti-β-actine ?
**5.4 Analysez et interprétez les résultats, notamment en tenant compte des résultats de 5.2
EXERCICE 6
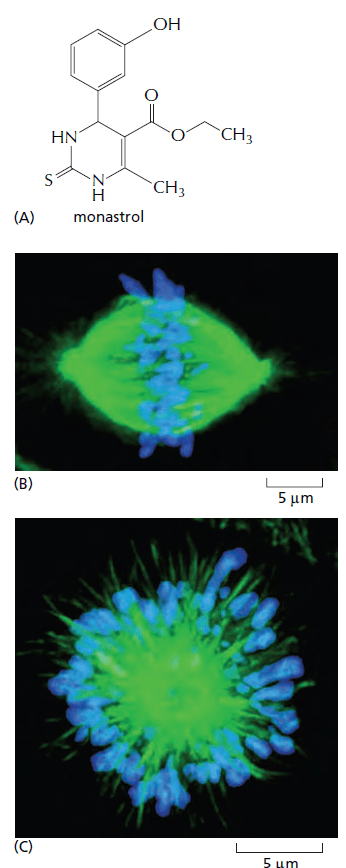
*6.1 D’après vos connaissances, quelle est la principale fonction des kinésines ?
*6.2 Analyez et interprétez les effets du monastrol mis en évidence en C.
REPONSES
1.1 : Ce sont des stades où il y a une oscillation entre une phase S et une phase M qui se succèdent très rapidement (surtout à partir du stade 2 cellules). Il n’y a pas de phase G1 et pas de phase G2. Tout se déroule sans transcription. 1.2 : On observe une augmentation de la quantité de cycline B1 puis une baisse avant chaque division. La hausse est nettement plus marquée chez le zygote avant la première division. Il s’agit des variations classiques avec accumulation de la cycline B1 jusqu’à la métaphase puis sa dégradation par la suite lors de la dernière partie de la mitose par le protéasome. Ici, l’augmentation de la quantité de cycline B1 ne peut pas être dûe à de la transcription (il n’y en a pas à ce stade) mais est sans doute dûe à de la traduction. 1.3 : Cdk1 est une kinase et elle phosphoryle l’histone H1 ce qui provoque la forte condensation de la chromatine en prophase de mitose. 1.4 : Les variations de l’activité de Cdk1 suit les variations de la cycline B1 ce qui est attendu puisque l’activité kinase de Cdk1 dépend de son association avec la cycline B1. 1.5 : La phosphorylation sur la tyrosine 15 de Cdk1 aboutit à une inhibition de son activité kinase. On observe un pic de cette phosphorylation à chaque fois un peu avant le pic d’activité de Cdk1 ce qui veut dire que la montée de cette activité est freinée par un mécanisme régulateur. Le relâchement de ce mécanisme aboutit au pic d’activité. 1.6 : Cdc25C est hyperphosphorylée pendant les mitoses. Elle joue un rôle de déphosphorylation de la tyrosine 15 de CDK1 donc on peut imaginer que cette hyperphosphorylation stimule son activité phosophatase et aide à activer CDK1 lors de la mitose. 1.7 : Les oscillations de la phosphorylation de la sérine 287 sont en opposition de phase avec les hyperphosphorylations mitotiques de Cdc25C. On peut imaginer que la phosphorylation de la sérine 287 inhibe l’activité de Cdc25C et l’empêche d’aller déphosphoryler la tyrosine 15 de CDK1 en dehors de la mitose.
2.1 : Des ovocytes non ovulés chez des souris adultes sont bloqués en prophase I de méiose. La première division de méiose n’a pas encore séparé les chromosomes paternels et maternels, donc les ovocytes des femelles Ccnb2+/- possèdent un allèle sauvage et un allèle muté perte-de-fonction. 2.2 : On vérifie que l’expression de CCNB2 est bien abolie dans les ovocytes issus des femelles Ccnb2-/- et que l’expression est diminuée environ de moitié dans les ovocytes issus des femelles Ccnb2+/-. Le western-blot permet aussi de vérifier que l’expression du partenaire de CCNB2, CDK1 n’est pas affectée par la diminution ou l’absence de CCNB2. 2.3 : On observe qu’en absence de CCNB2, CDK1 est nettement moins capable de phosphoryler PP1 (moins de la forme phosphorylée avec autant de PP1 total). On en déduit que CCNB2 est nécessaire à la bonne activité kinase de CDK1 (au moins lorsque sa cible est PP1). 2.4 : Lorsqu’il y a une diminution de la quantité de CCNB2 (et encore plus lorsqu’il n’y en a plus), la reprise de la méiose prend plus de temps. Notons tout de même qu’elle a lieu donc CCNB2 n’est pas entièrement nécessaire mais permet d’accélerer le processus. On peut imaginer que d’autres cyclines B et notamment cycline B1 (CCNB1) peuvent finir par compenser l’absence de CCNB2.
3.1 : On observe que la surexpression de GFP-AurB fait baisser un peu la production de AurB endogène (bande plus basse sur le western-blot car sans la GFP qui fait 27 kDa) et sa phosphorylation. GFP-AurB est aussi présente sous une forme phosphorylée (en quantité plus importante que la forme endogène phosphorylée). La quantité de AurA phosphorylée reste identique mais la quantité de AurB et de AurC phosphorylée est diminuée. 3.2 : Il y a moins de forme phosphorylée de l’histone H3 lorsque GFP-AurB est surexprimé. Il faudrait toutefois connaître la quantité totale de l’histone H3 pour vérifier qu’il s’agit juste bien d’un manque d’activité kinase ou s’il y a indirectement une baisse de l’expression de l’histone H3 (phosphorylée ou non). 3.3 : I) Métaphase. L’un des chromosomes ne semble pas aligné avec les autres sur la plaque métaphasique. K) Fin anaphase. L’un des chromosomes est resté sur la plaque métaphasique. M) Métaphase. Il y a un fuseau mitotique multipolaire (et non seulement bipolaire). 3.4 : Il pourrait s’agir d’un dysfonctionnement des kinétochores qui ancrent les microtubules au centromère ce qui permet de contrôler les déplacements des chromosomes lors des phases de la mitose.
4.1 La quantité détectée d’actine est la même dans chaque condition, donc on raisonne à protéines totales identiques entre toutes les conditions. On observe que lorsqu’on se met dans les conditions DI+ la quantité de cycline A est nettement plus faible qu’en conditions DI- où rien n’a été induit. On en conclut que le système de dégradation inductible de la cycline A a bien fonctionné. 4.2 L’expression de CDC25A est fortement augmentée en cas de dégradation de la cycline A. On peut imaginer que la cycline A active l’expression d’un inhibiteur de la transcription ou de la traduction de CDC25A ou alors que cycline A stimule sa dégradation. 4.3 La quantité de CDK1 reste la même, mais sa phosphorylation sur la tyrosine 15 est nettement plus faible en absence de cycline A. On peut le corréler à la hausse de l’expression de CDC25A car il s’agit d’une phosphatase qui enlève la phosphorylation sur la tyrosine 15 (la phosphorylation est quant à elle, catalysée par Wee1 ou Myt1 (voir cours)). 4.4 Sans dégradation accélérée de cycline A, l’inhibition de l’expression de CDC25A aboutit à un retard de l’entrée en mitose car CDK1 n’est probablement pas déphosphorylée suffisamment rapidement sur sa tyrosine 15 et reste anormalement longtemps sous sa forme inactive pour activer l’entrée en mitose (associé à la cycline B). Lorsque la cycline A est dégradée de manière accélérée mais en présence de CDC25A (DI+, siControl), on observe aussi un retard d’entrée en mitose, ce qui est étonnant car il y a plus de CDC25A et CDK1 est moins phosphorylé sur la tyrosine 15 ce qui devrait stimuler l’entrée en mitose. Il y a sans doute dans ce cas, un mécanisme de point de contrôle qui assure que la cellule ne rentre pas trop tôt en mitose si la phase S où agit la cycline A est perturbée. Lorsqu’on cumule les deux effets (dégradation accélérée de la cycline A et inhibition de l’expression de CDC25A) on a logiquement un très grand retard d’entrée en mitose.
5.1 La cytométrie en flux permet de mesurer simultanément plusieurs caractéristiques physiques et chimiques de cellules ou de particules en suspension lorsqu’elles passent une par une devant un faisceau laser. Elle repose sur la détection de la fluorescence et la diffusion de la lumière, permettant ainsi d’analyser des paramètres comme la taille, la granularité et l’expression de marqueurs spécifiques. L’iodure de propidium (IP) est un colorant intercalant de l’ADN qui devient fluorescent associé à l’ADN. Il permet de quantifier la quantité d’ADN dans les cellules, ce qui aide à déterminer les différentes phases du cycle cellulaire (G0/G1 (quantité normale d’ADN = fluorescence faible), S (quantité intermédiaire d’ADN car la réplication est en cours = fluorescence moyenne) et G2/M (quantité double d’ADN car la réplication a eu lieu mais les deux cellules-filles ne se sont pas encore formées = fluorescence forte). 5.2 En conditions de faible apport de cystéine, on observe une proportion plus importante de cellules qui sont en phase G0/G1 comparée aux conditions avec un apport de cystéine normal. La proportion de cellules en réplication (phase S) est plus faible, en revanche la proportion de cellules en G2/M n’est pas affectée. On en déduit qu’il y a un blocage de l’entrée en phase S et une accumulation de cellules dans les phases précédentes dans le cycle (G0 et G1). 5.3 La β-actine sert de contrôle de dépôt. Toutes les quantifications sont dans un premier temps normalisées par rapport à elle avant de normaliser par rapport aux cultures supplémentées en cystéine. 5.4 On constate une baisse de l’expression des cyclines D1, D2, E, A et B1 lorsque le milieu est carencé en cystéine. La quantité plus faible de cyclines de type D et E permet d’expliquer le blocage en GO/G1, celle plus faible de cycline A peut être à la fois la cause et la conséquence du fait qu’il y ait moins de cellules en phase S. La quantité plus faible de cycline B1 devrait affecter l’entrée en mitose mais on ne voit pas cet effet avec les résultats de 5.2. Peut-être qu’une autre cycline de type B compense la baisse de cycline B1 ou que la baisse n’est pas suffisamment forte.
6.1 Les kinésines sont des moteurs moléculaires qui peuvent transporter des complexes moléculaires, des vésicules ou des organites vers le pôle positif des microtubules. 6.2 La cellules observée en B est en métaphase de mitose. En présence de monastrol, la plaque métaphasique est complètement désorganisée. Les microtubules, au lieu de rayonner à partir des deux extrémités de la cellule, rayonnent à partir du centre ce qui indique que des kinésines sont impliquées dans la mise en place du fuseau mitotique et probablement dans la séparation des paires de centrosomes qui contrôlent l’organisation des microtubules.
< Retour sur la page sur les cycles et les divisions cellulaires.
