Par Patrick Pla, Université Paris-Saclay
Les concentrations cytosoliques de Ca2+ sont habituellement basses (de l’ordre de 100 nM, soit 20.000 fois moins environ que dans le milieu extracellulaire) et l’augmentation de cette concentration par l’ouverture de canaux sur le réticulum endoplasmique ou sur la membrane plasmique augmente l’activité de certaines protéines et déclenche des cascades de signalisation. Selon le contexte cellulaire, ces variations de concentration calcique cytosolique peuvent varier en amplitude et en durée et peuvent éventuellement osciller. Il y a une « signature calcique » à chaque stimulus et à chaque contexte cellulaire.
Il existe deux sources majeures d’ions Ca2+ qui permettent d’augmenter la concentration cytosolique : une réserve interne de calcium dans le réticulum endoplasmique (et dans une moindre mesure dans la mitochondrie) et le milieu extracellulaire. Le passage du Ca2+ d’un compartiment à l’autre dépend de l’activité de pompes et de canaux transmembranaires perméables au calcium. Les canaux transmembranaires facilitent les flux de calcium dans le sens du gradient électrochimique transmembranaire et les pompes, quant à elles, permettent le transport de calcium contre ce gradient, ce qui coûte de l’énergie.
- Comment visualiser la concentration de Ca2+ dans les cellules ?
- Contrôle de l’entrée du Ca2+ dans le cytosol
- En aval du Ca2+ cytosolique
- Contrôle de la sortie du Ca2+ cytosolique
- La signalisation calcique et la fécondation
- La signalisation calcique et la fermeture des stomates
Comment visualiser la concentration de Ca2+ dans les cellules ?
Des molécules à la fluorescence augmentée par les ions Ca2+ sont devenus des outils précieux pour ce domaine de recherche. La première molécule a avoir été populaire dans les laboratoires est le Fura-2, un acide aminopolycarboxylique, découvert en 1986. Il absorbe à 340-380 nm (UV) et son émission à 510 nm dépend de la concentration calcique.
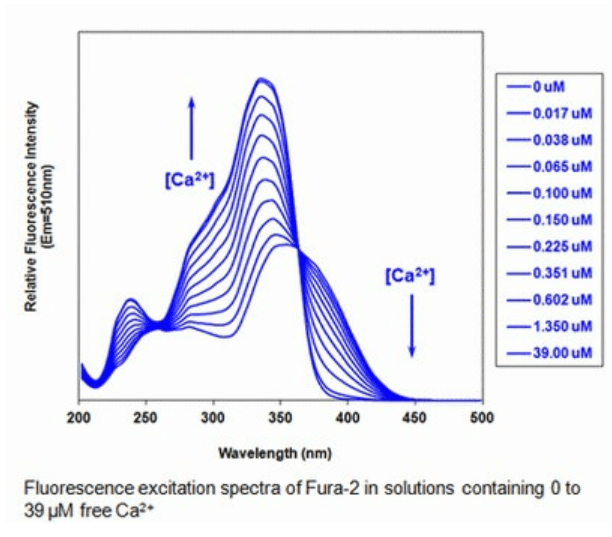
Plus récemment, une protéine fusion entre la GFP, la calmoduline (une molécule de signalisation sensible à la concentration en Ca2+) et M13 (une courte séquence de la kinase de la chaine légère de la myosine) a été mise au point, GCamp.
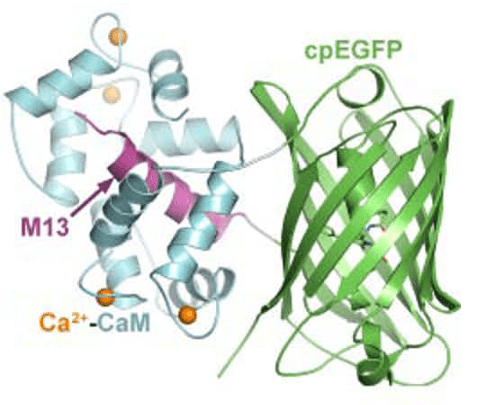
Source : https://www.jbc.org/article/S0021-9258(20)32673-9/fulltext
Comme c’est une protéine, on peut la faire exprimer sous le contrôle de l’ADN (et via un promoteur spécifique par exemple) dans les cellules ou les embryons.
Une variante de l’outil précédent consiste à utiliser le FRET (transfert d’énergie par résonance). Le FRET ne fonctionne que si les deux molécules composant le couple FRET sont très rapprochées (< 10 nm). Les protéines dites caméléon consistent en une fusion de calmoduline liant Ca2+ à M13 et flanqué d’un côté par un GFP décalé vers le bleu et de l’autre côté par un GFP décalé des longueurs d’onde plus longues. Lorsque Ca2+ se lie à la calmoduline, la distance entre les molécules GFP sont modifiées et l’efficacité du FRET augmente.
Contrôle de l’entrée du Ca2+ dans le cytosol
L’entrée du Ca2+ dans le cytosol peut être déclenchée par des ligands extérieurs :
- soit directement comme dans le cas des récepteurs NMDA au glutamate dans le système nerveux qui sont des canaux à Ca2+. Ces récepteurs-canaux font entrer les ions Ca2+ quand le glutamate se lie à eux et que concomitamment, il y a une dépolarisation membranaire qui permet de chasser le Mg2+ de son site de liaison sur les récepteurs car sa présence empêche les ions Ca2+ de passer. La dépolarisation est le plus souvent initiée en présence de glutamate par d’autres types de récepteurs, les récepteurs AMPA, mais qui ne font généralement pas entrer du Ca2+ mais Na+ (la faible perméabilité des canaux AMPA au Ca2+ est liée à la présence d’une arginine (chargée positivement) dans la sous-unité GluA2).
- soit indirectement via une cascade de signalisation
Dans ce dernier cas, les acides gras à phosphatidylinositol jouent un rôle important dans les voies de signalisation menant à l’entrée du Ca2+ dans le cytosol. Deux acides gras hydrophobes ancrent le phosphatidylinositol à la membrane. Les PI3-kinases phosphorylent le cycle inositol du phosphatidylinositol bi-phosphate (PIP2) en position 3 donnant ainsi le PIP3. La phosphatase PTEN a un effet opposé : elle tranforme le PIP3 en PIP2.
Quand PIP3 s’accumule, il recrute à la membrane plasmique des protéines contenant un domaine d’homologie de type pleckstrine (PH).
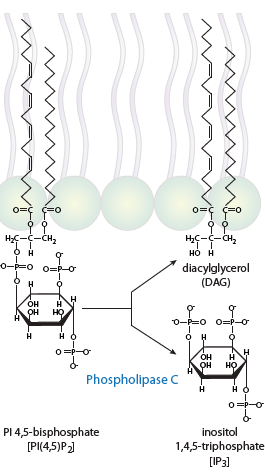
En plus d’être un substrat pour former le PIP3, PIP2 peut être la source de deux autres cofacteurs. La phospholipase C (PLC) est capable de cliver PIP2 en DAG (diacylglycérol) et en IP3 (inositol-1,4,5-trisphosphate) qui agissent en tant que seconds messagers. Tandis que le DAG reste à la membrane, l’IP3 est soluble dans l’eau et diffuse de la membrane vers le cytosol.
DAG est un cofacteur activateur de la protéine kinase C (PKC), une sérine/thréonine kinase. La PKC a été identifiée comme le substrat de l’ester de phorbol, un puissant promoteur de tumeur (Blumberg, 1988). Les esters de phorbol activent la PKC en imitant le DAG, qui est l’activateur physiologique de la PKC.
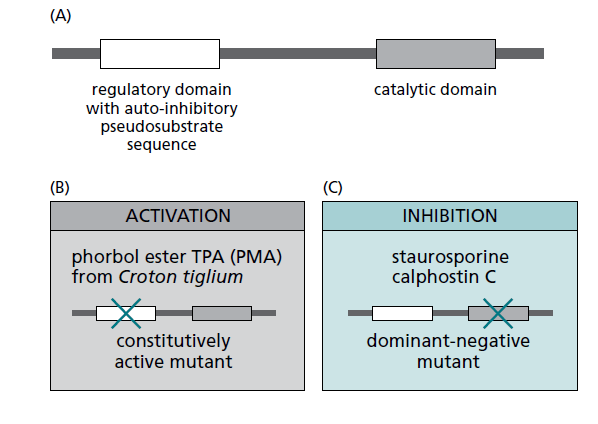
interagit avec le domaine catalytique de la PKC mais inhibe, en plus de la PKC diverses autres protéines kinases. La calphostine C (des espèces
Cladosporium) est plus spécifique et elle interagit avec le domaine régulateur. Pour inhiber la PKC, on peut générer aussi un
mutant dominant-négatif par suppression du domaine catalytique. Source : https://books.google.fr/books/about/Cellular_Signal_Processing.html?id=xwMpAQAAMAAJ&redir_esc=y
La phospholipase C (PLC) peut être activée par des récepteurs à 7 domaines transmembranaires couplés aux protéines G de type Gq/11.
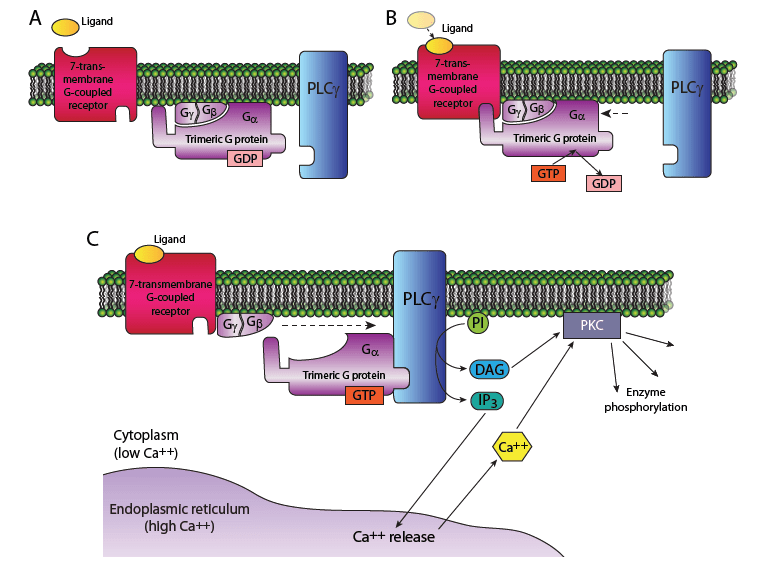
C’est le cas par exemple du récepteur à la GnRH dans les cellules de l’adénohypophyse qui contrôle la production et la sécrétion des hormones gonadotropes FSH et LH. C’est la sous-unité α de la protéine Gq/11 qui se dissocie du reste du complexe et active la phospholipase C.
IP3 agit sur l’un des acteurs majeurs de la signalisation calcique, le réticulum endoplasmique (RE), en se fixant sur un récepteur IP3R à sa surface. Ces récepteurs sont constitués de 4 sous-unités formant un canal. Il existe 3 isoformes d’IP3Rs qui peuvent s’assembler en homo- ou en hétérotétramères. Ils diffèrent par leurs domaines de liaisons à l’IP3, et par leur domaine dit de modulation qui peut être affecté par des phosphorylations (par exemple par la PKA) et qui permet des interactions avec la calmoduline. Cela permet de moduler les propriétés de libération du calcium par ces récepteurs (Mikoshiba, 2007; Taylor, 2017).
La sortie des ions Ca2+ du RE peut être couplée à une ouverture de canaux Ca2+ à la membrane plasmique par le mécanisme SOCE (pour store-operated Ca2+ entry). La réduction de la concentration de Ca2+ libre du RE provoque la dissociation du Ca2+ des sites de liaison dans la lumière du RE du Ca2+ de la protéine STIM1, une protéine dimérique intégrée dans les membranes du RE. STIM1 déplie alors des domaines cytosoliques qui interagissent avec un canal à Ca2+ de la membrane plasmique, Orai1, provoquant l’ouverture de son pore et l’entrée du Ca2+ (Lewis, 2020).
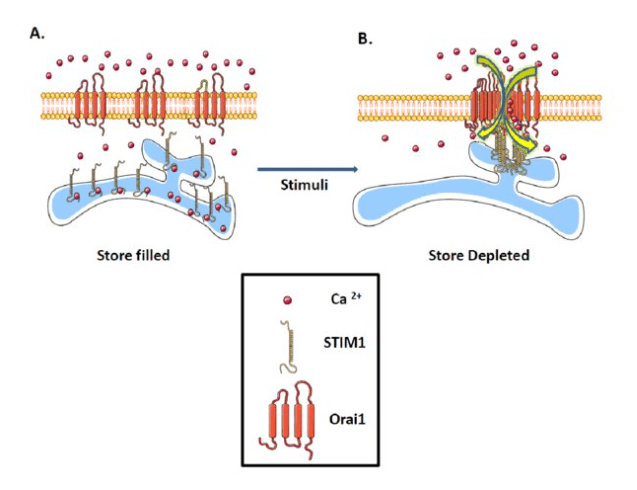
Les canaux tétramériques Orai1 sont fermés et distribués dans toute la membrane plasmique. B : Lors de l’épuisement des réserves de Ca2+, le Ca2+ se dissocie de STIM1, ce qui entraîne son agrégation dans les zones de jonctions ER-membrane plasmique proches (zones appelés puncta). Après l’agrégation,
STIM1 interagit physiquement avec les canaux Orai1 ce qui ouvre ces canaux
entraînant un afflux de Ca2+ dans la cellule. Source
Une voie de signalisation Wnt non canonique aboutit à l’augmentation de la concentration de Ca2+ dans le cytosol. Les Wnt se fixent alors au co-récepteur tyrosine kinase Ryk. Chez la drosophile, l’orthologue de Ryk, Derailed, est impliqué dans la répulsion des axones en croissance par Wnt5 (Yoshikawa et al., 2003).
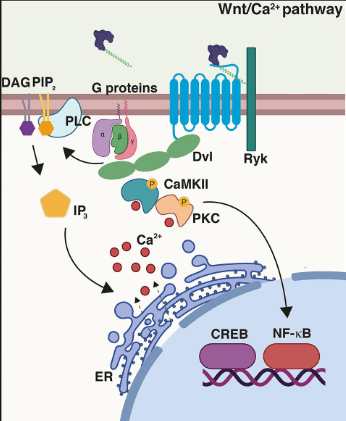
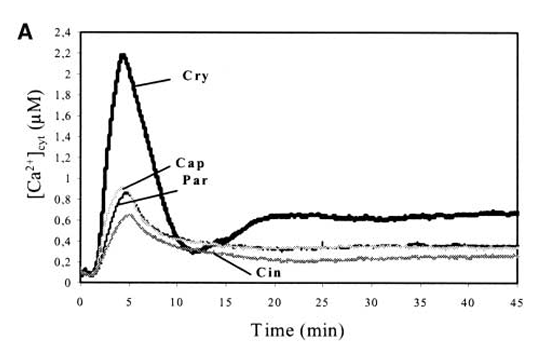
Dans les cellumes végétales, l’entrée du Ca2+ dans le cytosol peut aussi être l’aboutissement de voies de signalisation activées par différents stimuli, notamment la présence de molécules d’agents pathogènes appelés éliciteurs. Si l’augmentation de la concentration du Ca2+ est massive et prolongée (comme dans le cas de la cryptogéine produite par le champignon Phytophthora cryptogea, cela peut aboutir à la nécrose des tissus, ce qui constitue une mécanisme de défense qui limite la propagation du pathogène au reste de la plante (Lecourieux et al., 2002)
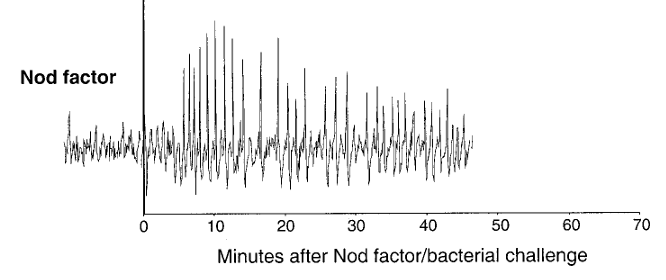
Dans d’autres cas, cela peut être des molécules d’organismes symbiotiques qui provoquent une augmentation du calcium intracellulaire comme les facteurs Nod, des lipo-chito-oligosaccharides produits par les bactéries du genre Rhizobium lors de la formation des nodosités avec les Fabacées. L’application de facteurs Nod sur les racines de Fabacées déclenche d’abord un influx rapide de calcium observé dans la minute suivant le traitement, suivi, environ dix minutes plus tard, par des oscillations calciques localisées autour et à l’intérieur du noyau, qui se prolongent pendant 30 à 45 minutes. Les facteurs Nod sont perçus par les récepteurs kinases NFR1/NFR5 qui déclenchent une cascade de signalisation aboutissant à l’entrée de Ca2+ (Harris et al., 2003; Gao et al., 2021). Ces ions à leur tour stimulent une cascade qui aboutit à l’activation de l’expression des nodulines, des protéines impliquées dans la formation des nodosités.
Les canaux Ca2+ voltage-dépendants (VGCC pour Voltage-Gated Calcium Channels), exprimés dans les cellules excitables, sont de grands canaux transmembranaires qui subissent des changements de conformation en réponse à des modifications du potentiel membranaire. En potentiel de repos, ils sont généralement fermés. L’ouverture de ces canaux provoque un afflux rapide de Ca2+ depuis l’espace extracellulaire, qui déclenche des contractions musculaires ou une exocytose dans la fente synaptique.
Un excès d’ouverture des canaux Ca2+ voltage-dépendants est une cause majeure de l’excitotoxicité dans les neurones, notamment en réponse à un excès de stimulation par le glutamate.
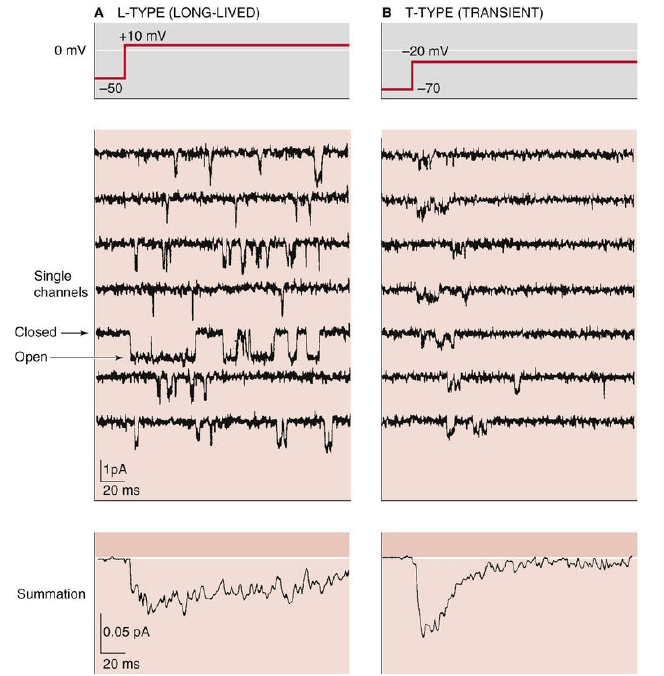
Les canaux calciques voltage-dépendants sont formés d’un complexe de plusieurs sous-unités différentes : α1, α2δ, β1-4 et γ. La sous-unité α1 forme le pore conducteur d’ions tandis que les sous-unités associées ont plusieurs fonctions, notamment la modulation du déclenchement d’ouverture.
Au début du développement, les canaux calciques de type T (ou Cav3) s’expriment en grande quantité dans les neurones (activés par un voltage bas, effet transitoire). Au cours de la maturation du système nerveux, l’expression des canaux de type N ou L (Cav1 et Cav2, activés par un voltage élevé, effet long) devient plus importante. Par conséquent, les neurones matures expriment davantage de canaux calciques qui ne seront activés que lorsque la cellule sera significativement dépolarisée.
Les canaux calciques voltage-dépendant permettent de faire rentrer du Ca2+ dans les neurones en croissance et la longueur des neurites (dendrites et axone) dépend de ces canaux.
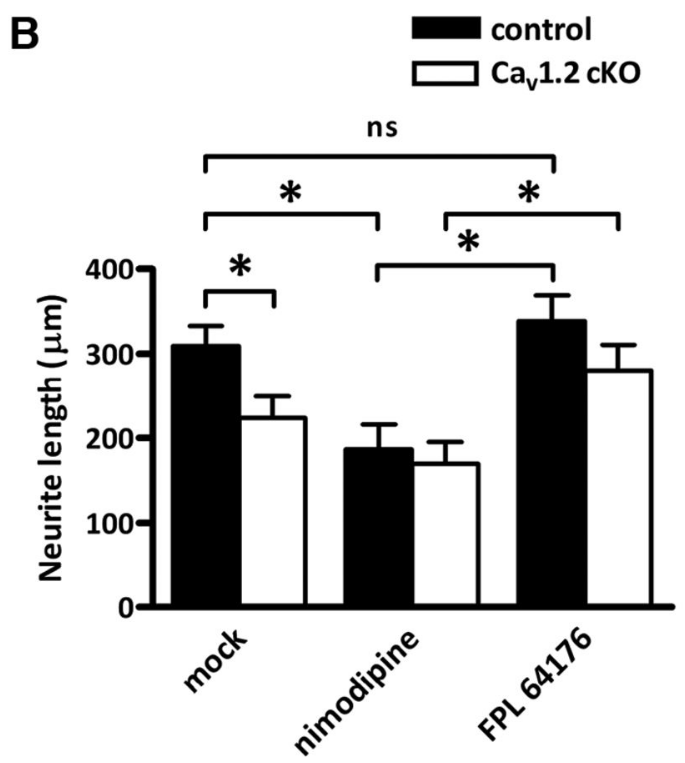
Les terminaisons nerveuses présynaptiques des synapses présentent une forte densité de canaux calciques voltage-dépendants, le plus souvent des canaux Cav2.1 (type P/Q), Cav2.2 (type N), ou une combinaison des deux. L’arrivée d’un potentiel d’action dans la terminaison ouvre ces canaux, provoquant un afflux de Ca2+ qui déclenche la libération du neurotransmetteur par exocytose. Des mutations de ces canaux calciques voltage-dépendants ont donné plusieurs modèles murins d’épilepsie généralisée, notamment la souris dite « tottering », porteuse d’une mutation des canaux calciques de type P/Q (Bomben et al., 2016).
Dans les cellules musculaires, l’entrée de Ca2+ dans le cytosol en provenance de l’extérieur de manière voltage-dépendant déclenche une autre entrée provenant du réticulum sarcoplasmique (le réticulum endoplasmique lisse particulier des cellules musculaires) via les récepteurs à ryanodine RyR (de type L) qui se trouvent dans la membrane du réticulum sarcoplasmique. Leur ouverture est déclenchée par des concentrations micromolaires d’ions Ca2+ ou expérimentalement par la ryanodine (un alcaloïde végétal) ou la caféine.
Deux isoformes de RyR ont été identifiées selon les types cellulaires :
- RyR1 dans les muscles striés squelettiques
- RyR2 dans le myocarde.
Cet apport de Ca2+ supplémentaire dans le cytosol est nécessaire à la contraction musculaire. En effet, le Ca2+ se lie de manière réversible à la troponine, ce qui entraîne le déplacement du complexe troponine-tropomyosine et permet le glissement des filaments épais et fins (myosines et microfilaments respectivement).
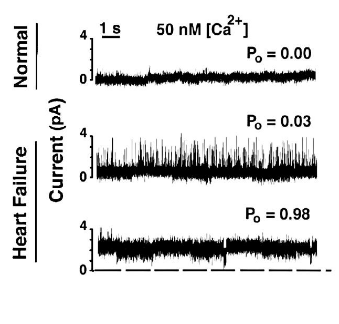
Dans l’insuffisance cardiaque, les RyR peuvent être dysfonctionnels en raison de modifications post-traductionnelles qui aboutissent à une fuite d’ions Ca2+ du réticulum sarcoplasmique vers le cytosol, ce qui perturbe la succession contraction-relâchement des cardiomyocytes et aussi leur métabolisme. (Marx et al., 2000).
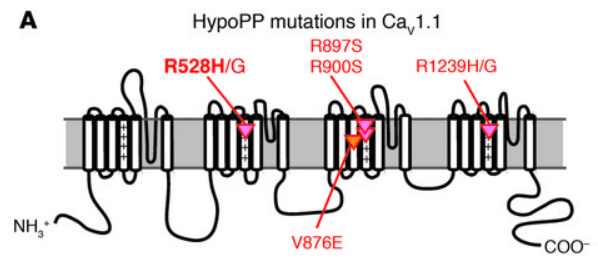
De manière similaire, dans certains cas de paralysie hypokalémique, des canaux calciques à la membrane plasmique des cellules musculaires striés squelettiques laissent entrer du calcium, même sans dépolarisation (Wu et al., 2012).
L’entrée du Ca2+ dans le cytosol peut aussi être « accidentelle » comme dans le cas où l’axone d’un neurone est endommagé voire sectionné. Dans ce cas, le calcium joue un rôle dans la réparation. Dans les neurones en cutlture d’aplysie (un gastéropode modèle en neurosciences), le calcium au site de la lésion stimule la fromation d’un nouveau cône de croissance en quelques minutes (Ziv et al., 1997). Dans les neurones périphériques des mammifères, le calcium local via la protéine kinase C (PKC) active le remodelage des microtubules près du site de la lésion pour faciliter la croissance (Cho et al., 2012). Les signaux calciques se propagent également à l’écart du site de la lésion axonale ce qui permet d’activer une réponse plus globale. Une vague de calcium élevé s’éloignant du site endommagé de l’axone vers le corps cellulaire du neurone a été visualisée chez le nématode C. elegans et les Mammifères (Mandolesi et al., 2004). Les canaux calciques voltage-dépendants sont nécessaires à l’augmentation générale du calcium induite par la lésion et le blocage des ces canaux réduit les capacités de régénération de l’axone (Sattler et al., 1996; Kulbatski et al., 2004).
Une autre possibilité d’ouverture de canaux calciques provient de stimuli mécaniques. Les protéines mécanosensibles sont essentielles pour détecter ces stimuli et activer en réponse une cascade biochimique, ce qu’on appelle une mécanotransduction. Une famille importante de mécanosenseurs est constituée de canaux ioniques mécanosensibles, qui sont des structures protéiques formant des pores localisées dans la membrane plasmique cellulaire et la membrane de certains organites (réticulum endoplasmique, endosomes et lysosomes). La majorité des canaux ioniques mécanosensibles ont une spécificité élevée pour les ions Ca2+, par conséquent, ils sont souvent appelés canaux Ca2+ activés par étirement. Parmi les canaux mécanosensibles qui font rentrer des ions Ca2+ citons les protéines Piezo.
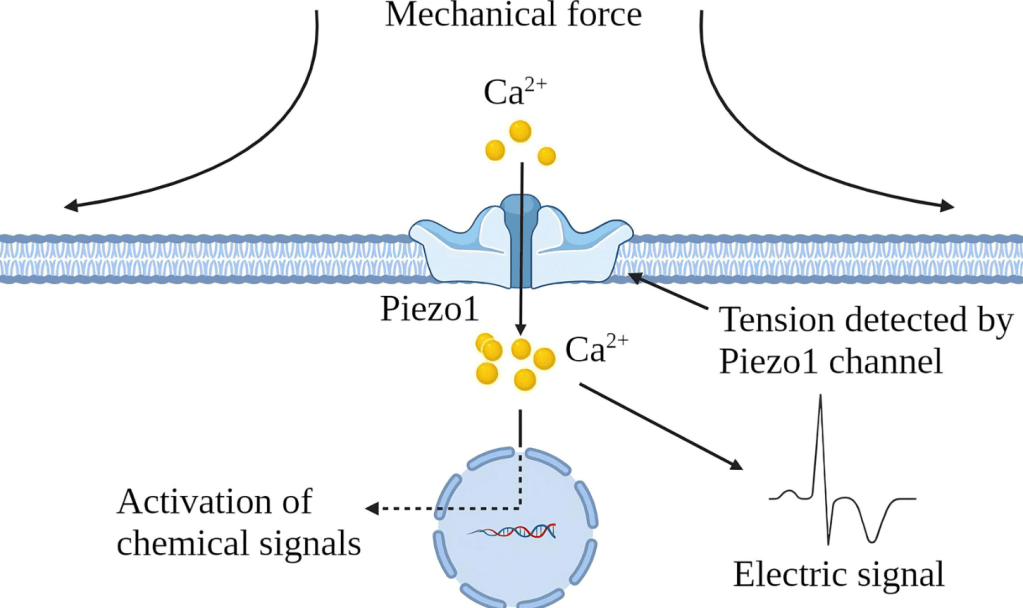
Par exemple, dans les cellules musculaires lisses des vaisseaux sanguins, l’entrée de Ca2+ qui aboutit à leur contraction est stimulée en partie par l’étirement, qui est ressenti par Piezo1 et aussi par une autre famille de canaux mécano-dépendants, les TRP (Li et al., 2015).
Les cellules végétales peuvent aussi exprimer des canaux calciques mécano-dépendant tels que DEK1 (pour Defective Kernel 1) qui est essentiel pour le développement embryonnaire chez Arabidopsis (Tran et al., 2017).
En aval du Ca2+ cytosolique
Les ions Ca2+ peuvent se fixer par des liaisons faibles sur des sites précis de certaines protéines et modifier leur conformation, ce qui aboutit à des modifications de leur fonction.
L’une des principales cibles des ions Ca2+ est la calmoduline. La calmoduline est une protéine ubiquitaire chez les Eucaryotes et dont la séquence est très conservée dans l’évolution, ce qui montre son importance. Il s’agit d’une petite protéine globulaire constituée d’une chaine peptidique de 148 acides aminés. Elle contient des séquences riches en aspartates et en glutamates, des acides aminés chargés négativement. Cette séquence forme des domaines appelés EF-hand de type hélice-boucle-hélice qui complexent les ions Ca2+. La complexation de ces ions par la calmoduline entraine un changement de conformation de la protéine qui prend alors une forme d’haltère où les deux domaines C-terminal et N-terminal de la protéine sont éloignés. Ces changements sont cependant réversibles lorsque la protéine est déchargée de ses ions calcium.
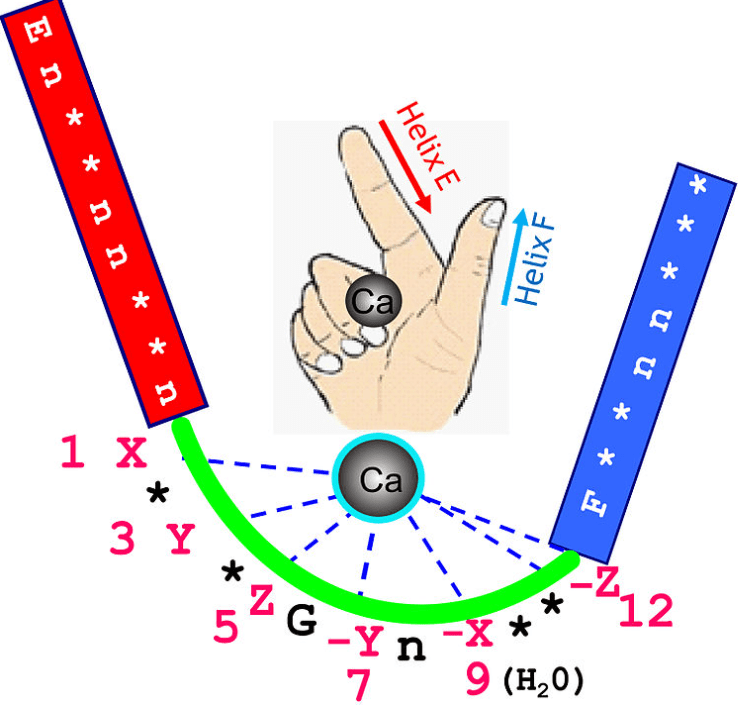
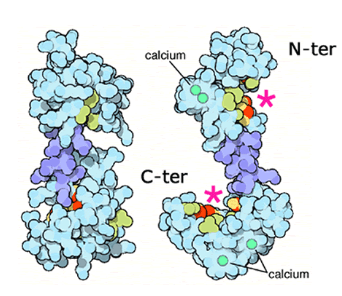
Le passage de la calmoduline en conformation active en présence d’ions Ca2+ permet de révéler une surface hydrophobe qui lui permet d’interagir avec ses protéines-cibles. Des analyses protéomiques ont révélé que le répertoire de ces cibles est très vaste, reflétant le rôle central de la calmoduline dans la régulation de multiples voies de signalisation intracellulaire. *
Parmi les cibles majeures de la calmoduline figurent diverses protéines kinases et phosphatases. Citons la kinase de la chaîne légère de la myosine (MLCK) et la protéine kinase II dépendante du Ca²⁺/calmoduline (CaMKII). Ces enzymes régulent à leur tour de nombreux processus cellulaires, notamment la motilité cellulaire, la plasticité synaptique et le métabolisme. Notamment, CaMKII est impliqué dans la LTP (Long-Term Potentiation), une augmentation persistante de l’efficacité de la transmission synaptique entre deux neurones suite à une stimulation synaptique intense ou répétée. C’est un mécanisme clé de la plasticité synaptique, considéré comme l’un des fondements cellulaires de l’apprentissage et de la mémoire. Dans l’hippocampe, l’induction de la LTP dépend fortement de l’entrée de calcium dans le neurone CA1 postsynaptique. Cette entrée s’effectue principalement via les récepteurs NMDA, qui sont activés lors d’une dépolarisation suffisante de la membrane postsynaptique après libération du glutamate par les neurones CA3. L’entrée de calcium dans la cellule active la CaMKII par liaison au complexe calcium-calmoduline. Une fois activée, CaMKII se regroupe aux synapses stimulées de façon spécifique et phosphoryle divers substrats, dont le récepteur AMPA, augmentant leur insertion et leur efficacité synaptique, et favorisant ainsi la transmission synaptique renforcée caractéristique de la LTP.
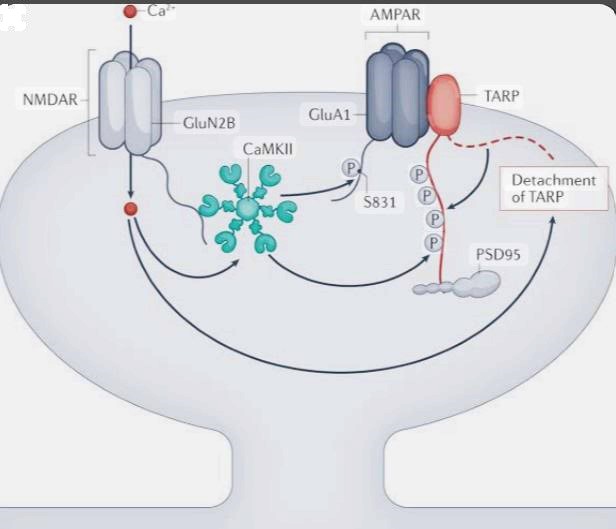
Lors d’une stimulation synaptique intense, le récepteur NMDA (NMDAR) laisse entrer du calcium (Ca²⁺) dans le neurone postsynaptique. Cette entrée de Ca²⁺ active la calmoduline puis la protéine kinase CaMKII (Calcium/Calmodulin-dependent protein kinase II), qui est alors capable de phosphoryler différents substrats. CaMKII phosphoryle d’une part la sous-unité GluA1 du récepteur AMPA (AMPAR), notamment au site S831, ce qui augmente la conductance du canal et favorise le ciblage et la rétention des récepteurs AMPA dans la densité post-synaptique. D’autre part, CaMKII phosphoryle les protéines TARPs (Transmembrane AMPAR Regulatory Proteins), associées aux récepteurs AMPA, entraînant leur attachement à la protéine d’ancrage PSD-95 dans la densité post-synaptique, renforçant la transmission synaptique, caractéristique de la LTP. Les ions Ca2+ seuls ont, au contraire, un effet de détachement des TARP de PSD-95 lorsque la stimulation n’est pas suffisamment forte pour activer CamKII. Source : https://www.nature.com/articles/s41583-022-00624-2
CamKII est aussi indirectement impliqué dans la régulation de la transcription dans les cellules musculaires striées squelettiques. Elle est activée par les ions Ca2+ à proximité de la synapse neuromusculaire et phosphoryle la myogénine qui se déplace ensuite et bloque la transcription des gènes codant les récepteurs à l’acétylcholine dans les noyaux éloignés de la synapse (la cellule musculaire striée squelettique possède plusieurs noyaux car issue d’une fusion de plusieurs cellules).
Une autre cible importante de la calmoduline activée par le Ca2+ est la calcineurine qui est une phosphatase composée de deux sous-unités : une catalytique et une régulatrice. La calcineurine est essentielle dans la régulation de facteurs de transcription comme NFAT (NFAT phosphorylée se trouve dans le cytoplasme et ne peut rentrer dans le noyau qu’une fois déphosphorylée par la calcineurine). NFAT joue un rôle important dans la réponse immunitaire, le développement musculaire et la communication neuronale. L’activité de la calcineurine peut être inhibée par des immunosuppresseurs comme la ciclosporine et le tacrolimus, fréquemment utilisés lors de transplantation d’organes.
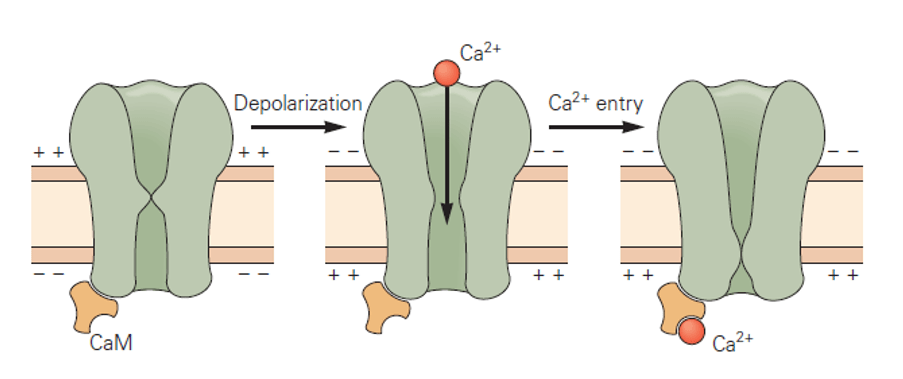
La calmoduline interagit également avec divers récepteurs cellulaires et canaux ioniques, modulant ainsi leur activité et leur signalisation. Parmi ceux-ci figurent des canaux Ca2+ voltage-dépendants (de type L et N) que la calmoduline liée au Ca2+ ferme, ce qui constitue une boucle de rétroaction négative (Peterson et al., 1999; Johny et al., 2013). La modulation par la calmoduline limite les entrées excessives de Ca²⁺ dans les neurones, ce qui est important pour prévenir la neurodégénérescence.
La famille des calpaïnes (CAPN) est un groupe de protéases à cystéine (CAPN1–16 chez l’homme et la souris) qui constitue une autre famille de protéines dont l’activation dépend du Ca2+. Les mutations génétiques des calpaïnes chez l’homme et la souris conduisent à des phénotypes pathologiques (appelées calpainopathies) suggérant leur importance physiologique. Certaines calpaïnes sont exprimées de manière ubiquitaires, d’autres de manière plus spécifique comme la calpaïne-3 qui est exprimée dans les muscles et interagit avec la titine. Des mutations perte-de-fonction de cette protéine aboutissent à la dystrophie musculaire des ceintures de type 2A. Selon les contextes cellulaires, certaines calpaïnes peuvent stimuler la traduction, notamment dans les épines dendritiques en relation avec la plasticité synaptique.
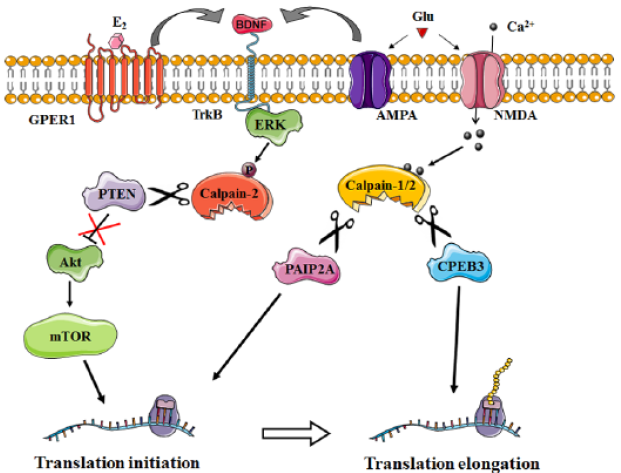
extracellulaires, dont le BDNF, l’E2 (l’estradiol) et le glutamate, notamment via ses récepteurs NMDA qui font rentrer des ions Ca2+, peuvent déclencher
l’activation de la calpaïne-1 et de la calpaïne-2. Cela entraîne le clivage de PAIP2A et CPEB3, qui inhibaient respectivement l’initiation et l’élongation de la traduction. D’autre part, l’activation de la calpaïne-2 médiée par ERK
entraîne le clivage et l’inactivation de PTEN ce qui enlève une inhibition de la voie Akt/mTOR qui contribue également à la stimulation de l’initiation de la traduction. On voit sur cet exemple que des calpaïnes peuvent être activées par phosphorylation et pas seulement pas des ions Ca2+. Source : https://www.researchgate.net/publication/303325613_Calpains_Master_Regulators_of_Synaptic_Plasticity
Une hausse du Ca2+ cytosolique provoque souvent une exocytose de vésicules pré-assemblées près de la membrane plasmique (secrétion de neurotransmetteurs, exocytose des granules corticaux après la fécondation…). Pour l’exocytose des vésicules contenant des neurotransmetteurs à la synapse, Ca2+ interagit essentiellement avec la synaptotagmine. Les synaptotagmines sont des protéines membranaires possédant une seule région transmembranaire N-terminale qui les ancre à la vésicule synaptique. La région cytoplasmique de chaque synaptotagmine est principalement composée de deux domaines C2, qui sont un motif protéique de liaison au Ca2+. Ces domaines C2 se lient aussi aux phospholipides membranaires ce qui permet de coupler la fixation du Ca2+ avec la fusion des membranes de la vésicule synaptique et de la membrane plasmique.
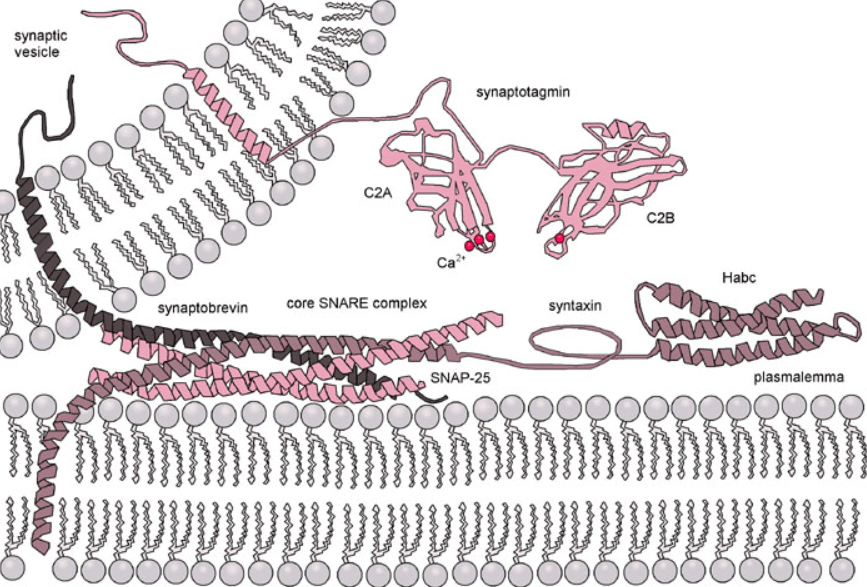
Les synaptotagmines-1, -2 et -9 sont des capteurs de Ca2+ pour la fusion rapide et synchrone des vésicules. En revanche, la synaptotagmine-7 intervient dans une forme plus lente d’exocytose déclenchée par le Ca2+, importante pour la transmission synaptique pendant les périodes prolongées d’activité et de déclenchement répété du potentiel d’action. Toutes ces synaptotagmines fonctionnent également comme capteurs de Ca2+ dans d’autres formes d’exocytose, telles que l’exocytose des cellules endocrines (sécrétion de l’insuline par les cellules β des îlots de Langerhans du pancréas par exemple).
L’α‑latrotoxine est une neurotoxine présynaptique produite par les araignées veuve-noires qui provoque une libération massive de neurotransmetteurs au niveau des synapses, en particulier des jonctions neuromusculaires. L’α‑latrotoxine est une grosse protéine de 120 kDa qui se fixe sur des récepteurs spécifiques de la membrane présynaptique, principalement les latrophilines (récepteurs couplés aux protéines G) et certaines neurexines. Après fixation, plusieurs molécules de latrotoxine oligomérisent et s’insèrent dans la membrane présynaptique pour former un pore. Ce pore se comporte comme un canal cationique très perméable au calcium, permettant une entrée massive de Ca²⁺ dans le bouton synaptique. L’augmentation brutale de la concentration de Ca²⁺ cytosolique active de façon incontrôlée la machinerie d’exocytose des vésicules synaptiques. Il en résulte une décharge explosive de neurotransmetteurs (acétylcholine, mais aussi noradrénaline, etc.), suivie d’un épuisement des vésicules et d’une perturbation durable de la synapse.
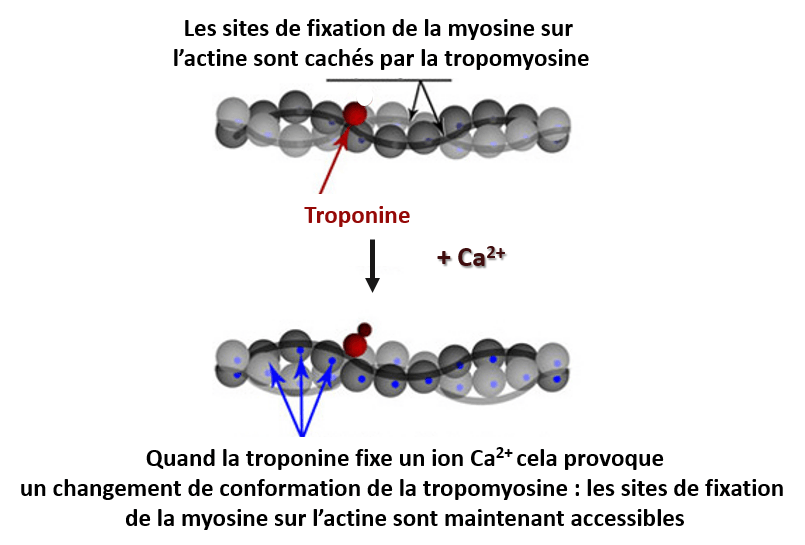
Dans les cellules musculaires striés, les ions Ca2+ se fixent sur la troponine ce qui provoque la contraction musculaire. En absence de Ca²⁺, le complexe troponine-tropomyosine bloque les sites de liaison de la myosine sur les filaments d’actine, empêchant ainsi l’interaction actine-myosine et la contraction musculaire. Lorsqu’une concentration suffisante de Ca²⁺ est présente dans le cytoplasme, les ions calcium se lient à la troponine, provoquant un changement de conformation du complexe. Cela déplace la tropomyosine, libérant les sites de liaison sur l’actine, ce qui permet son interaction avec la myosine et donc la contraction musculaire.
Nous avons vu que l’augmentation de la concentration en Ca2+ cytosolique a des conséquences importantes mais la baisse concomitante de Ca2+ dans la lumière du réticulum endoplasmique (RE) qui est la conséquence de son passage dans le cytosol a aussi des conséquences. Un stress du RE se produit car l’épuisement du Ca2+ du RE interfère avec le repliement correct des protéines dans le RE. Le stress du RE active principalement des voies de signalisation cytoprotectrices appelées UPR pour Unfolded Protein Response (Xu et al., 2005).
Une régulation fine des flux de Ca2+ dans les mitochondries est nécessaire au maintien des fonctions liées au métabolisme (production d’ATP), à l’homéostasie redox et aussi à l’équilibre prolifération/apoptose. L’activité de la pyruvate déshydrogénase, de l’isocitrate déshydrogénase et de l’α-cétoglutarate déshydrogénase (dans le cycle de Krebs), ainsi que l’activité du complexe respiratoire dépend de la concentration en Ca2+ mitochondrial (Glancy et Balaban, 2012).
Contrôle de la sortie du Ca2+ cytosolique
Le maintien d’une faible concentration de calcium libre dans le cytosol est essentiel pour la viabilité cellulaire, car un excès de Ca²⁺ est cytotoxique. Également, dans les muscles striés squelettiques, les ions Ca2+ doivent être sortis du cytoplasme pour éviter que les muscles restent contractés en permanence. Après une élévation transitoire du calcium cytosolique, la cellule doit rapidement rétablir l’homéostasie calcique. Cela est aussi nécessaire pour que la montée de concentration calcique cytosolique que nous avons vue plus haut reste bien un signal disponible pour la cellule.
L’ATPase de transport de Ca2+ sur la membrane plasmique (PMCA), l’échangeur Na+/Ca2+ (NCX), la Ca2+-ATPase du réticulum sarco/endoplasmique (SR/ER) (SERCA) et le transporteur mitochondrial de Ca2+ (MCU) maintiennent la concentration en Ca2+ dans le cytosol à un niveau bas normal. Ils interviennent également pour ramener les concentrations de Ca2+ cytosolique à la normale après une entrée de Ca2+.
Les pompes à calcium PMCA transportent deux ions Ca2+ pour chaque molécule d’ATP hydrolysée, avec deux protons transportés dans la direction opposée. L’échangeur Na+/Ca2+ utilise l’énergie potentielle du gradient électrochimique de Na+ pour transporter le Ca2+ hors d’une cellule. Cela coûte indirectement de l’énergie car de l’ATP est hydrolysé pour maintenir le gradient de Na+.
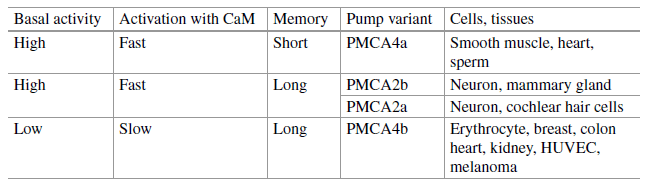
Plus de 20 isoformes de PMCA (codés par 4 gènes ATP2B et avec des épissages alternatifs), avec des propriétés différentes, des expressions cellulaires spécifiques et différentes localisations et interactions avec les molécules de signalisation, maintiennent non seulement l’homéostasie du Ca2+, mais également façonnent l’amplitude et la durée des signaux Ca2+. Des mutations ou des variations génétiques dans les gènes PMCA ont été associées à des maladies comme l’hypertension, la prééclampsie et des troubles neuronaux. C’est la partie C-terminale qui contient des domaines qui régulent l’activité des PMCA, notamment celui qui permet de lier la calmoduline qui active la sortie de Ca2+ via les PMCA. La calmoduline étant elle-même activée par une importante quantité d’ions Ca2+ dans le cytosol, il s’agit d’une boucle de rétroaction négative. La région C-terminale des PMCA contient aussi le domaine d’auto-inhibition qui chevauche le domaine de liaison à la calmoduline (Verma et al., 1994). L’étendue de l’autoinhibition diffère d’une isoforme à l’autre et également l’efficacité de l’action de la calmoduline car il y a une compétition entre l’autoinhibition et l’activation par la calmoduline.
Les Ca2+-ATPase du réticulum sarco/endoplasmique (SR/ER) (SERCA) peuvent être très abondantes et représenter jusqu’à 90% des protéines membranaires du réticulum sarcoplasmique (les cellules non musculaires en possèdent moins). Douze isoformes de protéines SERCA codées par trois gènes, sont exprimées dans différents tissus. Elles possèdent 10 hélices α transmembranaires.
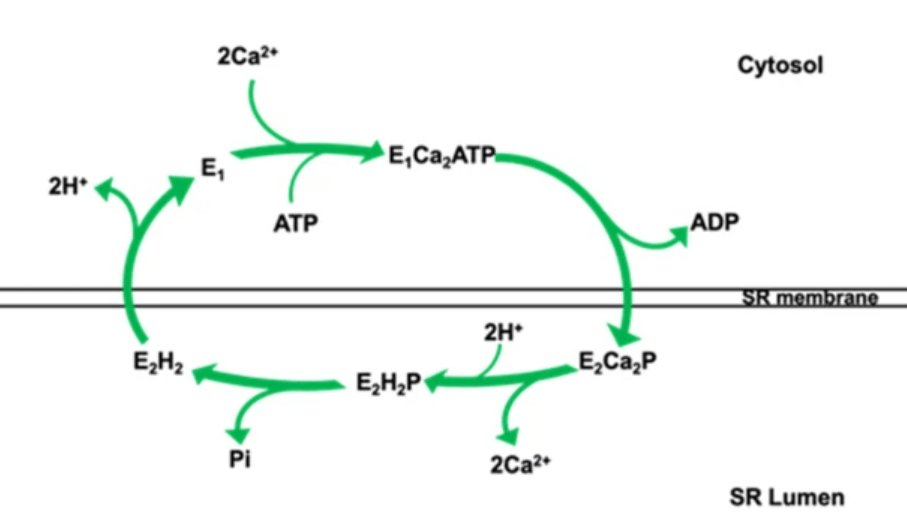
Une homéostasie du Ca2+ et une signalisation du Ca2+ altérées causées par un dysfonctionnement des pompes SERCA sont impliqués dans la maladie de Darier et dans certains troubles neurodégénératifs.
Dans les cellules végétales, la vacuole joue aussi un rôle majeur dans la séquestration du Ca²⁺ grâce à des pompes et échangeurs spécifiques, participant ainsi à la régulation du calcium cytosolique.
La signalisation calcique et la fécondation
Lors de la fécondation chez les Mammifères, l’entrée du spermatozoïde provoque une dépolarisation membranaire et une succession de pics de concentration en Ca2+ cytoplasmique (qui activent la protéine kinase dépendante de la calmoduline CaMKII (Knott et al., 2006)). Ces hausses de concentration calcique dépendent de PLC-ζ (PLC-zeta), une phospholipase C apportée par le spermatozoïde qui clive PI(4,5)P2 et permet de produire IP3 (inositol-triphosphate) qui active le sortie du Ca2+ du réticulum endoplasmique vers le cytosol (Wakai et al., 2011).
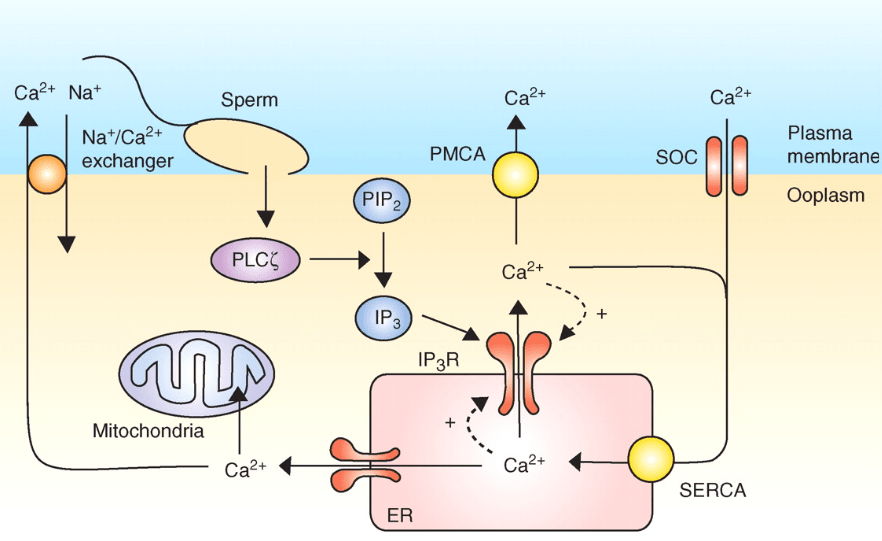
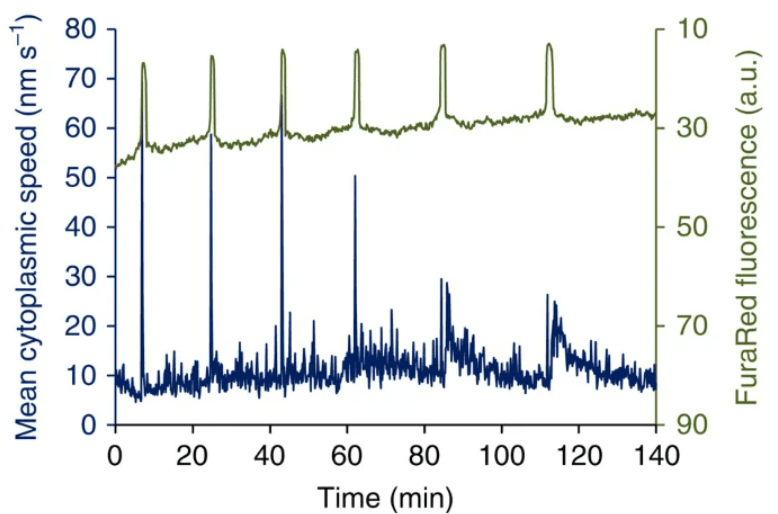
Une très forte concentration en Ca2+ cause la fermeture des canaux Ca2+ du réticulum endoplasmique et un repompage se fait. Ce rétrocontrôle négatif contribue à la deuxième partie du pic du signal calcique. Plusieurs pics se succèdent par le jeu successif des retrocontrôle positifs et négatifs. Ces pics calciques provoquent l’exocytose des granules corticaux et le déblocage de la méiose (dans ce dernier cas par stimulation de la dégradation du CSF (CytoStatic Factor). La méiose se termine avec l’expulsion du deuxième globule polaire.
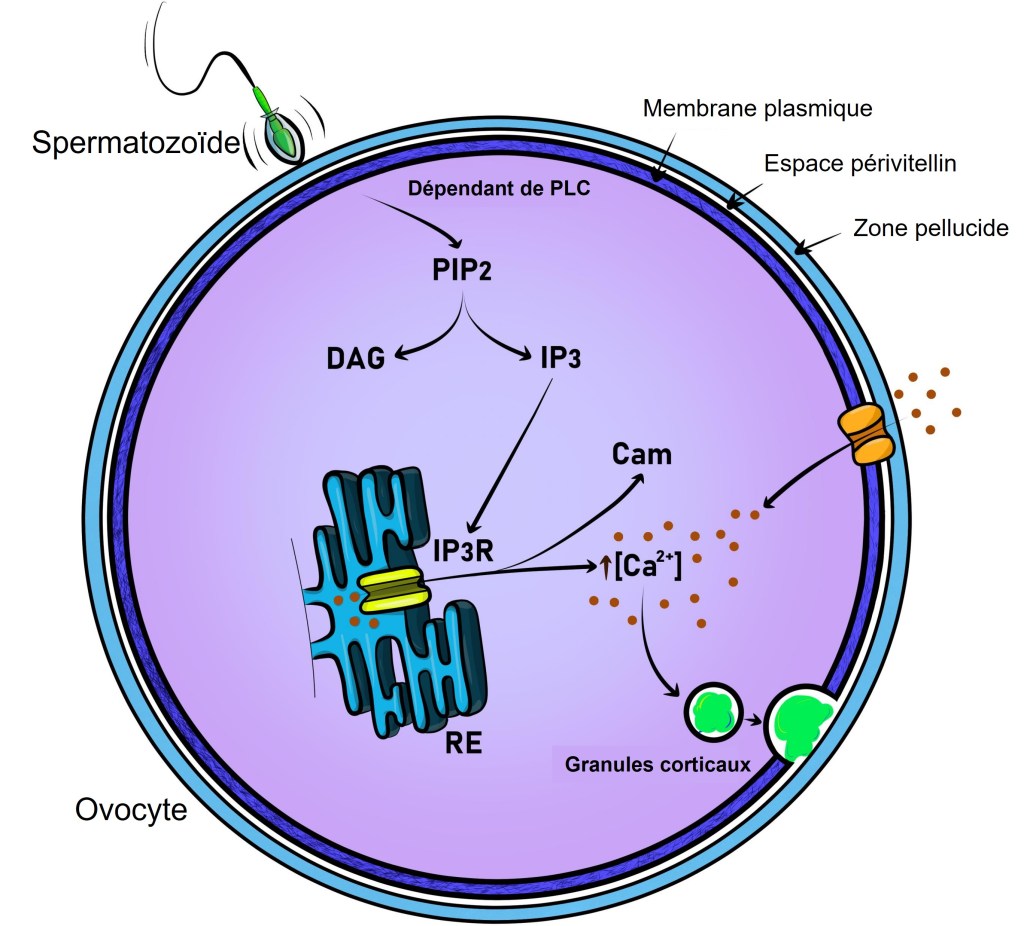
Chez la souris, seuls 4 pics calciques sont nécessaires pour déclencher l’exocytose des granules corticaux mais il en faut au moins 8 pour faire redémarrer la méiose (Ozil et al., 2005). Les enzymes dans les granules corticaux clivent les protéines ZP de la zone pellucide. Par exemple, la protéase ovastacine clive ZP2 qui perd sa capacité à interagir avec les spermatozoïdes. On observe aussi des mouvements cytoplasmiques rythmés qui dépendent de l’interaction actine-myosine et des pics de concentrations en Ca2+. Le blocage de ces mouvements cytoplasmiques aboutit à des développements anormaux mais leur fonction précise n’est pas encore claire (Ajduk et al., 2011).
La signalisation calcique et la fermeture des stomates
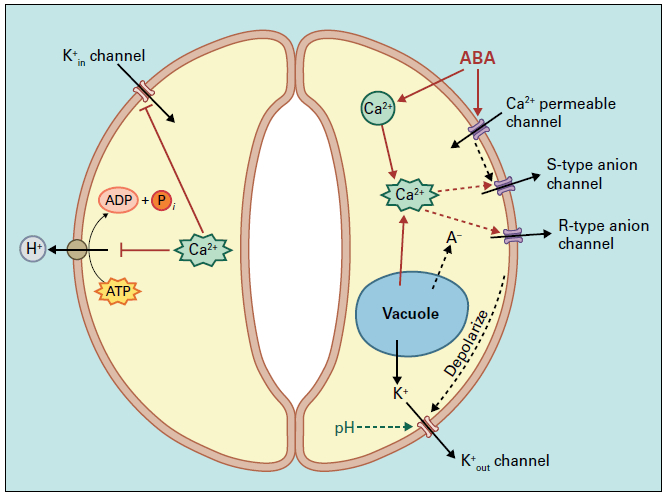
Les ions Ca2+ jouent un rôle de second messager important dans la fermeture des stomates en réponse à un stress hydrique médié par l’acide abscissique (ABA).
L’ABA induit une élévation transitoire ou oscillatoire du Ca2+ cytosolique dans les cellules de garde. Le calcium inhibe les canaux potassiques K+in responsables de l’entrée de potassium, qui sont importants pour l’ouverture des stomates. Les ions Ca2+ activent des canaux anioniques de type S (lents), entraînant une sortie d’anions (Cl–, NO3–), provoquant une dépolarisation membranaire qui favorise la sortie de K+ via les canaux externes K+out ce qui provoque la sortie des ions puis de l’eau de la vacuole et la perte de turgescence des cellules de garde. Le Ca2+ active aussi des protéines kinases dépendantes du calcium (CDPK), qui à leur tour phosphorylent des protéines cibles participant à la fermeture.
EN DIRECT DES LABOS :
