Par Patrick Pla, Université Paris-Saclay
- Aspects historiques
- Croissance et guidage du tube pollinique
- Les barrières à la fécondation
- Le gamétophyte femelle
- Déroulement de la double fécondation
Aspects historiques
Les étamines sont considérées pour la première fois comme les organes mâles de la fleur par Grew (1682). Camerarius (1694) a remarqué qu’un mûrier femelle, à proximité duquel aucun plant mâle ne poussait, ne produisait que des graines stériles. Inspiré par cette observation, il la généralisa à d’autres espèces et en conclut que les anthères sont les organes sexuels mâles et l’ovaire, avec son
style, l’organe sexuel femelle. Kolreuter (1761) a réalisé plusieurs expériences sur la sexualité des plantes et a mis en évidence le rôle des insectes dans la pollinisation. Il a également remarqué que seuls les grains de pollen de la même espèce étaient efficaces pour la fécondation. Le mérite de la découverte du tube pollinique revient à Amici (1824), un mathématicien italien, astronome et fabricant de microscopes méticuleux. Il a conclu que le tube pollinique, après être sorti du grain de pollen, s’allonge petit à petit et entre finalement en contact avec les ovules, un tube pour chaque ovule. Le rôle du sac embryonnaire a donné lieu à une controverse entre Amici et Schleiden avec ce dernier qui pensait que l’embryon de la plante provenait exclusivement du développement de l’extrémité du tube pollinique. Amici a finalement démontré que l’ovule et en son sein le sac embryonnaire jouait un rôle fondamental, ce qui fut aussi confirmé par Hofmeister (1849).
Croissance et guidage du tube pollinique
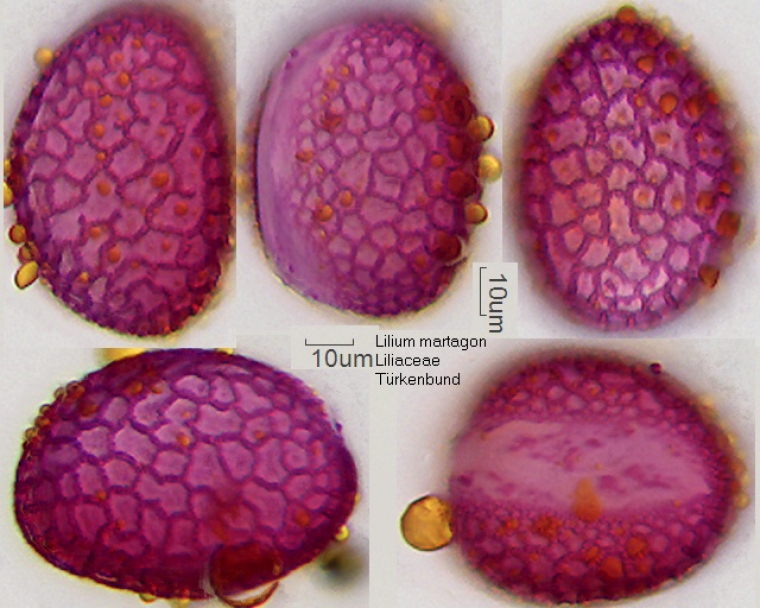
En guise d’introduction, rappelons que le pollen est un petit gamétophyte mâle. Il se développe au sein des étamines, l’organe reproducteur mâle des Angiospermes, qui est généralement constituée d’un filament en forme de tige et d’une anthère. La formation des microspores haploïdes (microsporogénèse) et le développement du pollen (microgamétogenèse) ont lieu dans l’anthère.
Chez les Angiospermes, les gamétophytes mâles sont en général tricellulaires constitués de cellules végétatives qui contiennent une paire de spermatozoïdes. Les deux spermatozoïdes sont entourés par la membrane plasmique végétative interne, une endomembrane qui provient de la membrane plasmique de la cellule végétative hôte. Cela reflète l’internalisation du précurseur du spermatozoïde au cours de la gamétogenèse mâle.
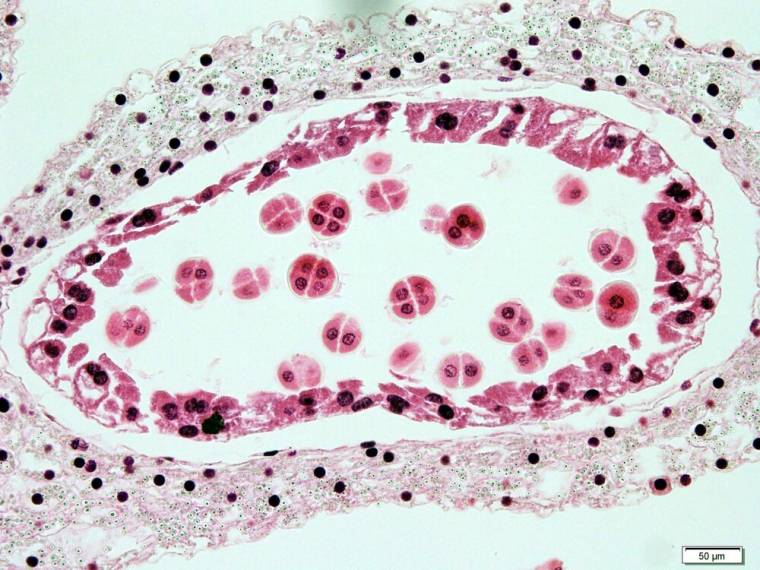

Les grains de pollen sont libérés de l’anthère à l’état déshydraté (vie ralentie). Selon la stratégie de reproduction de la plante, le pollen est transporté par le vent (anémogamie), les insectes (entogamie), les oiseaux ou même les chauves-souris frugivores vers d’autres fleurs, où il adhère au stigmate, l’extrémité réceptive souvent visqueuse du ou des carpelles.

Certaines espèces, comme Arabidopsis et le tournesol, ont des stigmates secs, et l’adhérence du pollen à la cellule papillaire stigmatique est assurée par des composants de l’exine pollinique. Néanmoins, dans tous les cas, il y a une réhydratation du pollen qui est nécessaire à son développement.
Après cette étape d’adhérence et de réhydratation, le grain de pollen reprend son métabolisme actif et émet le tube pollinique qui traverse les tissus du pistil pour atteindre l’ovule. Ce mode de fécondation par lequel un tube cellulaire apporte un gamète mâle jusqu’au gamète femelle s’appelle la siphonogamie (du latin sipho, «petit tube»).
Ce qu’on appelle l’unité germinale mâle est formée par un complexe de noyaux végétatifs et de spermatozoïdes. Après la germination du tube pollinique, l’unité germinale mâle est localisée dans la zone apicale du tube à environ 50–100 µm de l’extrémité et maintient la structure du triplet, gardant le noyau végétatif devant les spermatozoïdes.
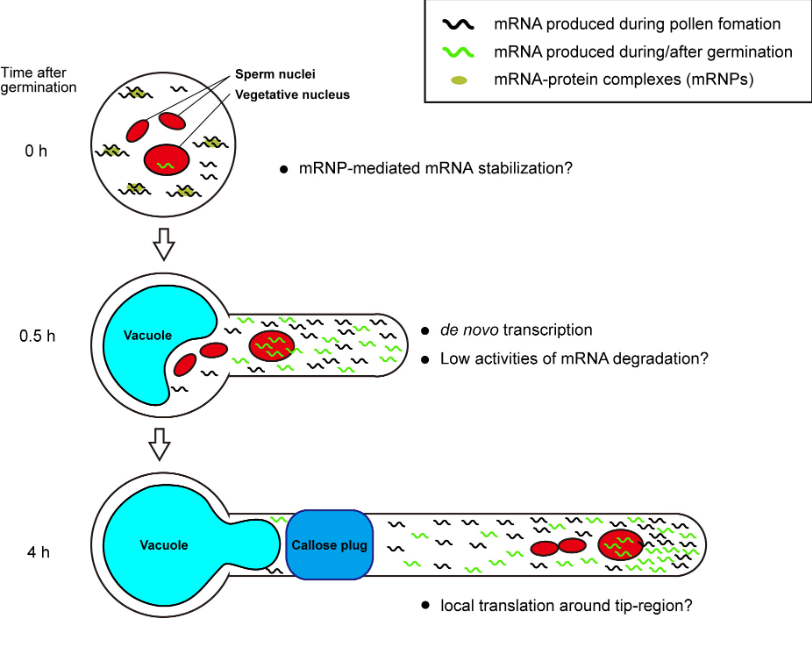
Durant sa croissance, le tube pollinique correspond à la cellule végétale qui s’allonge le plus rapidement (Sanati Nezhad et al., 2014) et chez Arabidopsis, la une vitesse de croissance peut atteindre 1 cm/h. Toute l’activité de croissance est restreinte au dôme apical du tube pollinique, ce qui fait que le tube pollinique est un modèle très étudié pour la régulation spatiale et temporelle de la croissance polarisée dans les cellules végétales. La croissance de l’extrémité du tube pollinique dépend de la pression de turgescence, du relâchement de la paroi cellulaire pour permettre l’expansion et d’un apport constant de matériaux de paroi cellulaire et de membrane pour l’incorporation à l’extrémité apicale.
À mesure que le tube pollinique se développe, son cytoplasme reste dans la zone située derrière l’extrémité apicale et des bouchons de callose se forment à intervalles réguliers pour obturer la partie restante du tube. Ces bouchons de callose sont produits par la callose synthase, dont le positionnement exact dépend des microtubules corticaux. La paroi des cellules polliniques est particulière et se divise en une paroi externe, composée principalement de pectines, et une paroi interne, contenant de la callose et de la cellulose, qui ne se dépose cependant qu’à une certaine distance de l’extrémité.
Les microfilaments d’actine sont essentiels à l’élongation rapide et polarisée des tubes polliniques. Leur perturbation par des inhibiteurs spécifiques (tels que la latrunculine B, la cytochalasine D ou un excès de profiline) entrave la croissance du tube pollinique (Vidali et al., 2001; Xu et al., 2020). La polymérisation de l’actine à l’extrémité du tube pollinique est une étape limitante de la croissance. Des protéines telles que les formines (par exemple, FH5) et les facteurs de dépolymérisation de l’actine régulent la nucléation et le renouvellement des microfilaments, établissant la structure d’actine subapicale nécessaire à la croissance efficace du tube (Cheung et al., 2010; Qu et al., 2017). Les protéines spécifiques de liaison à l’actine, comme CAP1, sont essentielles pour maintenir un approvisionnement en monomères d’actine compétents en polymérisation (Jiang et al., 2019).

Le dynamisme des microfilaments est sous le contrôle de GTPase de type Rho, ROP1 (Qin et Yang, 2011).

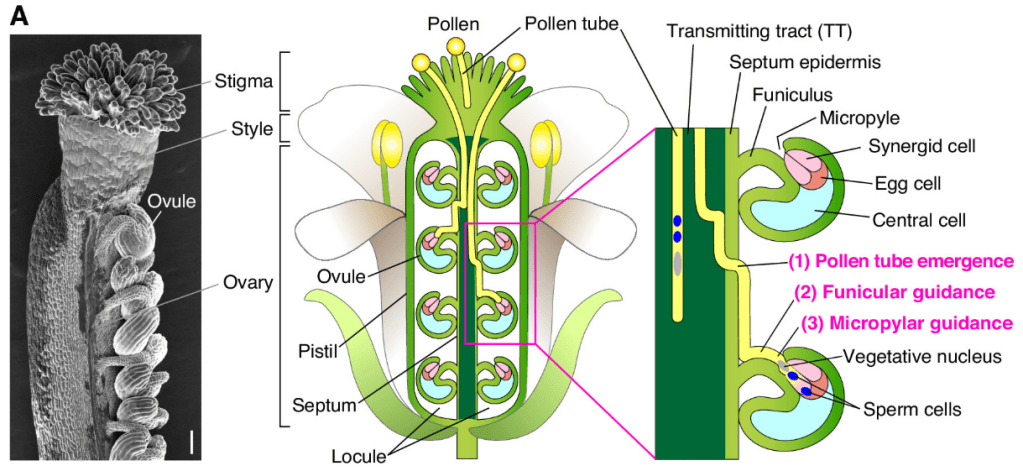
La croissance du tube pollinique est directionnelle et répond à divers signaux de guidage dans le pistil. La réorientation de la croissance peut être obtenue in vitro en exposant les tubes polliniques en croissance à des déclencheurs placés de manière asymétrique tels qu’un ovule isolé (Yetisen et al., 2011) ou un sac embryonnaire nu (Higashiyama et al., 1998) ainsi que des sources localisées d’agents attractifs et répulsifs (Prado et al., 2004; Horade et al., 2012).

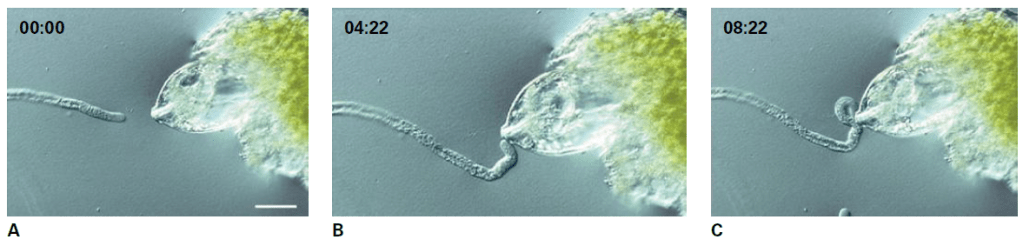
Les expériences d’ablation confirment que les cellules synergides sont à la fois nécessaires et suffisantes pour l’attraction du tube pollinique vers le gamétophyte femelle. Les synergides sécrètent de petites molécules sous l’induction non cellulaire autonome des cellules centrales pour attirer les tubes polliniques. Chez les mutants (tels que ceux présentant un défaut dans le facteur de transcription MYB98 qui contrôle la fonction sécrétoire synergique), l’absence de sécrétion adéquate de facteurs attractifs conduit les tubes polliniques à ne pas trouver le micropyle, ce qui entraîne un échec de la fécondation (Mizuta et al., 2018). Les synergides sécrètent notamment des peptides appelés LURE qui sont perçus par des récepteurs à activité kinase exprimées dans les tubes polliniques, puis transduites vers des machineries de croissance intracellulaire telles que de petites GTPases et le cytosquelette, qui sont régulées par un gradient de Ca2+ (Krichevsky et al., 2007; Steinhorst et al., 2013).
Les barrières à la fécondation

Environ 70 % des Angiospermes ont des fleurs hermaphrodites avec des organes mâles et femelles. On peut donc penser que l’autogamie est majoritaire. Ce n’est pas le cas.
En effet, les interactions pollen-pistil créent non seulement une série de barrières d’hybridation interspécifiques mais aussi peuvent restreindre la reproduction entre plantes d’une même espèce mais génétiquement trop proches (on parle alors d’auto-incompatibilité et c’est bien sûr un des freins majeurs à l’autofécondation chez les fleurs qui sont hermaphrodites). La surface des cellules du stigmate, qui sert de site récepteur aux grains de pollen est le point initial de détermination de la compatibilité. L’adhésion du pollen, son hydratation, sa germination, la pénétration du tube pollinique dans le stigmate et la croissance de ce tube dans le style, constituent d’importantes barrières.

causée par le locus d’auto-incompatibilité S chez Brassica.
(a) Un tube pollinique S1/S2 ne présente aucune croissance sur un stigmate S1/S2. (b) Il y a croissance du tube pollinique dans un stigmate S1/S2
croisé avec un pollen S3/S4.
Des recherches chez les Brassicacées ont révélé que le récepteur kinase stigmatique du locus S (SRK) contribue au rejet du pollen intraspécifique et interspécifique via une signalisation dépendante de FERONIA (FER) qui active la production les espèces réactives de l’oxygène (ROS) (Huang et al., 2023).

Chez Arabidopsis thaliana, STIGMATIC PRIVACY 1 (SPRI1), une protéine stigmatique, est impliquée dans l’établissement de l’incompatibilité interspécifique. Des découvertes récentes ont également montré que les peptides de classe B de la POLLEN COAT PROTEIN (PCP-B) portés par les PG compatibles sont reconnus par le récepteur stigmatique FER d’une manière spécifique à l’espèce, favorisant l’hydratation rapide du pollen conspécifique. Cependant, une hydratation brièvement retardée permet toujours la germination interspécifique du pollen et la pénétration/croissance des tubes, ne constituant donc pas une barrière stricte d’hybridation interspécifique/intergénérique.
Chez le pavot commun (Papaver rhoeas), le locus d’auto-incompatibilité du pistil code pour des protéines S de faible poids moléculaire qui déclenchent une voie de signalisation dépendant du Ca2+ dans le pollen incompatible. Il en résulte un arrêt rapide de la croissance du tube pollinique, une dépolymérisation de l’actine et l’activation d’une cascade de MAP kinases. Ces événements favorisent à leur tour l’apoptose, au cours de laquelle le cytochrome c miotchondrial s’échappe dans le cytosol, l’ADN est fragmenté et les métacaspases sont activées.

Le gamétophyte femelle
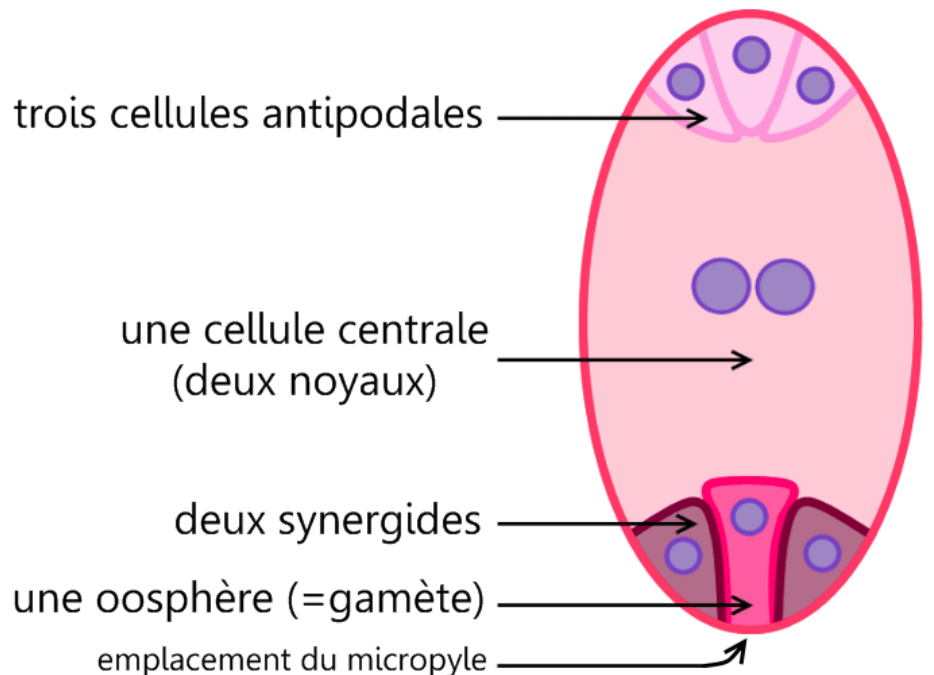
Pendant le développement de la fleur, un seul mégasporocyte subit la méiose et donne en général naissance à un seul macrospore (ou mégaspore) mature (les 3 autres dégénèrent rapidement sauf dans certains groupes comme chez Allium (ail) où 2 macrospores se développent). Dans la mégaspore, il y a plusieurs mitoses qui donnent 8 noyaux haploïdes :
- l’oosphère qui est le gamète
- 2 synergides
- une cellule centrale à deux noyaux
- 3 cellules antipodales

Déroulement de la double fécondation
Lors de la fécondation chez les Angiospermes, un noyau d’un spermatozoïde fusionne avec le noyau de l’oosphère pour former le zygote diploïde, qui se développe en embryon, tandis que le noyau de l’autre spermatozoïde fusionne avec les deux noyaux de la cellule centrale pour former un noyau triploïde,
à partir duquel se développe l’albumen (appelé endosperm en anglais), qui est un tissu de réserve.
Le sac embryonnaire sécrète des protéines (ex. ZmES4, une défensine-like) qui interagissent avec des canaux potassiques du tube pollinique. Cette interaction provoque un influx brutal d’ions K⁺ et d’eau, créant un déséquilibre osmotique qui rompt l’extrémité du tube pollinique, libérant les deux spermatozoïdes (Amien et al., 2010).

(A) Schéma du gamétophyte femelle (sac embryonnaire) du maïs, intégré dans les tissus maternels de l’ovule. Le tégument externe est noir, le tégument interne gris foncé et le nucelle gris clair. L’ovule (bleu-vert) est caché derrière les deux synergides et l’appareil filiforme est indiqué par une flèche blanche. (B) Micrographie fusionnée en fond clair et en UV montrant une vue oblique de la région micropylaire. Le tégument interne a été retiré. La protéine de fusion ZmES4-GFP, sous le contrôle du promoteur endogène, est localisée dans les cellules synergides, les signaux les plus forts étant situés autour de l’appareil filiforme (flèche). La flèche pointe vers les cinq à six empilements de cellules du nucelle micropylaires entourant l’appareil ovulaire. (C) Image UV améliorée de (B) montrant les signaux GFP les plus forts dans la zone sécrétoire des deux cellules synergides (flèches). Des vésicules sont visibles dans les extensions synergides de l’appareil filiforme (pointe de flèche). Des signaux plus faibles sont visibles dans la cellule centrale. Source : https://journals.plos.org/plosbiology/article?id=10.1371/journal.pbio.1000388
Après une double fécondation réussie, les synergides aident à prévenir l’attraction de tubes polliniques supplémentaires en inactivant la libération des signaux attractifs, via les voies de signalisation incluant FERONIA (FER) et LORELEI (LRE).
Chez les Gymnospermes, il n’y a pas de double fécondation. Il n’y a, en effet, pas de fusion des noyaux mâle conduisant à la formation d’un endosperme triploïde. Le tissu de stockage dans la graine des Gymnospermes est haploïde et correspond au mégagamétophyte modifié.
